
Билет №12.
Распределение
Больцмана.
Выведем
закон изменения давления с высотой,
предпологая, что поле тяготения однородно,
температура постоянна и масса всех
молекул одинакова. Если атмосферное
давление на высоте h равно p, то на высоте
h+dh оно равно p+dp (при dh>0 dp<0, так как
давление с высотой убывает). Разность
давлений p и p+dp равна весу газа, заключенного
в объеме цилиндра высотой dh с основанием
площадью 1 м2:
![]()
где
-
плотность газа на высоте h (dh насолько
мало, что при изменении высоты в этом
пределе плотность газа можно считать
постоянной). Следовательно,
![]()
Воспользовавшись
уравнением состояния идеального газа
pV=(m/M)RT (m - масса газа, M - молярная масса
газа), находим, что
![]()
Подставим плотность и получим
![]()
![]()
С изменением высоты от h1 до h2 давление изменяется от p1 до p2 т.е.
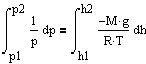
![]()
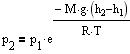
Выражение
называется барометрической
формулой.
Она позволяет найти атмосферное давление
в зависимости от высоты или, измерив
давление, найти высоту. Так как высоты
обозначаются относительно уровня моря,
где давление считается нормальным, то
выражение может быть записано в виде
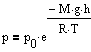
Барометрическую формулу можно преобразовать, если воспользоваться выжением p=nkT:
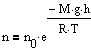
где n - концентрация молекул на высоте h, n0 - то же, на высоте h=0. Так как M=m0NA ((NA - постоянная Авогадро, m0 - масса одной молекулы), а R=kNA, то
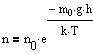 где
m0gh=
- потенциальная энергия молекулы в поле
тяготения, т.е.
где
m0gh=
- потенциальная энергия молекулы в поле
тяготения, т.е.
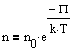
Полученное выражение называется распределением Больцмана для внешнего потенциального поля. Из него следует, что при постоянной температуре плотность газа больше там, где меньше потенциальная энергия его молекул.Если частицы имеют одинаковую массу и находятся в состоянии хаотического теплового движения, то распределения Больцмана справедливо в любом внешнем потенциальном поле, а не только в поле сил тяжести.
Закон Больцмана о распределении энергии по степеням свободы молекул: для статистической системы, находящейся в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднекинетическая энергия, равная kT/2, а на каждую колебательную степень свободы - в среднем энергия, равная kT.
Билет №13.
Распределение Максвелла. Распределение Максвелла задает распределение молекул газа по скоростям при их хаотическом темпловом движении. Случайные столкновения молекул при их движении в газе приводят к случайным же изменениям их скоростей как по величине, так и по направлению. Скорость молекул удобно изобразить точкой в 3-х мерном пространстве скоростей. Совокупность скоростей всех молекул газа заполнит пространсто скоростей с некоторой плотностью, пропорциональной плотносмти вероятности нахождения того или иного значения скорости. Вдоль любого направления в пространстве скоростей случайные отклонения в ту или иную сторону равновероятны, поэтому в качестве функции распределения для этого направления можно взять распределение Гаусса. Так как все направления равновероятны, то меры точности вдоль каждого из них должны быть одинаковыми, поэтому для функции распределения компонент скоростей имеем
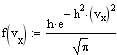
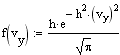

Ввиду независимости компонент скорости, пользуясь теоремой об умножении вероятностей, получаем
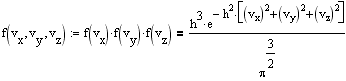
![]()
Среднее значения квадратов компонент скоростей одинаковы и равны <vx2> =<vy2> =<vz2> = 1/2h2. Средняя кинетическая энергия молекулы массой m равна 3kT/2, следовательно
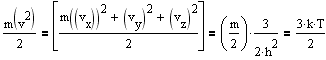
Откуда
![]()
Получим распределение Максвелла по компонентам скоростей:
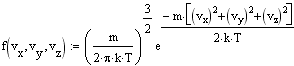
Для нахождения распределения молекул по модулю скорости перейдем в сферическую систему координат и, интегрируя по углам. найдем относилельное число молекул, обладающих скоростью от v до v+dv:
![]() ,
откуда получим функцию распределения:
,
откуда получим функцию распределения:
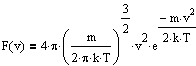 F(v)
называется распределением Максвелла
по модулю скорости v.
F(v)
называется распределением Максвелла
по модулю скорости v.
Задачу заменят!
Билет №14.
Капиллярные явления. Если поместить узкую трубку (капиляр) одним концом в жидкость, налитую в широкий сосуд, то вследствие смачивания или не смачивания жидкостью стенок капилляра кривизна поверхности жидкости в капилляре становится значительной. Если жидкость смачивает материал трубки, то внутри ее поверхность жидкости - мениск - имеет вогнутую форму, если не смачивает - выпуклую. Под вогнутой поверхностью жидкости появится отрицательное избыточное давление, определяемое по формуле p=-2/R. Наличие этого давления приводит к тому, что жидкость в капилляре поднимается, так как под плоской поверхностью жидкости в широком сосуде избыточного давления нет. Если же жидкость не смачивает стенки капилляра, то положительное избыточное давление приведет к опусканию жидкости в капилляре. Явление изменения высоты уровня жидкости в капиллярах называется капиллярностью. Жидкость в капилляре поднимается или опускается на такую высоту h, при которой давление столба жидкости (гидростатическое давление) gh уравновешивается избыточным давлением p, т.е. 2/R=gh, где - плотность жидкости, g - ускорение свободного падения. Елси r - радиус капилляра, - краевой угол, то h=(2cos)/(gh) Капиллярные явления играют большую роль в природе и технике. Например, влагообмен в почве и в растениях осуществляется за счет поднятия воды по тончайшим капиллярам. На капиллярности основано действие фитилей, впитывание влаги бетоном и т.д.
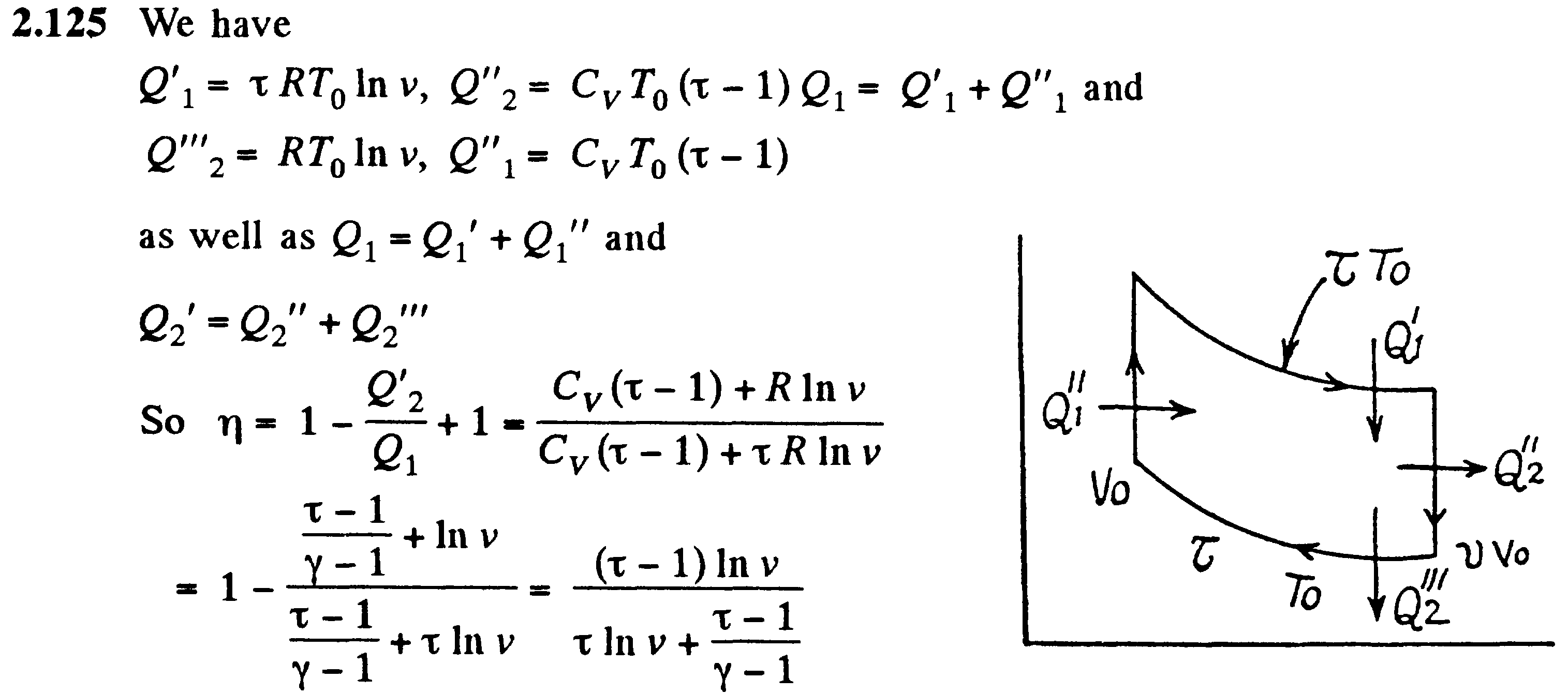
Билет №15.
Классическая молекулярно-кинетическая теория и ее ограниченность. Учение о свойстве вещества. 1) Все вещества состоят из мельчайших частиц. (Атомов и молекул) 2) Частицы вещества находятся в непрерывном движении. (Движутся хаотически) 3) Между частицами есть силы взаимодействия (притягивания и отталкивания) Потенциал Джонса U=a/r6--b/r12. Если Ek>Ep - газ. Ek<Ep - жидкость. Ek=Ep- твердое. P=1/3mV2 основное уравнение мкт.
![]()
Дж/К
![]() где n - концентрация
где n - концентрация
Уравнение состояния идеального газа.
![]() ,
,
![]() ,
,
![]() ,
,
![]()
Задача:
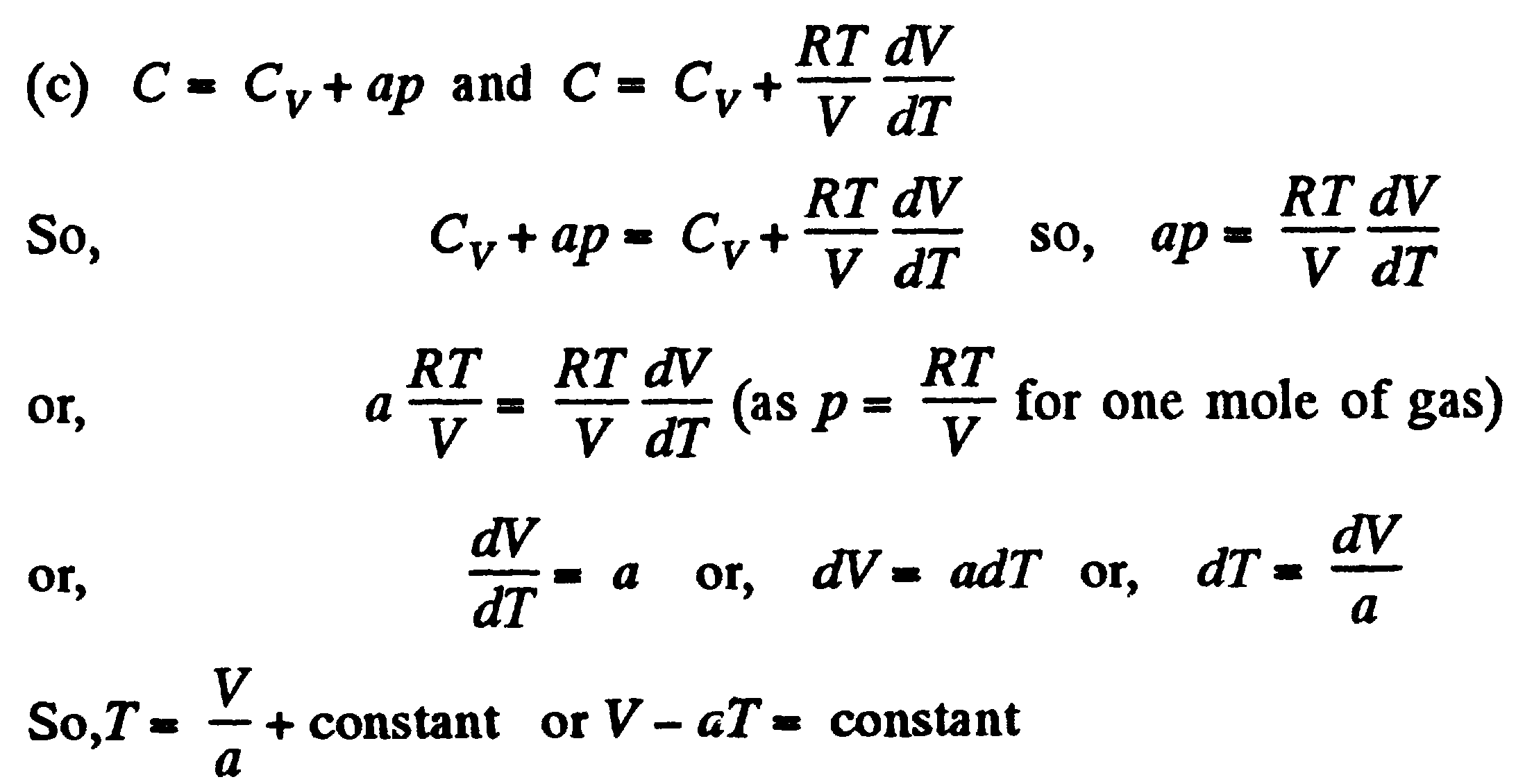
Билет №16.
Теплоемкость при постоянном объеме и давлении. Удельная теплоемкось вещества - величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К:
![]()
Единица удельной теплоемкости - джоуль на килограмм-кельвин (Дж/кг К) Молярная теплоемкость - величина, равная количеству теплоты, необходимому для нагревания 1 моль вещества на 1 К:
![]() где
=m/M
- количество вещества. Единица молярной
теплоемкости - джоуль на моль-кельвин.
Удельная
теплоемкость связана с молярным
соотношением: cm=cM,
где M - молярная масса вещесва.
где
=m/M
- количество вещества. Единица молярной
теплоемкости - джоуль на моль-кельвин.
Удельная
теплоемкость связана с молярным
соотношением: cm=cM,
где M - молярная масса вещесва.
Различают
теплоемкости при постоянном объеме и
постоянном давлении, если в процессе
нагревания вещества его объем или
давление поддерживается постоянным.
Запишем первое начало термодинамики
для 1 моль газа с учетом теплоемкости:
![]()
Если
газ нагревается при постоянном объеме,
то работа внешних сил равна нулю и
сообщаемая газу извне теплота идет
только на увеличение его внутренней
энергии:
![]()
т. е. молярная теплоемкость газа при постоянном объеме СV равна изменению внутренней энергии 1 моль газа при повышении его температуры на 1 К. Согласно формуле
![]() =(i/2)RdT,
тогда
=(i/2)RdT,
тогда
![]()
Если
газ нагревается при постоянном давлении,
то теплоемкость можно выразить в виде
![]()
Изходя
из выражения молярной теплоемкости при
постоянном объеме и дифференциальной
формы уравнения Клайперона - Менделеева
получим
![]()
Это
выражение называется уравнением Майера;
он показывает, что
![]() всегда больше
всегда больше
![]() на величину молярно газовой постоянной.
на величину молярно газовой постоянной.
Задача: В политропическом процессе pVn =const, где n – индекс политропа. Для этого процесса…
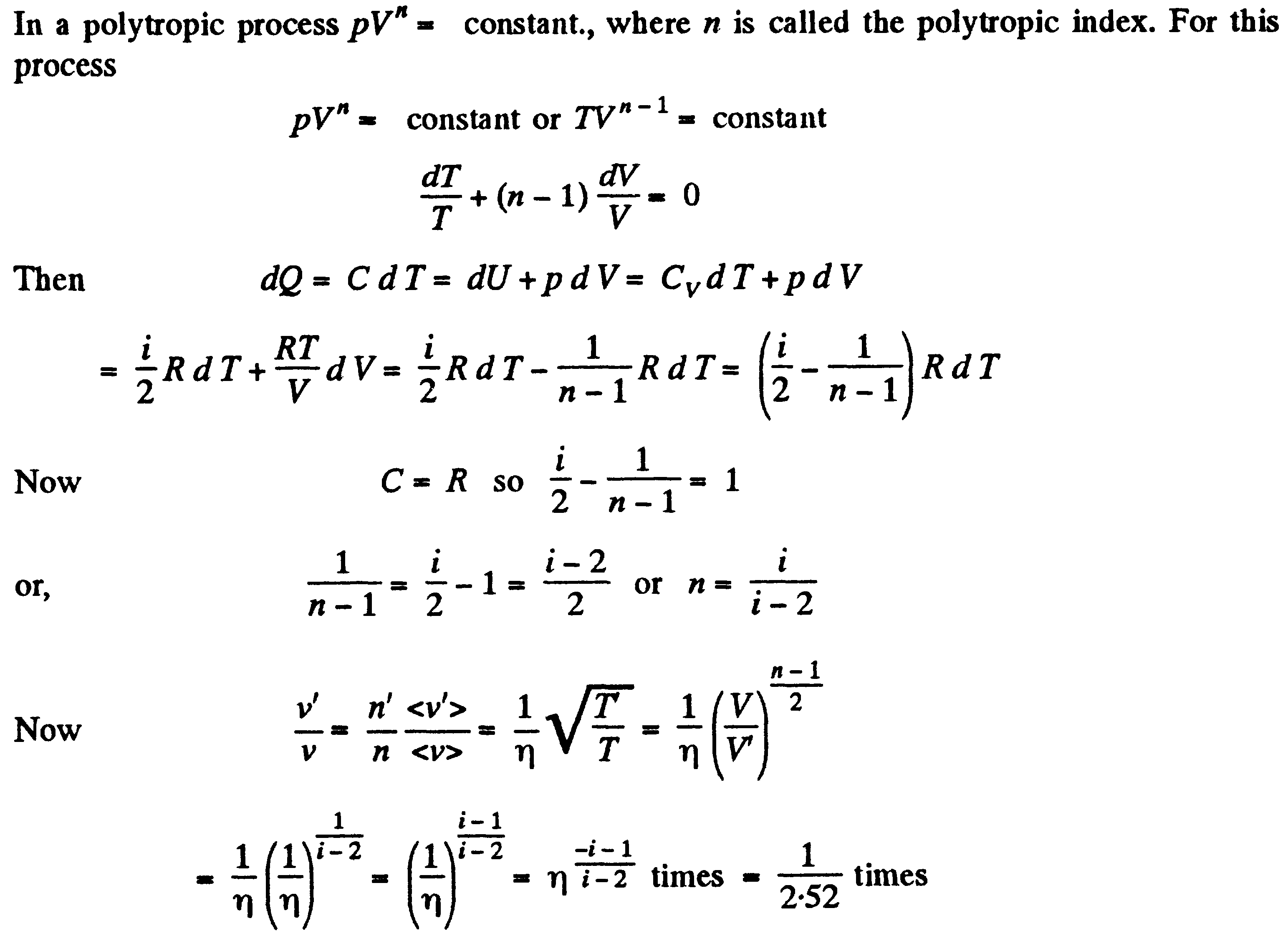
Билет №17.
Адиабатический процесс. Политропный процесс.
Адиабатическим
называется процесс, при котором отсутсвует
теплообмен (Q=0)
между системой и окружающей средой. К
адиабатическим процессам можно отнести
все быстропротекающие процессы.
Из
первого начала термодинамики для
адиабатического процесса следует, что
![]()
Поизведя некоторые преобразования из этого выражения получим уравнение адиабатического процесса, также называемое уравнением Пуассона.
![]() где
=Cp/CV
-
показатель адиабаты
Работа при
адиабатическом процессе равна
где
=Cp/CV
-
показатель адиабаты
Работа при
адиабатическом процессе равна
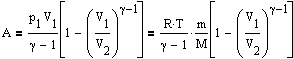
Изохорный,
изобарный, изотермический и адиабатический
процессы имеют общую особенность - они
происходят при постоянной теплоемкости.
Процесс, в котором теплоемкость остается
постоянной, называется политропным.
Уравнение
политропы, исходя из первого начала
термодинамики, выглядит так:
![]() где
где
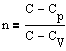



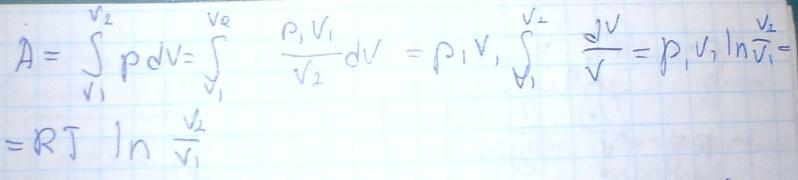
Задача:
![]()
![]()
![]()
![]()
![]()
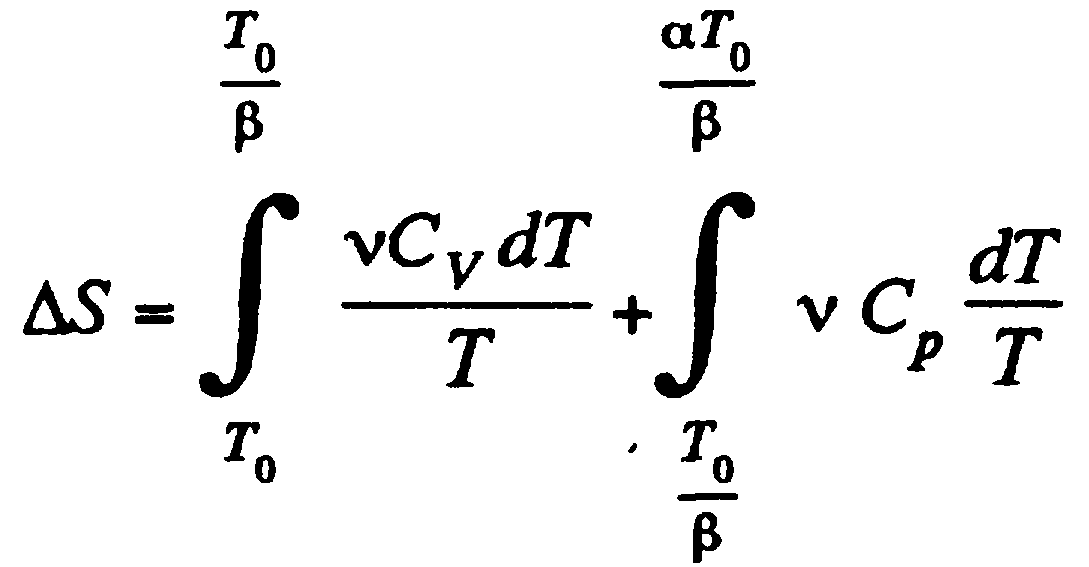
![]()
Изменение энтропии зависит от начального и конечного состояния, только так может быть рассчитан для любого процесса вообще. Мы будем оценивать изменение энтропии по паре линий, показанных выше. Тогда...
Билет №18.
Случайные
события. Вероятность. Функция распределения.
Вероятность
события называется предел, к которому
стремится отношение числа опытов,
приводящих к его осуществлению, к общему
числу опытов при беспредельном увеличении
последнего. Если из N опытов N` приводят
к реализации интересующего нас событитя,
то вероятность W этого события выражается
формулой:
![]() В
термодинамике необходимо знать
вероятность встречи молекул в определенном
интервале скоростей. Эту вероятность
называют распределением по скоростям
и записывают в виде
В
термодинамике необходимо знать
вероятность встречи молекул в определенном
интервале скоростей. Эту вероятность
называют распределением по скоростям
и записывают в виде
![]() Функция f(V) называется функцией
распределения.
Функция f(V) называется функцией
распределения.
Система – конечная область пространства, с находящейся в ней объектов исследования. Определенная система предполагает наличие границ (воображ. или матер, подвижных или нет) Мы изучаем состояние системы из идеального газа:
а) Макроскопическое. Пусть в некотором изолированном объеме есть газ. Если температура в некоторый момент времени разная, то через некоторое время она выровнится и газ перейдет в стационарное состояние, где P, V, T – параметры. Состояние, где характеризующееся параметрами P, V, T, называется макроскопическим.
б) Микроскопическое. Состояние газа, характеризуемое положением и скоростями всех его частиц называется микроскопическим. Если в системе имеется n частиц, то в n-величин характеризуется его микроскопическое состояние. n=2,7*1019 см-3. Связь между а) и б): Каждому макроскопическому состоянию соответствует громадное количество микроскопических состояний.
Задача: (наша задача б)
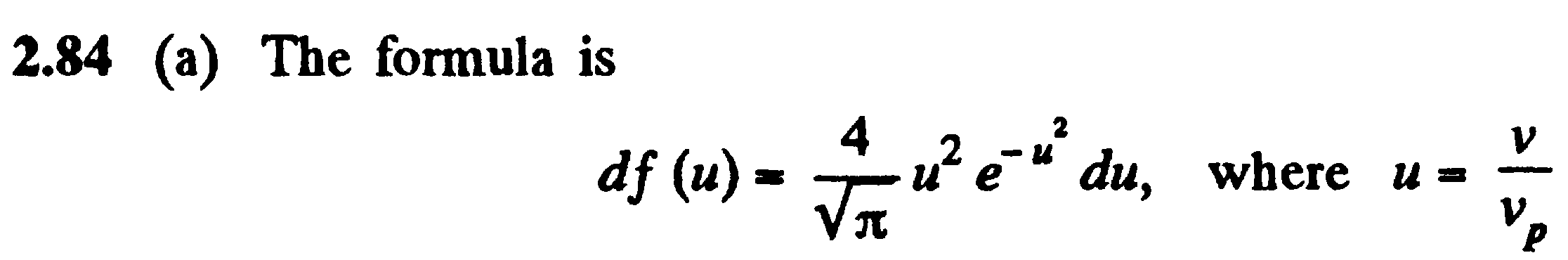 (prob
– исследовать)
(prob
– исследовать)
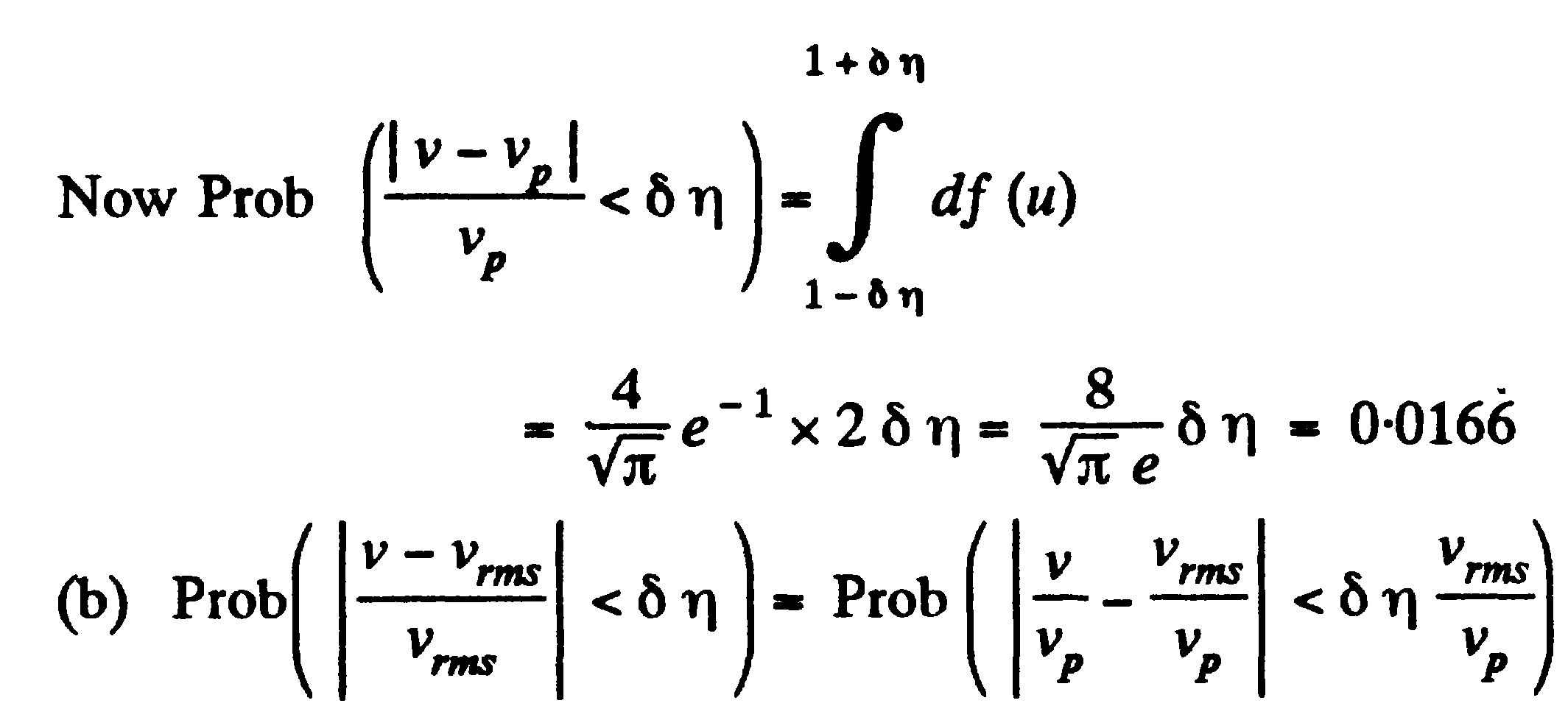
![]()
![]()
-
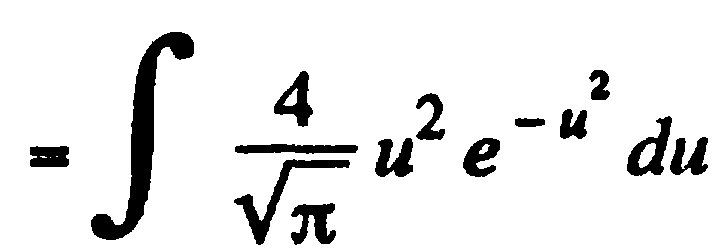
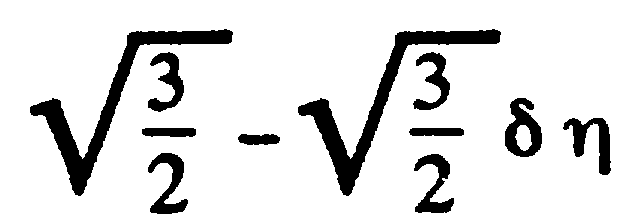
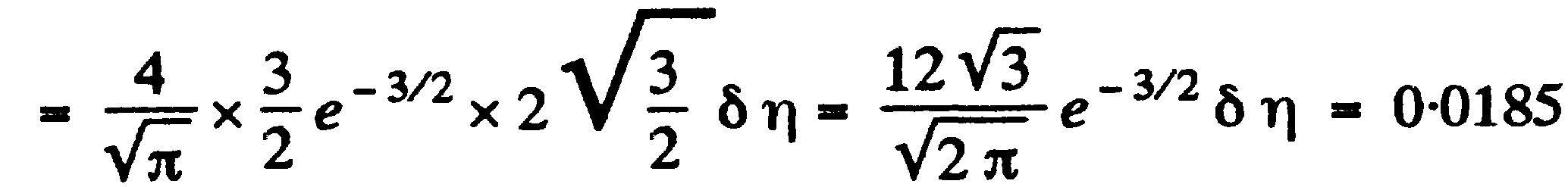
Билет №19.
Барометрическая формула.
Разность
давлений p и p+dp равна весу газа, заключенного
в объеме цилиндра высотой dh с основанием
площадью 1 м2:
![]()
где
-
плотность газа на высоте h (dh насолько
мало, что при изменении высоты в этом
пределе плотность газа можно считать
постоянной). Следовательно,
![]()
Воспользовавшись
уравнением состояния идеального газа
pV=(m/M)RT (m - масса газа, M - молярная масса
газа), находим, что
![]()
Подставим
плотность и получим
![]()
![]()
С изменением высоты от h1 до h2 давление изменяется от p1 до p2 т.е.
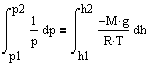
![]()
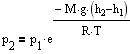 -
барометрическая формула.
-
барометрическая формула.
Так
как высоты обозначаются относительно
уровня моря, где давление считается
нормальным, то выражение может быть
записано в виде
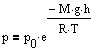
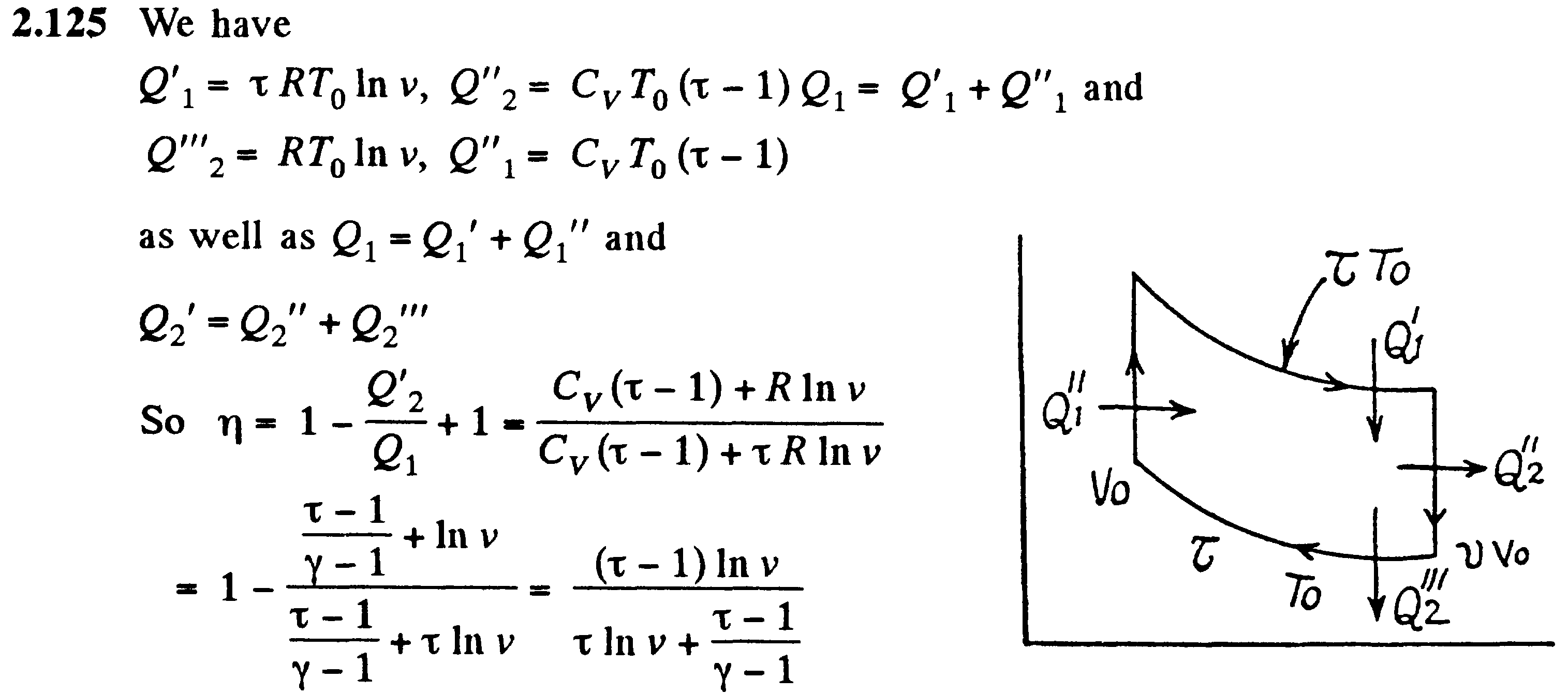
Билет №20.
Первое начало термодинамики. Работа, теплота, внутренняя энергия.
Термодинамика – раздел физики, в котором изучается условие превращения одного вида энергии в другое и количественное отношение при этих превращениях.
Рассмотрим
термодинамическую систему, для которой
механическая энергия не изменяется, а
изменяется лишь ее внутренняя энергия.
Внутренняя энергия системы может
изменяться в результате различных
процессов, например совершения над
системой работы или сообщения ей теплоты.
![]()
Это уравнение выражает первое начало термодинамики: теплота, сообщаемая системе, расходуется на изменение ее внутренней энергии и на совершение ею работы против внешних сил. Первое начало термодинамики в дифференциальной форме будет иметь вид
![]()
Работа:
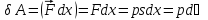 .
.
Теплота. Известно из опыта, что при соприкосновении 2-х тел их температура выравнивается. Говорят, что от более теплого энергия переходит к более холодному. Теплота – энергия в форме молекулярного движения.
Внутренняя энергия – вся энергия системы, за исключением кинетической энергии связи с движущимся центром масс системы и потенциальной энергии системы во внешнем поле. Во внутреннюю энергию входит энергия взаимодействия частиц, кинетическая энергия частиц.
Задача:
Мы
знаем, что изменением давления с высотой
жидкости даёт выражение:
![]()
Но
из газового закона:
![]() Из этих 2-х получается:
Из этих 2-х получается:
![]()
Или
![]() Теперь проинтегрируем:
Теперь проинтегрируем:
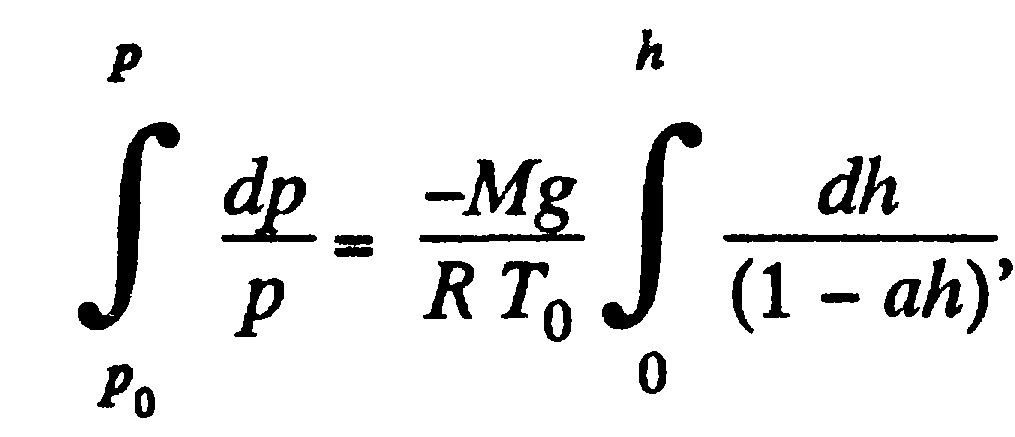 и получаем
и получаем
![]() Следовательно:
Следовательно:
![]()
