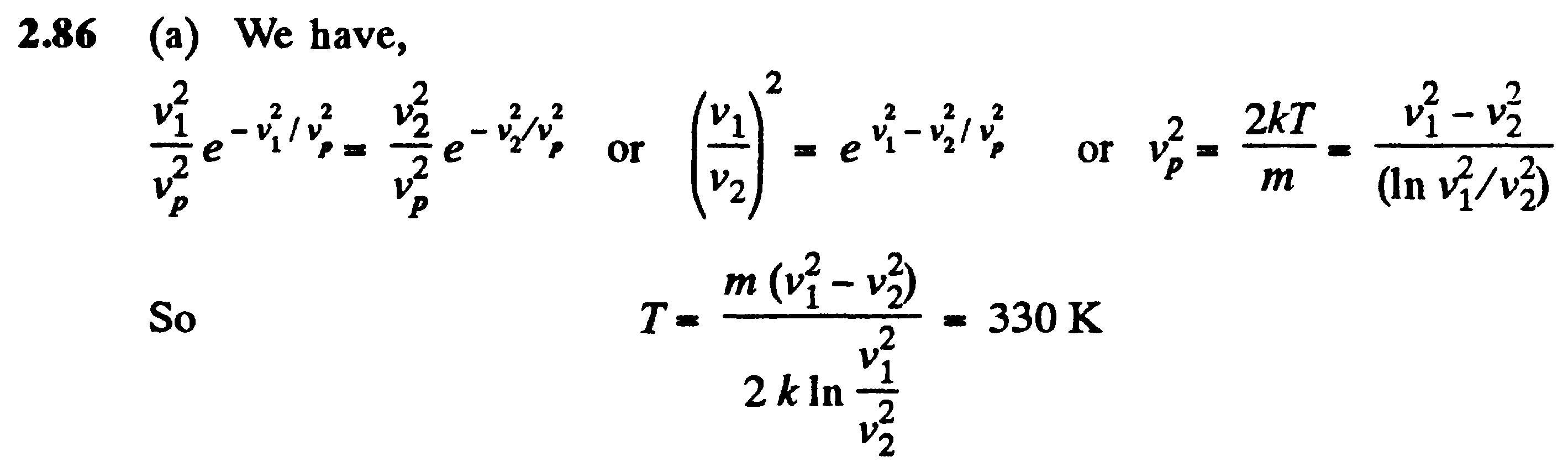Билет №3.
Отступление от законов идеальных газов. Уравнение Ван-дер-Ваальса. Для реальных газов необходимо учитывать размеры молекул и их взаимодействие друг с другом, поэтому модель идеального газа и уравнение Клайперона-Менделеева
![]()
(для моля газа), описывающее идеальный газ, для реальных газов непригодны. Учитывая собственный объем молекул и силы межмолекулярного взаимодействия, Ван-дер-Ваальс вывел уравнение состояния реального газа. Он ввел в уравнение Клайперона-Менделеева введены две поправки. 1.Учет собственного объема молекул. Наличие сил отталкивания, которые противодействуют проникновению в занятый молекулой объем других молекул, сводится к тому, что фактический свободный объем, в котором могут двигаться молекулы реального газа, будет не Vm, a Vm - b, где b - объем, занимаемый самими молекулами. Объем b равен учетверенному собственному объему молекул. 2. Учет притяжения молекул. Действие сил притяжения газа приводит к появлению дополнительного давления на газ, называемого внутренним давлением. По вычислениям Ван-дер-Ваальса, внутреннее давление обратно пропорционально квадрату молярного объема, т. е.
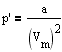
где a - постоянная Ван-дер-Ваальса, хараактерезующая силы межмолекулярного притяжения, Vm - молярный объем. Вводя эти поправки. получим уравнение Ван-дер-Ваальса для моля газа (уравнение состояния реальных газов):
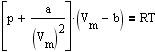
Для произвольного количества вещества n газа с учетом того, что V=nVm, уравнение Ван-дер-Ваальса примет вид
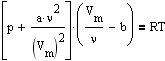
или
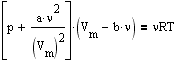
где поправки a и b - постоянные для каждого газа велечины, определяемые опытгным путем.
Задача:
![]() или
или
![]() ,
,
![]()
![]() , или
, или
![]()
Билет №4.
Уравнение Ван-дер-Ваальса после несложных преобразований можно привести к виду:
![]()
Это уравнение третьей степени относительно объема V и оно поэтому имеет три корня. Это значит , что при данных значениях температуры и давления могут быть три значения молярного объема или, что то же самое, три значения плотности газа.
В отличие от изотермы идеального газа, представляющей собой гиперболу, изотерма, соответствующая уравнению, которую назовем изотермой Ван-дер-Ваальса. Эта кривая, являющаяся графическим изображением уравнения третьей степени, имеет максимум и минимум, так что данному значению давления соответствуют три значения молярного объема. Естественно считать, что минимальному из этих значений объема соответствует жидкое состояние, а максимальному - газообразное.
Задача:
(где Cn
– молярная
теплоёмкость газа в этом процессе. Этому
даёт, что)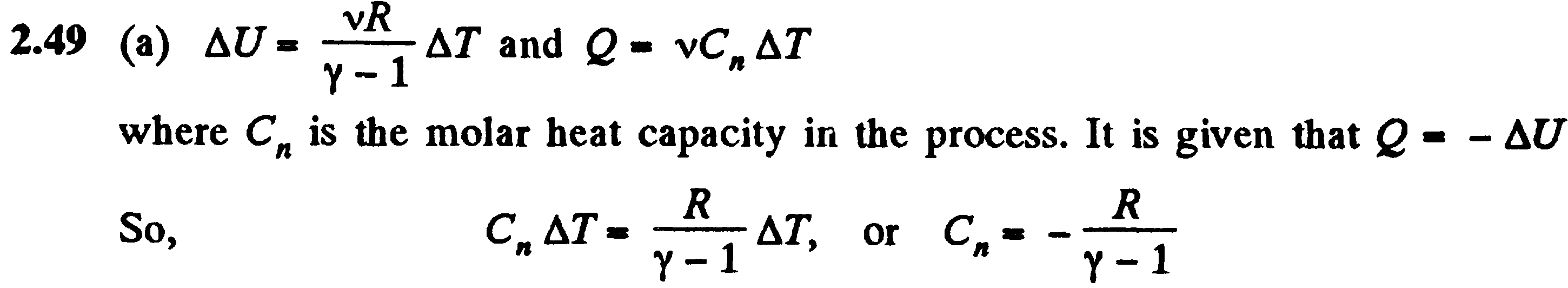
Билет №5,6.
Энтропия. Неравенство Клаузиуса.
Энтропия является мерой неупорядоченности системы.
Понятие энтропии введено в 1865г. Р.Клазиусом. Для выяснения физического одержания этого понятия рассматривают отношение теплоты Q, полученной телом в изотермическом процессе, к температуре T теплоотдающего тела, называемое приведенным количеством теплоты. приведенное кол-во телоты, сообщаемое телу на бесконечно малом участке процесса, равно dQ/T. Строгий теоретический анализ показывает, что приведенное кол-во теплоты, сообщаемое телу в любом обратимом круговом процессе, равно нулю:
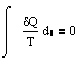
Из равенства интеграла, взятого по замкнутому контуру, следует, что подынтегральное выражение dQ/T есть полный дифференциал некоторой функции, которая определяется только состоянием системы и не зависит от пути, каким система пришла в это состояние. Таким образом,
![]()
Функция состояния, дифференциалом которой является dQ/T, называется энтропией и обозначается S. Для обратимых процессов изменение энтропии DS=0. Энтропия системы, совершающей необратимый циккл, возрастает: DS>0 Эти выражения относятся только к замкнутым системам, если же система обменивается теплотой с внешней средой, то ее энтропия может вести себя любым образом. Данные отношения можно представить в виде неравенства Клаузиуса: В
![]()
, т.е. энтропия замкнутой системы может либо возрастать (в случае необратимого процесса), либо оставаться постоянной (в случае обратимых процессов). Если система совершает равновесный переход из состояния 1 в состояние 2, то изменение энтропии
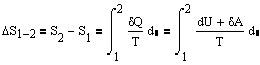
Энтропия обладает свойством аддитивности: энтропия системы равна сумме энтропий тел, входящих в систему. Свойством аддитивности обладают также внутренняя энергия, масса, объем (температура и давление таким свойством не обладают). Термодинамическая вероятность W состояния системы - это сило способов, которыми может быть реализовано данное состояние макроскопической системы, или число микросостояний, осуществляющих данное макросостояние. Согласно Больцману, энтропия системы и термодинамическая вероятность связаны между собой следующим образом:
![]()
где
k - постоянная Больцмана. Таким образом,
энтропия может рассматриваться как
мера вероятности состояния термодинамической
системы. Формула Больцмана позволяет
дать статистическое толкование энтропии:
энтропия
является мерой неупорядоченности
системы.В
состоянии равновесия - наиболее вероятном
состоянии системы - число микросостояний
максимально, следовательно максимальна
и энтропия. 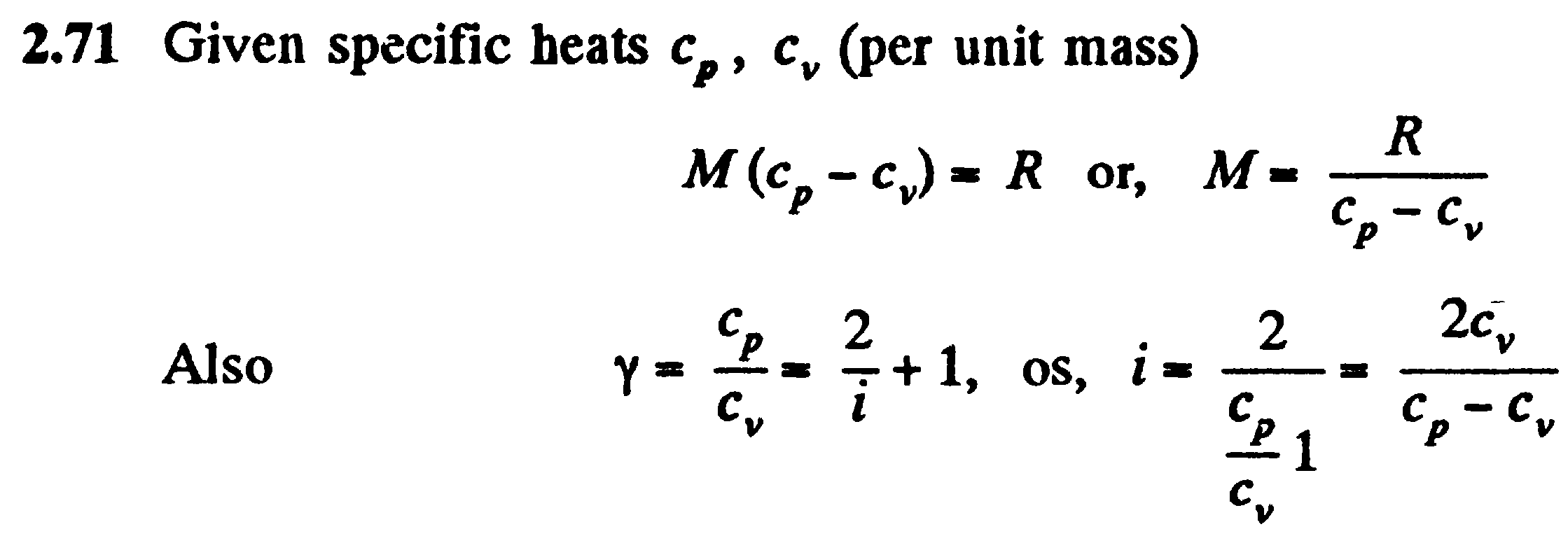
Задача: 5 нет. По аналогии 2.71:
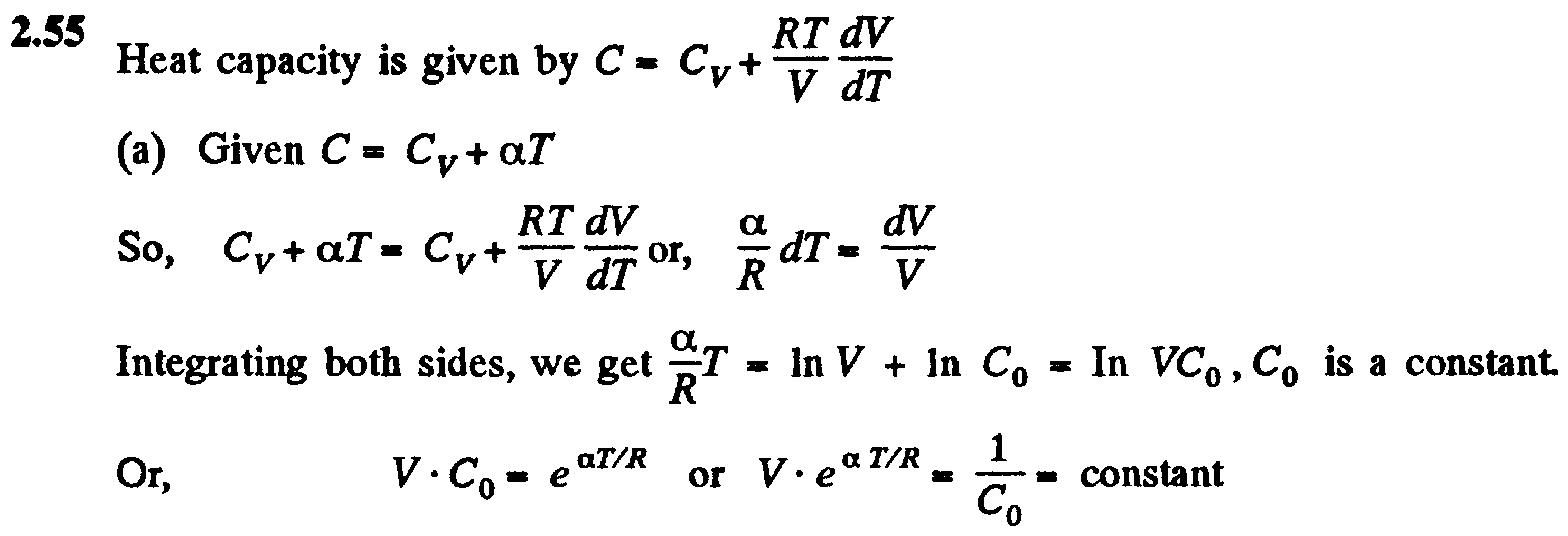
Теплоёмкость дает:… объединяя обе стороны, мы получаем
Билет №7.
Три начала термодинамики.
Термодинамика – раздел физики, в котором изучается условие превращения одного вида энергии в другое и количественное отношение при этих превращениях.
Рассмотрим
термодинамическую систему, для которой
механическая энергия не изменяется, а
изменяется лишь ее внутренняя энергия.
Внутренняя энергия системы может
изменяться в результате различных
процессов, например совершения над
системой работы или сообщения ей теплоты.
![]()
Это уравнение выражает первое начало термодинамики: теплота, сообщаемая системе, расходуется на изменение ее внутренней энергии и на совершение ею работы против внешних сил. Первое начало термодинамики в дифференциальной форме будет иметь вид
![]()
Если система периодически возвращается в первоначальное состояние, то изменение ее внутренней энергии DU=0. Тогда, согласно первому началу термодинамики, A=Q, т.е. вечный двигатель первого рода - периодически действующий двигатель, который совершал бы работу большую. чем сообщенная ему из вне энергия, - невозможен.
Используя понятие энтропии и неравенство Клаузиуса (DS>=0), второе начало термодинамики можно сформулировать как закон возрастания энтропии замкнутой системы при необратимых процессах: любой необратимый процесс в замкнутой системе происходит так, что энтропия системы при этом возрастает. Можно дать более краткую формулировку второго начала тд: в процессах, происходящих в замкнутой системе, энтропия не убывает.
Первые два начала тд дают недостаточно сведений о поведении термодинамических систем при нуле Кельвина. Она дополняются третьим началом тд, или теоремой Нернста-Планка: энтропия всех тел в состоянии равновесия стремится к нулю по мере приближения температуры к нулю Кельвина.