
Билет №1.
Фазовые переходы первого и второго рода. Уравнение Клайперона-Клаузиуса. 1. Фазовыий переход (переход вещества из одной фазы в другую) всегда связан с качественными изменениями свойств вещества. Различают фазовые переходы двух родов. Фазовый переход первого рода (например, плавление. кристаллизация) сопровождается поглащение или выделением теплоты, называемой теплотой фазового перехода. Фазовые переходы первого рода характеризуются постоянством температуры. изменениями энтропии и объема.
Фазовые переходы, не связаные с поглощением или выделением теплоты и изменением объема, называются фазовыми перехода второго рода
Эти переходы характеризуются постоянством объема и энтропии, но скачкообразным изменением теплоемкости. Фазовые переходы второго рода связаны с изменением симметрии: выше точки перехода система, как правило, обладает более высокой симметрией, чем ниже точек перехода.
В подобных переходах - из более упорядоченного кристаллического состояния в менее упорядоченное жидкое состояние степень беспорядка увеличивается, то есть согласно второму началу термодинамики, этот процесс связан с возрастанием энтропии системы. Если переход происходит в обратным направлении (кристаллизация), то система теплоту выделяет.
2. Для наглядного изображения фазовых превращений используется диаграмма состояния, на которой в координатах p, T задается зависимость между температурой фазового перехода и давлением в виде кривых испарения, плавления и сублимации, разделяющих поле диаграммы на три области. соответствующие условиям существования твердой, жидкой и газообразной фаз. Кривые на диаграмме называются кривыми фазовыми равновесия. Термодинамика дает метод расчета кривой равновесия двух фаз одного и того же вещества. Согласно уравнению Клапейрона-Клаузиуса. производная от давления по температуре равна
![]()
где L-теплота фазового перехода, (V2-V1) - изменение объема вещества при переходе его из первой фазы во вторую, T - температура перехода (процесс изотермический). Уравнение Клайперона-Клаузиуса позволяет определять наклоны кривых равновесия.
Задача: Если проявленная сила - F, тогда закон изменения концентрации с высотой читается:…

Билет №2.
Распределение Максвелла. Распределение Максвелла задает распределение молекул газа по скоростям при их хаотическом тепловом движении. Случайные столкновения молекул при их движении в газе приводят к случайным же изменениям их скоростей как по величине, так и по направлению. Скорость молекул удобно изобразить точкой в 3-х мерном пространстве скоростей. Совокупность скоростей всех молекул газа заполнит пространство скоростей с некоторой плотностью, пропорциональной плотности вероятности нахождения того или иного значения скорости. Вдоль любого направления в пространстве скоростей случайные отклонения в ту или иную сторону равновероятны, поэтому в качестве функции распределения для этого направления можно взять распределение Гаусса. Так как все направления равновероятны, то меры точности вдоль каждого из них должны быть одинаковыми, поэтому для функции распределения компонент скоростей имеем
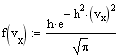
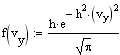
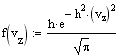
Ввиду независимости компонент скорости, пользуясь теоремой об умножении вероятностей, получаем
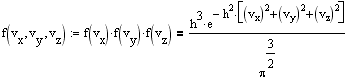
![]()
Среднее значения квадратов компонент скоростей одинаковы и равны <vx2> =<vy2> =<vz2> = 1/2h2. Средняя кинетическая энергия молекулы массой m равна 3kT/2, следовательно
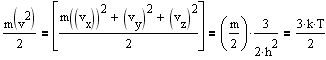
Откуда
![]()
Получим распределение Максвелла по компонентам скоростей:
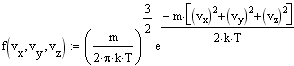
Для нахождения распределения молекул по модулю скорости перейдем в сферическую систему координат и, интегрируя по углам. найдем относилельное число молекул, обладающих скоростью от v до v+dv:
![]() ,
откуда получим функцию распределения:
,
откуда получим функцию распределения:
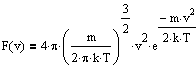
F(v) называется распределением Максвелла по модулю скорости v.
Задача:
Рассматриваемый
процесс может быть записан как
![]() где α – постоянная, p, V - некоторые
значения. Для этого процесса характерно:
где α – постоянная, p, V - некоторые
значения. Для этого процесса характерно:
![]() По объему линейно увеличивается α как
и давление. Температура должна тогда
увеличиться α в квадрате по времена.
Таким образом:
По объему линейно увеличивается α как
и давление. Температура должна тогда
увеличиться α в квадрате по времена.
Таким образом:
![]()
![]()
