
FIST_2_molekulyarnaya_fizika
.pdf
Федеральное агентство связи
Федеральное государственное образовательное бюджетное учреждение высшего профессионального образования
Поволжский государственный университет телекоммуникаций и информатики
Кафедра физики
по учебной дисциплине физика
(Ч.2. термодинамика и статистическая физика)
для студентов I курса очного отделения по направлениям (профилям) подготовки:
220400 Управление в технических системах (Управление и информатика в технических системах);
230100 Информатика и вычислительная техника (Программное обеспечение средств ВТ и АС);
230400 Информационные системы и технологии (Информационные системы и технологии);
230700 Прикладная информатика (Прикладная информатика в экономике);
231000 Программная инженерия (Разработка программно-информа– ционных систем);
222000 Инноватика (Управление инновациями)
Разработчик: к.ф.-м.н., доцент каф. физики Матвеев И.В.
Самара 2012

2 Лекция 1. Основы молекулярно-кинетической теории газов (МКТ)
Лекция 1. Основы молекулярно-кинетической теории газов (МКТ)
1.1. Основные понятия и положения МКТ
Детализированные цели изучения раздела.
Текст
Подзаголовок
Существуют системы: газы, жидкости, твердые тела, плазма. Все вещества состоят из молекул или атомов, которые находятся
в непрерывном движении.
Состояние тела (газа) зависит от числа частиц его составляющих (атомов, молекул), их масс, скоростей (импульсов). Рассмотрим массу атомов m0. Это очень маленькая величина, имеет порядок 10 27 кг. Использовать такие малые числа достаточно неудобно при практических расчетах. Поэтому вместо массы атома была введена физическая величина, которая получила название относительной атомной (молекулярной) массы.
Относительной атомной (молекулярной) массой Ar называется отношение массы этого атома (молекулы) m0 к одной двенадца-
той массы атома |
1 |
m |
изотопа углерода 12 (12C): |
|||||
12 |
||||||||
|
0,C |
|
|
|
|
|
||
|
|
|
A |
|
m0 |
. |
||
|
|
|
|
|
||||
|
|
|
r |
1 |
|
m |
||
|
|
|
|
|
||||
|
|
|
|
|
|
|||
|
|
|
|
12 0,C |
||||
Как видно из определения, относительные атомная и молекулярная массы являются величинами безразмерными:
Ar 1.
Масса, соответствующая одной двенадцатой массы атома изотопа углерода 12 называется атомной единицей массы (а.е.м.). В
этом случае, массы атомов (молекул) в относительных атомных единицах массы численно равны относительным атомным (молекулярным) массам:
m0 Ar 1а.е.м.
Лекции по курсу физики. Ч.1. Механика.
Разработчик: к.ф.-м.н., доцент каф. физики Матвеев И.В.

1.1. Основные понятия и положения МКТ |
3 |
Многие свойства газов зависят от массы газа m или от количест- |
|
ва молекул N в газах (которые связаны с массой |
молекул газа: |
m N m0 ), поэтому удобно вычислять некоторые характеристики газов без учета их массы или количества атомов (молекул). Для этого обычно рассматривают отношения этих величин к массе газа или к количеству молекул. Но рассмотрение такой характеристики вещества как количество атомов (молекул) тоже неудобно, так как эта величина огромна, порядка 1023 и больше. Поэтому, так же как и с массой, была введена новая физическая величина количество вещества, которая измеряет число структурных единиц (атомов или молекул) в молях.
1 моль — количество вещества, в котором содержится число частиц (атомов, молекул, ионов, электронов и т.д.) равное числу атомов в 12 граммах изотопа углерода 12.
Таким образом, число частиц равно произведению количества вещества в молях на число частиц в одном моле:
N NA ,
где — количество вещества в молях, NA — постоянная Авогадро, численно равная числу частиц в одном моле. Так как единица измерения количества вещества — моль: 1моль, а число частиц величина безразмерная, то NA 1моль 1. Экспериментально установленное значение постоянной Авогадро:
NA 6.02214199(47) 1023 моль 1.
Молярная масса M — масса одного моля вещества:
M m NA Ar 1а.е.м. M 1кг моль.
моль.
По определению, относительная атомная масса изотопа углерода 12 равна 12 (Ar 12), а молярная масса равна 12 грамм/моль. Таким образом, мы получаем:
1г моль NA 1а.е.м.
моль NA 1а.е.м.
или
Лекции по курсу физики. Ч.1. Механика.
Разработчик: к.ф.-м.н., доцент каф. физики Матвеев И.В.

4 Лекция 1. Основы молекулярно-кинетической теории газов (МКТ)
1а.е.м. 1г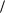 моль 10 3 кг
моль 10 3 кг моль 1.66053873(13) 10 27 кг.
моль 1.66053873(13) 10 27 кг.
NA NA
Также видно, что молярная масса в граммах на моль численно равна относительной атомной (молекулярной массе):
M Ar 1г моль Ar 10 3 кг
моль Ar 10 3 кг моль.
моль.
Очень удобна для запоминания формула, связывающая все рассмотренные величины:
N m .
NA M
Как и любой другой раздел физики, МКТ рассматривает модельные представления о газах. Одной из таких моделей является модель идеального газа. В основу модели идеального газа положены следующие постулаты:
— молекулы идеального газа можно рассматривать как точечные, их размеры значительно меньше расстояний, на которых они
находятся: rмол r;
— все взаимодействия молекул сводятся к упругому соударению друг с другом и со стенками сосуда (потенциальная энергия взаимодействия отсутствует).
В большинстве случаев этим условиям удовлетворяют сильно разреженные газы при больших температурах.
Выводы по теме
Текст
Вопросы для самоконтроля по теме
1)...;
2)...;
N)... .
1.2.Экспериментальные газовые законы для разреженных газов
Детализированные цели изучения раздела.
Текст
Лекции по курсу физики. Ч.1. Механика.
Разработчик: к.ф.-м.н., доцент каф. физики Матвеев И.В.
1.2. Экспериментальные газовые законы для разреженных газов |
5 |
Закон Бойля-Мариотта
При постоянной температуре T объём V данной массы газа обратно пропорционален его давлению P:
PV const .
Данный закон установлен Р.Бойлем в 1662 году, в 1676 году сформулирован также Э.Мариоттом. На рисунке представлены P-V-диаграммы состояния идеального газа при T const (T1 T2 T3 ). Диаграммы представляют собой равносторонние гиперболы (площади A1 и A2 равны).
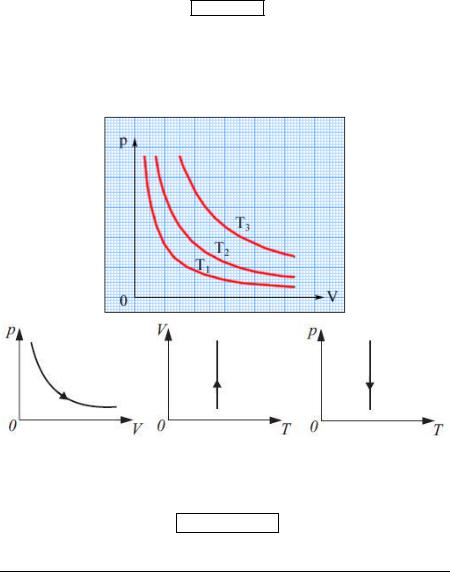
Закон Гей-Люссака
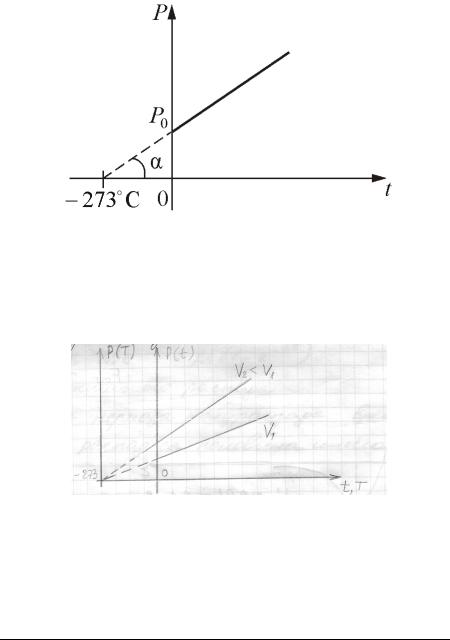
Для данной массы газа при постоянном давлении (P const ) объём, занимаемый газом, меняется линейно с температурой:
V(t) V0(1 t),
Лекции по курсу физики. Ч.1. Механика.
Разработчик: к.ф.-м.н., доцент каф. физики Матвеев И.В.
6 Лекция 1. Основы молекулярно-кинетической теории газов (МКТ)
где V0 — объём, занимаемый газом при t 0 C, |
1 (273.15К) — |
|||||||
коэффициент объёмного расширения газов. |
|
|
|
|
||||
Закон был открыт независимо Ж.Л.Гей-Люссаком в 1802 году и |
||||||||
Дж.Дальтоном в 1801г. |
|
|
|
|
|
|
|
|
|
|
T t 273.15 |
|
|
|
|
||
|
|
T 273.15 |
1 |
|
|
T |
||
|
|
|
|
|
|
|
|
|
|
|
|
T V0 . |
|||||
V V0 1 |
|
V0 |
|
|||||
|
|
|
|
273.15 |
|
|
T |
|
|
|
273.15 |
|
|
||||
|
|
|
|
|
|
0 |
|
|
Лекции по курсу физики. Ч.1. Механика.
Разработчик: к.ф.-м.н., доцент каф. физики Матвеев И.В.
1.2. Экспериментальные газовые законы для разреженных газов |
7 |
Закон Шарля
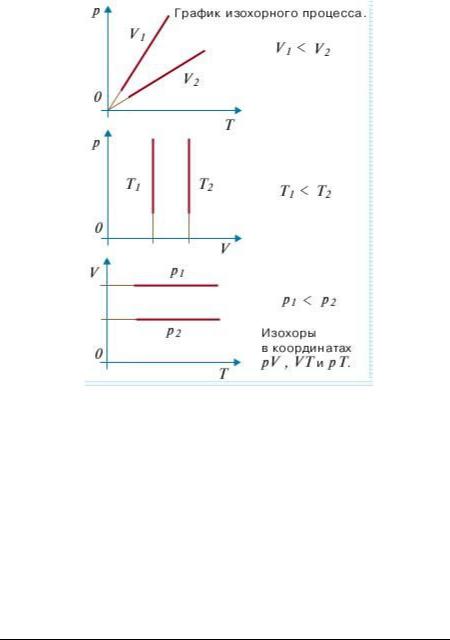
Для данной массы газа при постоянном объёме (V const ), давление, производимое газом, пропорционально температуре:
|
|
|
|
P1 |
|
P2 |
|
P P (1 t) |
P P Т |
||||||
|
|
|
|
||||
0 |
|
0 |
|
T1 |
|
T2 |
|
|
|
|
|
|
Открыт Ж.Шарлем в 1787 году.
Лекции по курсу физики. Ч.1. Механика.
Разработчик: к.ф.-м.н., доцент каф. физики Матвеев И.В.
8 Лекция 1. Основы молекулярно-кинетической теории газов (МКТ)
Закон Авогадро
При одинаковых температурах и давлениях в равных объёмах любых идеальных газов содержится одинаковое число молекул.
Открыт А.Авогадро в 1811г. Закон Авогадро можно сформулировать иначе: 1 моль любого из веществ в газообразном состоянии при одинаковых температуре и давлении занимает вполне определенный объём. При P0 101.325кПа, T0 273.15К этот объём равен
V0 22.413996(39)дм3 (литров).
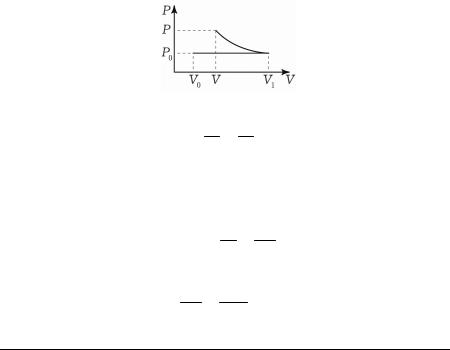
Уравнение Клапейрона-Менделеева
Уравнение Клапейрона (Клапейрона-Менделеева) — зависи-
мость между параметрами идеального газа (давлением P, объёмом V и абсолютной температурой T), определяющими его состояние:
Лекции по курсу физики. Ч.1. Механика.
Разработчик: к.ф.-м.н., доцент каф. физики Матвеев И.В.
1.2. Экспериментальные газовые законы для разреженных газов |
9 |
PV BT, где коэффициент пропорциональности B зависит от массы газа m и его молярной массы M .
Установлен французским ученым Б.П.Э.Клапейроном в 1834 году. В 1874 году Д.И.Менделев вывел уравнение состояния для одного моля идеального газа:
PV RT,
где R — универсальная газовая постоянная. Если молярная масса газа M , то
PV |
m |
RT или |
PV NkT. |
|
|||
|
M |
|
|
Уравнение Клапейрона является уравнением состояния идеального газа, которое объединяет законы Бойля-Мариотта, Гей-Люссака и Авогадро. Поэтому другое определение идеального газа — газ, точно подчиняющийся законам Бойля-Мариотта, Гей-Люссака и Авогадро.
Рассмотрим изобарный процесс P0,V0,T0 P0,V1,T :
V1 V0
T T0
и изотермический P0,V0,T0 P0,V1,T :
PV P0V1.
Выразим из данных законов промежуточный объём V1 :
V1 T V0 PV . T0 P0
Для одного моля получим:
PV P0V0 R, T T0
Лекции по курсу физики. Ч.1. Механика.
Разработчик: к.ф.-м.н., доцент каф. физики Матвеев И.В.

10 Лекция 1. Основы молекулярно-кинетической теории газов (МКТ)
где R 8.314472(15)Дж (К моль) — универсальная газовая постоянная.
(К моль) — универсальная газовая постоянная.
Как следует из закона Авогадро, при постоянных давлении и температуре объём пропорционален количеству вещества:
PVT R
или
PV RT.
Выразив количество вещества через массу или через количество частиц, получим следующие записи уравнения Менделее- ва-Клапейрона:
PV m RT;
M
N R
PV NA RT N NA T NkBT,
где kB R NA 1.3806503(24) 10 23 Дж
NA 1.3806503(24) 10 23 Дж К 8.617342(15) 10 5 эВ
К 8.617342(15) 10 5 эВ К — постоянная Больцмана.
К — постоянная Больцмана.
Разделив полученное уравнение на объём, получим:
P nkBT,
где n N V — концентрация частиц — число частиц в единице объёма.
V — концентрация частиц — число частиц в единице объёма.
Закон Дальтона
Воздух — многокомпонентный газ (О2,N2,CO,CO2,…) Обозначим концентрации составляющих через n1, n2, n3, … Давление, производимое смесью газов:
P nkBT (n1 n2 ...)kBT n1kBT n2kBT n3kBT ...
Закон Дальтона: давление, производимое смесью газа на стенки сосуда, равно сумме парциальных давлений:
P P1 P2 P3 ...
Парциальное давление — это давление, которое производила бы составляющая газа, если бы остальные составляющие отсутствовали.
Лекции по курсу физики. Ч.1. Механика.
Разработчик: к.ф.-м.н., доцент каф. физики Матвеев И.В.
