
FIST_2_molekulyarnaya_fizika
.pdf
1.2. Экспериментальные газовые законы для разреженных газов |
11 |
Уравнение Ван-дер-Ваальса
Будем сжимать газ, до тех пор, пока нельзя станет считать его разряженным. Поскольку увеличиваются силы притяжения, то давление становится больше:
a P P0 V02 .
Объём, предоставленный для движения молекул газа, уменьшается на собственный размер молекул (b):
V V0 b.
В уравнении состояния идеального газа
PV RT |
||||
сделаем подстановку |
|
|
||
P P |
a |
; |
V V b. |
|
V2 |
||||
|
|
|
||
Полученное уравнение
P0 Va2 V b RT
называется уравнением Ван-дер-Ваальса.
Основное уравнение МКТ газа
Рассмотрим давление, которое оказывает газ на стенки сосуда.
v0
x
v
Будем считать, что удар о стенки сосуда является абсолютно упругим, т.е. частица при отражении не теряет и не приобретает кинетической энергии. Это действительно имеет место, если газ и стенки сосуда находятся при одинаковых температурах. В этом случае, импульс силы, который получит частица, будет равен изменению импульса частицы:
Лекции по курсу физики. Ч.1. Механика.
Разработчик: к.ф.-м.н., доцент каф. физики Матвеев И.В.

12 Лекция 1. Основы молекулярно-кинетической теории газов (МКТ)
Ft p p0
или в скалярном виде:
Fxt px p0x 2p0x 2px 2m0vx .
Зафиксируем время t. За это время от площадки оболочки площадью S отразится N частиц:
1
N 2 n S vxt.
Здесь n — концентрация частиц в объёме V S vxt, где l vxt — длина цилиндра, все молекулы в объёме которого, движущиеся к оболочке, за время t пройдут расстояние l и отразятся от оболочки. Множитель 1 2 введен в связи с тем, что только половина частиц движется по направлению к оболочке.
2 введен в связи с тем, что только половина частиц движется по направлению к оболочке.
Давление, которое оказывают эти частицы на оболочку, будет складываться из столкновений N частиц:
P N |
F |
|
1 |
nSvxt |
2m0vx t |
nm0 vx 2 . |
|
S |
2 |
S |
|||||
|
|
|
|
Так как скорости частиц различны, то для вычисления давления необходимо просуммировать давления создаваемые частицами с различными скоростями:
P Ni |
Fi |
|
1 |
niSvi,xt |
2m0vi,x t |
m0 ni vi,x 2 |
||||||
S |
|
|
|
S |
||||||||
i |
i 2 |
|
|
|
|
|
i |
|
||||
m0 |
Ni vi,x 2 |
|
N |
|
Ni vi,x 2 |
|
2 |
|||||
|
|
|
|
m0 |
|
|
|
|
nm0 |
vx . |
||
|
V |
V |
N |
|
||||||||
i |
|
|
i |
|
|
|
||||||
Здесь Ni ,ni — число и концентрация частиц в объёме Vi S vi,xt со скоростями vi,x .
Квадрат скорости выразим через проекции скоростей: v2 vx 2 vy 2 vz 2 .
Учитывая равновероятность всех направлений движения:
vx 2 vy 2 vz 2
получим
Лекции по курсу физики. Ч.1. Механика.
Разработчик: к.ф.-м.н., доцент каф. физики Матвеев И.В.
1.2. Экспериментальные газовые законы для разреженных газов |
13 |
|||||||||||||
v2 3 vx 2 |
vx 2 |
|
1 |
v2; |
vx 2 |
1 |
v2 . |
|
||||||
3 |
3 |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
Введём понятие среднеквадратичной скорости: |
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
v2 |
v2 |
v2 |
|
|
|
||||
|
|
v2 |
|
|
|
|||||||||
v |
|
1 |
2 |
N |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
||||||
ср.кв. |
|
|
|
|
|
|
|
|
N |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|||
Таким образом, для давления получим:
P 13 nm0  v2
v2  13 nm0v2ср.кв. .
13 nm0v2ср.кв. .
Полученное уравнение носит название основное уравнение МТК газов.
Учитывая, что средняя кинетическая энергия молекул одноатомного газа:
 Eкин
Eкин  =
= 12 m0v2
12 m0v2  =12 m0
=12 m0  v2
v2  =12 m0vср2 .кв.
=12 m0vср2 .кв.
для давления получим
P 13 n 2 12 m0vср2 .кв. 23 n  Eкин
Eкин  .
.
Учитывая уравнение состояния идеального газа
P nkBT
для средней кинетической энергии молекул идеального газа получим
3
 Eкин
Eкин  2kBT .
2kBT .
Из полученной формулы следует, что температура есть мера средней кинетической энергии молекул газа, а постоянная Больцмана есть коэффициент перевода температуры в Кельвинах в энергию в джоулях.
Выводы по теме
Текст
Вопросы для самоконтроля по теме
1)...;
2)...;
Лекции по курсу физики. Ч.1. Механика.
Разработчик: к.ф.-м.н., доцент каф. физики Матвеев И.В.

14Лекция 1. Основы молекулярно-кинетической теории газов (МКТ)
N)... .
Лекции по курсу физики. Ч.1. Механика.
Разработчик: к.ф.-м.н., доцент каф. физики Матвеев И.В.

2.1. Основные понятия термодинамики |
15 |
Лекция 2. Элементы термодинамики (ТД)
2.1. Основные понятия термодинамики
Детализированные цели изучения раздела.
Текст
Введение
Существует два подхода к рассмотрению молекулярных явлений: статистический и термодинамический. Первый подход реализует раздел физики, называемый статистическая физика, второй — термодинамика.
У статистической физики и термодинамики общий предмет изучения — свойства веществ и происходящие в них процессы. Подходя к изучению этих свойств и процессов с различных точек зрения, статистическая физика и термодинамика взаимно дополняют друг друга, образуя, по существу, единое целое.
Статистическая физика — раздел физики, посвященный изучению свойств макроскопических тел исходя из свойств образующих тело частиц и взаимодействий между ними.
Она изучает статистические закономерности, используя вероятностные методы и истолковывая свойства тел, непосредственно наблюдаемые на опыте (давление, температура), как суммарный, усредненный результат действия отдельных молекул.
Вотличие от статистической физики, термодинамика — раздел физики, изучающий связи и соотношения между экспериментально определяемыми (феноменологическими) параметрами (ТД параметрами) физических тел, не интересуясь микроскопической при-
родой этих тел. В основе термодинамики лежат фундаментальные законы (называемые началами термодинамики), установленные путем большого числа опытных фактов. По этой причине результаты, получаемые термодинамикой, имеют общий характер.
Втермодинамике вещество характеризуется некоторыми состояниями, параметрами выступают свойства, которые характеризуют все вещество в целом. Термодинамика изучает вещество через зави-
Лекции по курсу физики. Ч.1. Механика.
Разработчик: к.ф.-м.н., доцент каф. физики Матвеев И.В.

16 Лекция 2. Элементы термодинамики (ТД)
симость состояния вещества от неких параметров (свойств, характеризующих вещество в целом) независимо от его внутренней структуры. Эти параметры называют макропараметрами (T, V, P, m, ).
Термодинамическая система — совокупность макроскопических тел, которые могут обмениваться энергией между собой и с внешней средой. Примером может служить жидкость и находящийся с ней в соприкосновении пар или газ. В частности, система может состоять из одного твердого, жидкого или газообразного тела.
Термодинамическая система может находиться в различных состояниях, различающихся температурой, давлением, объемом, плотностью и т.д. Подобные величины, характеризующие состояние сис-
темы, называются параметрами состояния или ТД параметрами. Равновесное состояние ТД системы — такое состояние изоли-
рованной системы, в которое она переходит по истечении достаточно большого промежутка времени.
Данное время, называемое временем релаксации, зависит от природы тел, взаимодействия их частиц, а также от характера исходного неравновесного состояния.
Равновесное состояние полностью характеризуется небольшим числом ТД параметров.
Параметры системы не всегда имеют определенные значения. Состояние, в котором ходя бы один из параметров не имеет определенного значения, называется неравновесным.
Равновесное состояние ТД системы — такое состояние, при ко-
тором все параметры состояния имеют определенные значения, не изменяющиеся с течением времени.
ТД системы, которые не обмениваются с внешней средой ни энергией, ни веществом, называются изолированными или замкнутыми.
Процесс перехода термодинамической системы из состояния с одними параметрами системы в состояние с другими парамет-
рами называется термодинамическим процессом. Такой переход всегда связан с нарушением равновесия системы.
Лекции по курсу физики. Ч.1. Механика.
Разработчик: к.ф.-м.н., доцент каф. физики Матвеев И.В.

2.1. Основные понятия термодинамики |
17 |
Квазистатический, квазиравновесный или просто равновесный процесс — бесконечно медленный процесс, состоящий из последовательности равновесных состояний.
Квазистатический процесс — абстракция, не реализующаяся в природе, но большинство ТД процессов можно приближенно считать квазистатическими.
Квазистатические процессы — обратимые.
Обратимый процесс — процесс, который можно совершить в обратном направлении и при этом в окружающей среде не останется никаких изменений.
Реально обратимые процессы не существуют (по второму началу термодинамики), т.к. любой термодинамический процесс идет с потерей энергии (диссипацией). Но в реальности мы с той или иной степени точности очень часто можем считать процесс обратимым.
ТД дает полное количественное описание обратимых процессов, а для необратимых устанавливает лишь определенные неравенства и указывает направление их протекания.
Процесс, при котором система после ряда изменений возвращается в исходное состояние, называется круговым процессом или
циклом. Графически цикл изображается замкнутой кривой.
Температура
Температура — характеризует степень нагретости тел, но субъективные ощущения (тёплый, холодный, горячий) не годятся для научных целей. Чувственные ощущения зависят от теплопроводности тела. Так, когда в помещении все тела находятся при одной температуре, то металлические тела на ощупь холоднее деревянных (или наоборот горячее, если их температура выше температуры тела человека).
Если два тела привести в соприкосновение, то они спустя некоторое время приходят в состояние термодинамического равновесия
(ТД равновесия).
Каково бы ни было начальное состояние тел изолированной системы, в ней в конце концов устанавливается ТД равновесие, в кото-
Лекции по курсу физики. Ч.1. Механика.
Разработчик: к.ф.-м.н., доцент каф. физики Матвеев И.В.

18 Лекция 2. Элементы термодинамики (ТД)
ром прекратятся все макроскопические процессы. При этом, в состоянии ТД равновесия все тела имеют одинаковую функцию состояния, называемой температурой.
Таким образом, температура — макроскопическая характеристика внутреннего состояния тел.
Существование ТД параметра — температуры называют нуле-
вым началом ТД.
Широкое применение получили следующие шкалы температур: 1) шкала Цельсия — в качестве реперных точек (фиксированных
температур) принимается температура |
плавления |
льда |
равная |
||||
t 0 C |
и температура кипящей воды равная t 100 C. |
|
|||||
2) шкала Фаренгейта — в качестве реперных точек принимается |
|||||||
температура плавления льда равная |
t 32 F |
и температура кипя- |
|||||
щей воды равная t 212 F. |
|
|
|
|
|
|
|
Связь между шкалой Фаренгейта и шкалой Цельсия: |
|
||||||
|
t( F) 1.8 t( C) 32; |
t( C) 5 |
9 t( F) 32 . |
|
|||
3) термодинамическая шкала температур — в качестве реперной |
|||||||
точки |
принимается температура |
тройной |
точки |
воды |
равная |
||
T 273.16К. |
|
|
|
|
|
|
|
Связь между шкалой Цельсия и термодинамической шкалой: |
|||||||
|
T(К) t( C) 273.15; |
t( C) T(К) 273.15. |
|
||||
Адиабатически изолированная система
Пусть ТД система заключена в к.-л. оболочку, отделяющую её от других тел. Изменить состояние системы можно различными способами.
Один из них заключается в механических перемещениях частей оболочки или изменением внешних параметров определяющих состояние системы. При этом совершается механическая работа.
Работа внешних сил, связанных с перемещением оболочки или изменением внешних параметров называется макроскопической работой (A ): A — работа внешних сил над системой, А — работа системы против внешних сил.
Лекции по курсу физики. Ч.1. Механика.
Разработчик: к.ф.-м.н., доцент каф. физики Матвеев И.В.

2.1. Основные понятия термодинамики |
19 |
Для квазистатических процессов: |
A A , для неквазистатиче- |
ских процессов: A A .
Работа не обязательно связана с изменением объёма: при вращении мешалки внутри объёма с газом, над системой производится работа, что приводит к её нагреву — при этом объём системы не меняется.
Состояние системы можно менять и не совершая механической работы. Например, нагреванием, воздействием механических и электрических полей. Все такие процессы объединены понятием теплообмена.
Адиабатически изолированная система или система в адиабати-
ческой оболочке — это такая система, состояние которой остаётся неизменной при любых изменениях температуры окружающих тел, если только значения внешних параметров поддерживать постоянными.
Иначе, адиабатически изолированная система — это система, в которой отсутствует теплообмен.
Если система адиабатически изолирована, то работа внешних сил над этой системой зависит только от её начального и конечного состояний, но не зависит от способа или пути, каким осуществляется этот переход.
Всегда возможен один из двух адиабатических процессов: либо из состояния 1 в 2, либо из состояния 2 в 1.
Макроскопическая работа
Рассмотрим газ под поршнем. Работа газа при перемещении поршня площадью S на расстояние dx:
A Fdx PSdx PdV.
Для квазистатических процессов давление одинаково по всему объёму. Для газа произвольного объёма полная работа газа при бесконечно малом перемещении оболочки:
A PSdn P Sdn PdV.
Лекции по курсу физики. Ч.1. Механика.
Разработчик: к.ф.-м.н., доцент каф. физики Матвеев И.В.
20 Лекция 2. Элементы термодинамики (ТД)
Внутреннее и внешнее давления одинаковы:
A PвнешdV Aвнеш A .
Полная работа выражается
2 |
2 |
2 |
A A PdV P(V,T)dV. |
||
1 |
1 |
1 |
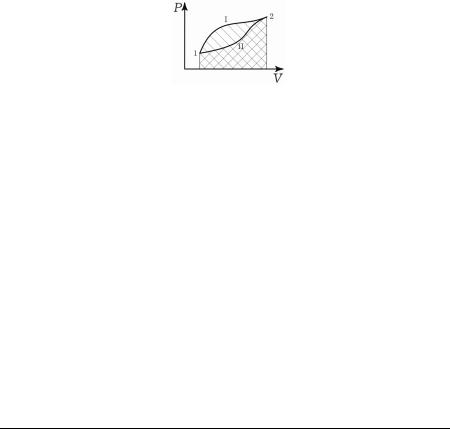
При переходе из состояния 1 в состояние 2, различным образом меняя температуру Т, получим разные значения работы А. Так на диаграмме PV работа газа будет равна площади фигуры ограниченной графиком процесса. Так для путей 1I2 и 1II2 работа будет равна заштрихованным фигурам на рисунке.
Таким образом, работа не определяется заданием начального и конечного состояния системы. Её величина зависит от способа или пути перехода системы из начального состояния в конечное.
Работа не является функцией состояния, а A является не дифференциалом (разностью двух величин), а бесконечно малой величиной. Чтобы отличать малые величины от дифференциала, вместо символа d используют .
2.2. I начало термодинамики. Теплоёмкость
Детализированные цели изучения раздела.
Текст
Внутренняя энергия и I начало ТД
Внутренней энергией системы U называется функция состояния, приращение которой во всяком процессе, совершаемом адиабатически изолированной системой равно работе внешних сил над системой Aвнеш при переходе её из начального равновесного состояния в конечное равновесное состояние:
Лекции по курсу физики. Ч.1. Механика.
Разработчик: к.ф.-м.н., доцент каф. физики Матвеев И.В.
