
FIST_2_molekulyarnaya_fizika
.pdf
2.2. I начало термодинамики. Теплоёмкость |
21 |
U2 U1 A12внеш A .
В термодинамические формулы входит не сама энергия, а её изменение либо производная по какому-либо параметру. Поэтому внутреннюю энергию можно определять с точностью до произвольной постоянной, выбирая её так, чтобы выражение для энергии было предельно простым.
Фактически, внутренняя энергия какого-либо тела слагается из кинетической энергии поступательного и вращательного движения молекул, кинетической и потенциальной энергии колебательного движения атомов в молекулах, потенциальной энергии взаимодействия между молекулами и внутримолекулярной энергии и т.п. Кинетическая энергия тела как целого и его потенциальная энергия во внешнем силовом поле во внутреннюю энергию тела не входят.
Внутренняя энергия системы тел слагается из внутренней энергии каждого из тел в отдельности и энергии взаимодействия между ними.
Внутренняя энергия является функцией состояния системы. Поэтому приращение внутренней энергии, при переходе системы из одного состояния в другое, всегда равно разности значений внутренней энергии в конечном и начальном состояниях независимо от пути, по которому совершался переход.
Процесс обмена внутренними энергиями соприкасающихся тел, не сопровождающийся производством механической работы, назы-
вается теплообменом. Энергия, переданная телу окружающей средой в результате теплообмена, называется количеством теплоты
или просто теплотой Q, полученной телом в таком процессе. Фактически, под количеством теплоты подразумевается микро-
скопическая работа.
Рассмотрим теорему о кинетической энергии:
Aмикро Aмакровнеш U2 U1 U.
Учитывая, что Aмакровнеш Q, получим
Q A U |
|
Q A U |
или
Лекции по курсу физики. Ч.1. Механика.
Разработчик: к.ф.-м.н., доцент каф. физики Матвеев И.В.

22 Лекция 2. Элементы термодинамики (ТД)
Q U A .
Данная формула выражает закон сохранения энергии или пер-
вое начало термодинамики:
Теплота Q, полученная системой, идет на приращение её внутренней энергии и на произведение системой работы.
Для бесконечно малых процессов I начало термодинамики запишется следующим образом:
Q dU А.
Если механическая работа связана с изменением объема, то первое начало ТД можно переписать следующим образом:
Q dU PdV.
Как и работа, теплота не является функцией состояния или полным дифференциалом:
2
Q Q2 Q1,
1
поэтому для теплоты используется не дифференциал, а греческая буква , обозначающая бесконечно малую величину.
A, A — работа ТД системы против внешних сил;
A , A — работа внешних сил над ТД системой;
Q, Q — количество теплоты, полученное системой от внешней среды; Q , Q — количество теплоты, отданное системой внешней среде.
Теплоёмкость
Теплоёмкость тела — это физическая величина, равная отношению бесконечно малого количества теплоты Q, полученного телом, к соответствующему приращению его температуры dT:
C |
Q |
, |
[C ] |
Дж |
. |
тела |
dT |
|
тела |
К |
|
Для практического использования теплоёмкость тела, которая зависит от его массы и количества вещества не удобна. Поэтому практически используют удельную и молярную теплоёмкости.
Лекции по курсу физики. Ч.1. Механика.
Разработчик: к.ф.-м.н., доцент каф. физики Матвеев И.В.
2.2. I начало термодинамики. Теплоёмкость |
23 |
Удельная теплоёмкость тела — это количество теплоты, ко-
торое нужно сообщить телу единичной массы для увеличения его температуры на единицу:
c Cтелаm mdTQ , [c] кгДжК .
Молярная теплоёмкость тела — это количество теплоты, ко-
торое нужно сообщить 1 молю тела для увеличения его температуры на единицу.
С |
Cтела |
|
Q |
, |
[C] |
Дж |
. |
|
|
||||||
|
dT |
||||||
|
|
|
|
моль К |
|||
Для практического применения удобно использовать удельную теплоёмкость, а в теоретических исследованиях молярную. Связь между ними:
СCтела mc Mc.
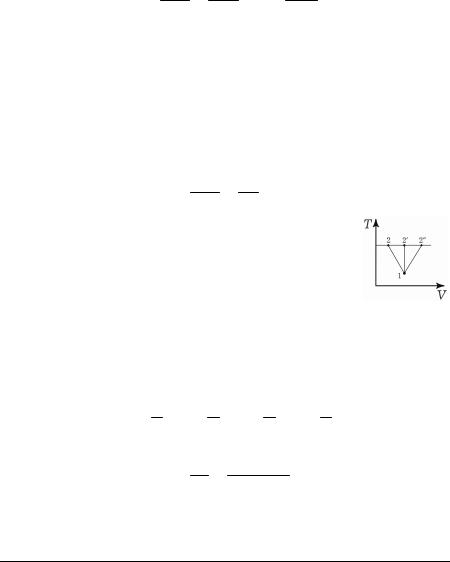
Теплоёмкость является не функцией состояния, а характеристикой бесконечно малого процесса совершаемого телом. Так в процессах 12, 12 и 12 приращение температуры одно и то же, а количество теплоты будет различно во всех трёх процессах.
В дальнейшем все величины будем рассматривать для одного моля. Чтобы в конечных формулах учесть зависимость от количества вещества, необходимо все величины, пропорциональные количеству вещества разделить на число молей, т.е. сделать следующую подстановку:
Q Q ; U U ; A A ; V V .
Учтём первое начало термодинамики:
С Q dU PdV . dT dT
В общем случае, внутренняя энергия тела зависит от количества вещества (не учитываем, т.к. рассмотрение ведем для постоянных масс и одного моля), объёма V, давления P и температуры T.
Лекции по курсу физики. Ч.1. Механика.
Разработчик: к.ф.-м.н., доцент каф. физики Матвеев И.В.

24 Лекция 2. Элементы термодинамики (ТД)
Уравнение состояния связывает данные параметры: f(P,V,T) 0 P P(V,T),
Таким образом, будем считать, что внутренняя энергия зависит только от двух параметров тела — объёма V и температуры T:
U U(V,T,P(V,T)) U(V,T).
Для внутренней энергии в соответствии с правилами вычисления дифференциала от функции нескольких переменных получим:
|
|
U |
|
|
U |
dU |
|
|
dV |
|
|
|
|
|
dT. |
||
|
|
|
|
||
|
|
V T |
|
|
T V |
И для теплоемкости запишем
|
dU PdV |
U |
|
U |
|
dV |
||
|
|
|
||||||
С |
|
|
|
|
|
P |
|
|
|
|
|
|
. |
||||
|
dT |
|
|
|
|
|
dT |
|
|
|
T V |
|
V T |
|
|||
Рассмотрим теплоемкости при изохорном и изобарном процессах. В первом случае dV dT 0 (V const) и теплоёмкость при постоянном объёме будет равна:
dT 0 (V const) и теплоёмкость при постоянном объёме будет равна:
СV dU . dT V
Теплоёмкость при постоянном давлении:
|
|
U |
|
dV |
|
||
|
|
|
|
||||
С C |
|
P |
|
|
|
, |
|
|
|||||||
P V |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
V T |
|
dT P |
|
||
А разность теплоемкостей при постоянных давлении и объёме:
|
|
U |
|
dV |
||
|
|
|
||||
С C |
|
P |
|
|
. |
|
|
||||||
P V |
|
|
|
|
|
|
|
|
|
|
|||
|
|
V T |
|
dT P |
||
Уравнение состояния и внутренняя энергия идеального газа
Определение уравнения состояния и внутренней энергии — предмет изучения термодинамики. Уравнение состояния — уравнение, которое связывает термодинамические параметры: массу m или количество вещества (не учитываем при рассмотрении одного моля), объём V, давление P и температуру T:
f(P,V,T) 0.
Лекции по курсу физики. Ч.1. Механика.
Разработчик: к.ф.-м.н., доцент каф. физики Матвеев И.В.

2.2. I начало термодинамики. Теплоёмкость |
25 |
Идеальный газ — газ, строго подчиняющийся законам Бой- ля-Мариотта, Гей-Люссака и Авогадро. Из этих трех законов выводится уравнение Клапейрона (Менделеева-Клапейрона). Для одного моля :
PVm RT.
Для идеального газа выполняется экспериментальный закон Джоуля: внутренняя энергия идеального газа при неизменной температуре не зависит от его объёма:
Uид.г. U(T).
В этом случае для идеального газа выполняется следующее соотношение:
dUm UTm V dT CVdT.
Для идеального газа произвольной массы: dU CVdT.
Для идеального одноатомного газа выполняется основное уравнение МКТ газов:
P13 nm0  v2
v2  32 n
32 n  Wкин
Wкин  .
.
Сучетом уравнения состояния идеального газа
|
N |
RT |
|
|
|
|
|
|
|
|
|
|
|
|
|
P |
NA |
|
N |
|
R |
T nk T |
|
|
|
|
|||||
|
V |
|
|
|
|
B |
|
|
|
V NA |
|||||
для средней кинетической энергии молекул получим
1
 Wкин
Wкин  3 2kBT.
3 2kBT.
В классической физике выводится закон равнораспределения:
на каждую степень свободы молекулы приходится в среднем одинаковая кинетическая энергия, равная 12 kBT.
Таким образом, для одной молекулы получим:
i  Wкин
Wкин  2 kBT,
2 kBT,
Лекции по курсу физики. Ч.1. Механика.
Разработчик: к.ф.-м.н., доцент каф. физики Матвеев И.В.

26 Лекция 2. Элементы термодинамики (ТД)
где i — число степеней свободы. Для идеального однокомпонентного газа
U |
|
N |
W |
|
i |
N k T |
i |
RT. |
|
|
2 |
||||||
|
m |
|
A кин |
|
2 A B |
|
||
|
|
|
|
C |
Qm |
|
dUm |
|
i |
R. |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
V |
|
dT |
|
|
|
dT |
|
2 |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
C |
Qm |
|
|
dUm PdVm |
C |
|
RdT |
|
i 2 |
R. |
|
||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
P |
dT |
|
|
dT |
|
|
|
|
|
V |
|
|
|
|
dT |
2 |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
Закон Майера: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
CP CV R. |
|
|
|
|
|
|
|
|
|
|
|||||||
Постоянная адиабаты: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
CP |
|
i 2 |
1 |
2 |
. |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
C |
|
i |
|
|
|
|
|
i |
|
|
|
|
||||||
|
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Число степеней свободы — число независимых координат, необ- |
||||||||||||||||||||||||
ходимых для задания |
положения молекулы газа. |
|
||||||||||||||||||||||
Для одноатомного газа i 3. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Для двухатомных молекул с жесткой связью i 5 (3 |
поступа- |
|||||||||||||||||||||||
тельных степени свободы и 2 вращательных). |
|
|
|
|
||||||||||||||||||||
Для |
двухатомных |
|
молекул |
|
|
с |
упругой |
связью |
||||||||||||||||
i iпост |
iвр 2 iкол 7 (3 поступательных степени свободы, 2 вра- |
|||||||||||||||||||||||
щательных и 2 колебательных).
При колебательном движении полная энергия складывается из потенциальной и кинетической, поэтому энергоёмкость колебательных степеней свободы в 2 раза больше: одна на кинетическую и одна на потенциальную энергии. В статистической физике доказано, что ни один вид движения не имеет преимущества перед другими. Отсюда следует, что энергоёмкость всех степеней свободы одинакова и равна 12 kBT.
Выводы по теме
Текст
Вопросы для самоконтроля по теме
1) ...;
Лекции по курсу физики. Ч.1. Механика.
Разработчик: к.ф.-м.н., доцент каф. физики Матвеев И.В.

2.3. Применение первого начала термодинамики к изопроцессам |
27 |
2) ...; N) ... .
2.3. Применение первого начала термодинамики к изопроцессам
Детализированные цели изучения раздела.
Текст
Изохорный процесс
m const, V const, PT const.
Запишем 1-ый закон термодинамики:
Q dU A dU.
В ходе изохорного процесса система работы не совершает A 0 (dV 0) и вся теплота, переданная системе, идет на приращение внутренней энергии.
Молярная теплоёмкость при постоянном объеме — это количество теплоты, необходимое для нагревания 1-го моля газа в закрытом сосуде на 1К:
C |
Q |
|
dU Q C dT |
|
dT |
||||
V |
|
V |
U Q CV dT CV T2 T1 .
Изобарный процесс
m const, P const, VT const.
C |
|
Q |
|
dU PdV |
. |
dT |
|
||||
P |
|
|
dT |
||
Для идеального газа энергия зависит только от температуры: dU CVdT,
а из уравнения состояния при постоянном объеме:
PV RT |
PdV RdT. |
Лекции по курсу физики. Ч.1. Механика.
Разработчик: к.ф.-м.н., доцент каф. физики Матвеев И.В.

28 Лекция 2. Элементы термодинамики (ТД) |
|
|
|
C |
CVdT RdT |
C |
R. |
|
|||
P |
dT |
V |
|
|
|
|
|
Полученное уравнение называется уравнением Майера:
CP CV R .
A PdV RdT R T.
Q U A CV T R T CP T.
Рассмотрим физический смысл газовой постоянной R:
A R T |
|
R |
A |
. |
|
||||
|
|
|
T |
|
Газовая постоянная R численно равна работе, совершённой газом при изобарном нагревании 1 моля газа на 1К.
Изотермический процесс
m const, |
T const, |
PV const. |
|
|
|
|
||||
|
dU CVdT 0, |
dT 0 (T const). |
||||||||
|
|
C |
Q |
|
. |
|
|
|
|
|
|
|
dT |
|
|
|
|
||||
|
|
T |
|
|
|
|
|
|
||
|
|
Q dU A A. |
|
|
|
|
||||
|
PV RT |
|
P RT |
1 |
|
|
|
|||
|
V |
|
|
|||||||
|
|
|
|
|
|
|
|
|
||
|
V2 |
|
V2 |
dV |
|
|
V |
|||
|
A pdV RT |
|
RT ln |
2 |
. |
|||||
|
V |
V |
||||||||
|
V1 |
|
V1 |
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|||
Адиабатический процесс
Процесс, протекающий без теплообмена с окружающей средой:
Q dU A 0 |
|
dU A. |
||
Получим уравнение адиабаты: |
|
|
|
|
|
CVdT PdV |
|
||
Из уравнения состояния идеального газа: |
||||
PV RT |
|
PdV VdP RdT. |
||
Лекции по курсу физики. Ч.1. Механика.
Разработчик: к.ф.-м.н., доцент каф. физики Матвеев И.В.

2.3. Применение первого начала термодинамики к изопроцессам |
29 |
|||||||
Исключим из полученных уравнений dT: |
|
|
|
|||||
PdV VdP |
RPdV |
PdV |
CP CV |
PdV |
1 , |
|
||
C |
|
|
||||||
|
|
|
C |
|
|
|
||
|
|
V |
|
V |
|
|
|
|
где CP CV 1 R CV 1 — постоянная адиабаты. |
|
|
||||||
VdP PdV 0 |
|
V dP PV 1dV 0 |
|
d PV 0 |
|
|||
В итоге получим уравнение адиабаты или уравнение Пуассона:
PV const .
Для адиабаты получим:
dVdP VP .
Из изотермы:
PV const |
|
PdV VdP 0 |
|
dP |
|
P |
. |
dV |
|
||||||
|
|
|
|
|
V |
||
Наклон адиабаты в раз круче изотермы.
P,кПа |
|
|
|
600 |
|
|
|
500 |
|
|
|
400 |
|
|
|
300 |
|
|
|
200 |
|
|
|
100 |
|
|
|
100 |
200 |
300 |
V,л |
400 |
|||
|
T2 |
|
|
A CVdT CV T1 T2 . |
|
||
|
T1 |
|
|
Политропический процесс |
|
||
Политропический процесс — процесс, протекающий с постоянной теплоёмкостью.
Лекции по курсу физики. Ч.1. Механика.
Разработчик: к.ф.-м.н., доцент каф. физики Матвеев И.В.

30 Лекция 2. Элементы термодинамики (ТД)
Получим уравнение политропы
CdT CVdT PdV
C CV dT PdV
|
|
dT |
PdV |
|
|
|
|
|
|
|
|
|
C C |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
V |
|
|
|
|
|
|
|
|
PdV VdP RdT R |
PdV |
|
|
|
||||
|
|
C C |
|
|
||||||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
V |
|
|
|
C C |
|
C C C C |
|
|
C C |
|
||||
|
P V |
|
P |
V |
V |
|
|
P |
|
|
|
|
|
|
|||||||
VdP |
|
1 PdV |
|
|
|
|
PdV |
|
PdV |
|
C C |
|
C C |
|
C C |
||||||
|
|
|
|
|
|
|
||||
|
V |
|
|
|
V |
|
|
|
V |
|
VdP C CP PdV 0
C CV
Введем показатель политропы
n C CP C CV
VdP nPdV 0
Решением данного уравнения является
|
P Vn const |
|
P1 n V const |
|
|||||||||
C CP n(C CV ) |
nCV CP C n 1 |
||||||||||||
|
|
nCV CP |
|
C |
CP |
|
|
||||||
|
|
|
|
||||||||||
|
C |
|
V |
|
|
n |
|
||||||
|
|
n 1 |
|
|
|
1 |
|
|
|
|
|||
|
|
|
|
1 |
|
|
|
|
|||||
|
|
|
|
n |
|||||||||
Исходя из полученного уравнения, получаем:
1) изотермический процесс — C , |
n 1, |
PV const. |
2)изобарный процесс — C CP, n 0, P const.
3)изохорный процесс — C CV , n , V const.
4)адиабатный процесс — n , PV const
Получим выражение для работы, которую совершает система в ходе политропического процесса
Лекции по курсу физики. Ч.1. Механика.
Разработчик: к.ф.-м.н., доцент каф. физики Матвеев И.В.
