
коллоквиум по химии вопросы 1-15
.docx-
Наименьшей частью химического элемента, определяющей его основные свойства, является атом. В конце XIX в. французский физик А. Бек-керель открыл явление радиоактивного излучения. Английский физик Э. Резерфорд исследовал природу этого излучения. Оказалось, что пучок радиоактивного излучения в сильном магнитном поле разделился на три части: а-, b- и у-излуче-ния. b-Лучи представляют собой поток электронов, а-лучи — ядро атома гелия, у-лучи — коротковолновое электромагнитное излучение. Явление естественной радиоактивности указывает на сложное строение атома.
-
Планетарная модель атома, или модель Резерфорда, - историческая модель строения атома, которую предложил Эрнест Резерфорд в результате эксперимента с рассеянием альфа-частиц. По этой модели атом состоит из небольшого положительно заряженного ядра, в котором сосредоточена почти вся масса атома, вокруг которого движутся электроны, - подобно тому, как планеты движутся вокруг Солнца. Планетарная модель атома соответствует современным представлениям о строении атома с учётом того, что движение электронов имеет квантовый характер и не описывается законами классической механики. Исторически планетарная модель Резерфорда пришла на смену «модели сливового пудинга» Джозефа Джона Томсона, которая постулирует, что отрицательно заряженные электроны помещены внутрь положительно заряженного атома.
-
В 1924 году французский физик Луи де Бройль высказал гипотезу о том, что установленный ранее для фотонов корпускулярно-волновой дуализм присущ всем частицам — электронам, протонам, атомам и так далее, причём количественные соотношения между волновыми и корпускулярными свойствами частиц те же, что и для фотонов. Таким образом, если частица имеет энергию
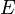 и
импульс, абсолютное значение которого
равно
и
импульс, абсолютное значение которого
равно
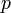 ,
то с ней связана волна, частота которой
,
то с ней связана волна, частота которой
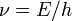 и
длина волны
и
длина волны
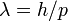 ,
где
,
где
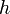 —
постоянная Планка. Эти волны и получили
название волн
де Бройля.
—
постоянная Планка. Эти волны и получили
название волн
де Бройля. -
Квантово-механическое представление об атоме.
Строение атома. Ядро атома состоит из положительнозаряженных протонов, не имеющих заряда нейтронов. Ядро окружают отрицательно заряженные Электроны. Электроны движутся вокруг ядра по неопределенной траектории. Химические свойства атома определяется концентрацией электромагнитной оболочки. Положение в таблшице менделеева определяется электрическим зарядом его ядра. если атом находиться в нейтральном состояни, то количество электронов равно количеству протонов. Основная масса атома сосредоточена в ядре.
-
Принцип неопределенности гейзенберга
классическая механика – скорость частицы, траектория.
Квантовая механияка – вероятность нахождения частицы в точке пространства – понятие импульса . -неопределенности. - постоянная планка. Невозможно определить положение и скорость частицы атомного масштаба (чем точнее одно, тем неопределеннее другое).
-
Временная эволюция системы в квантовой физике в нерелятивистском случае описывается уравнением Шредингера
![]()
являющимся аналогом уравнения Ньютона в классической физике. Если потенциал U не зависит от времени t U = U(x,y,z), то решение уравнения Шредингера имеет вид
![]()
где E – полная энергия квантовой системы, а волновая функция ψ(x,y,z) удовлетворяет стационарному уравнению Шредингера
![]()
Волнова́я
фу́нкция,
или пси-функция ![]() — комплекснозначная функция, используемая
в квантовой механике для описания
чистого состояния системы. Является
коэффициентом разложения вектора
состояния по базису (обычно координатному):
— комплекснозначная функция, используемая
в квантовой механике для описания
чистого состояния системы. Является
коэффициентом разложения вектора
состояния по базису (обычно координатному):
![]()
где
![]() —
координатный базисный вектор, а
—
координатный базисный вектор, а
![]() —
волновая функция в координатном
представлении.
—
волновая функция в координатном
представлении.
Физический смысл волновой функции заключается в том, что согласно копенгагенской интерпретации квантовой механики плотность вероятности нахождения частицы в данной точке пространства в данный момент времени считается равной квадрату абсолютного значения волновой функции этого состояния в координатном представлении.
-
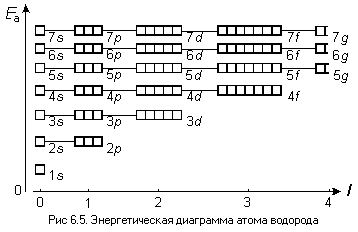
Квантовые числа — энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится.
Главное квaнтовое число n определяет общую энергию электрона и степень его удаления от ядра (номер энергетического уровня); оно принимает любые целочисленные значения, начиная с 1 (n = 1, 2, 3, . . .)
Орбитальное (побочное или азимутальное) квантовое число l определяет форму атомной орбитали. Оно может принимать целочисленные значения от 0 до n-1 (l = 0, 1, 2, 3,..., n-1). Каждому значению l соответствует орбиталь особой формы. Орбитали с l = 0 называются s-орбиталями, l = 1 – р-орбиталями (3 типа, отличающихся магнитным квантовым числом m), l = 2 – d-орбиталями (5 типов), l = 3 – f-орбиталями (7 типов).
Магнитное квантовое число m определяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля. Его значения изменяются от +l до -l, включая 0. Например, при l = 1 число m принимает 3 значения: +1, 0, -1, поэтому существуют 3 типа р-АО: рx, рy, рz.
Спиновое
квантовое число s
может принимать лишь два возможных
значения +1/2 и -1/2. Они соответствуют двум
возможным и противоположным друг другу
направлениям собственного магнитного
момента электрона, называемого спином
(от англ. веретено).
Для обозначения электронов с различными
спинами используются символы:
![]() и
и
![]() .
.
-
 Электронное
облако - область пространства вблизи
ядра атома, к которойсосредот. преобраз.
часть заряда и массы электрона. Плотность
тем больше, чем больше вероятность
обнаружения электрона в области
Электронное
облако - область пространства вблизи
ядра атома, к которойсосредот. преобраз.
часть заряда и массы электрона. Плотность
тем больше, чем больше вероятность
обнаружения электрона в области
1s – сфера , обладает сферической симметрией . Расположение по одну сторону от оси абсцисс.

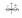 2p
-
2p
-
сосредоточено в оси x, в плоскости y,z электронного облака нет.
d-(l=2)
Четырехлепестковая фигура, знаки волновой среды чередуются
Пространственная орбита.
-
Стационарное строение электрона : не излучает магнитной энергии. Характеризуюется состоянием стоячей волны де бройля (минимальное значение его энергии), другое – возбужденное – волна де бройля имеет переменное значение , Энергия ионизации – энергия гид расходуемая для отрыва электрона от атома.
Потенциальная ионизация – минимальное напряжение поля, при котором атом ионизируется A=
чем меньше I, тем легче атом отдает электрон, тем активнее Ме i1,i2<i3<…<in.СРОДСТВО ЭЛЕКТРОНу – это энергия выделяющаяся при присоединении электрона к электроотриц. атому: A+
Электроотрицательность – способность атома притягивать к себе электроны. Эо= e – Сродство к электрону. Для удобства используют значения относительной электроотрицательности(ЭО).
|
Cs |
Li |
c,s |
n, cl |
o |
f |
|
0,7 |
1,0 |
2,5 |
3,0 |
3,5 |
4,0 |
-
Состояние электронов в атоме с позиции квантово-механической модели оп- ределяется плотностью вероятности обнаружения электрона в данной области про- странства
Электроны в атоме расположены на энергетических уровнях, которые со- держат различные энергетические подуровни, состоящие, в свою очередь, из определенного количества атомных орбиталей: s- подуровень состоит из одной, р- подуровень ─ из трех, d- подуровень ─ из пяти и f- подуровень ─ из семи орбиталей. Условная запись, представляющая распределение электронов атома по энерге- тическим уровням и подуровням (атомным орбиталям), называется электронной формулой атома. Для составления электронной формулы, в которой представ- лено состояние каждого электрона (его энергия, форма орбитали, магнитные ха- рактеристики), необходимо знать: − последовательность заполнения подуровней электронами (принцип наименьшей энергии), − максимальную емкость каждого подуровня.
-
Паули сформировал принцип исключения, согласно которому в системе одинаковых фермионов любые два из них не могут одновременно находиться в одном и том же состоянии.
Напомним, что состояние электрона в атоме однозначно определяется набором четырех квантовых чисел: n, l, m, ms
· главного n ; (n= K, L, M, N)
· орбитального l ,(l=s, p, d, f) обычно эти состояния обозначают 1s, 2d, 3f;
· магнитного m; (0, ±1, ±2, ±2 … ±l)
· магнитного спинового ms. (±1/2)
Распределение электронов в атоме происходит по принципу Паули, который может быть сформулирован для атома в простейшем виде: в одном и том же атоме не может быть более одного электрона с одинаковым набором четырех квантовых чисел: n, l, m, m5 :
Z (n, l,m ,ms ) = 0 или 1,
Таким образом, принцип Паули утверждает, что два электрона, связанные в одном и том же атоме различаются значениями, по крайней мере, одного квантового числа.
Максимальное число Z2(n,l,ms) электронов, находящихся в состояниях, описываемых набором трех квантовых чисел n, l и m, и отличающихся только ориентацией спинов электронов равно:
Z2(n,l,m)=2
Максимальное число Z3(n,l) электронов, находящихся в состояниях, определяемых двумя квантовыми числами n и l:
Z3(n,l)=2(2l+1)
Максимальное число электронов, находящихся в состояниях, определяемых значением главного квантового числа n, равно:
Z(n)=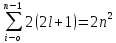
-
Правило Клечковского (принцип наименьшей энергии) – последовательность заселения электронами энергетических уровней и подуровней в атоме должна отвечать наибольшей связи электронов с ядром, т.е. электронная система должна обладать наименьшей энергией. Порядок заполнения энергетических состояний определяется стремлением атома к минимальному значению суммы главного и побочного квантовых чисел, причем при фиксированном значении (n + l) заполняются состояния, отвечающие минимальному значению n.
-
Проскок (провал) электрона – переход s-электронов наружного слоя на места d-подуровня. Это связано с тем, что нарушения заполнения электронных оболочек (1s, 2s, 2p, 3s, 3p, 4s, 3d и так далее) позволяют затрачивать атомам некоторых элементов (Cr, Cu, Ar, Au, Pd) меньше энергии по сравнению с заполнением электронных оболочек "по правилам".
Пример.
Cr
(Хром): должно быть -
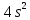 3
3 ,
но на самом деле - 4
,
но на самом деле - 4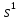 3
3 .
.
Общие
примеры: Cr
(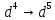 ),
CuArAu
(
),
CuArAu
(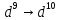 ),
Pd
(
),
Pd
(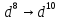 )
)
Электроннаяформулаатома–№11 Na (1s22s22p63s1), № 22 Ti (1s22s22p63s23p64s23d2)
Электронная
формула иона -Ион
образуется из атома в результате приёма
или отдачи валентных электронов. Значит,
чтобы получить электронную формулу
иона, нужно составить электронную
формулу атома, а затем изменить число
электронов. Например, электронная
формула Na
(1s22s22p63s1).
Атом натрия отдаёт 1 электрон. Получаем
электронную формулу иона
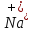 :
1s22s22p6
. Валентными не являются электроны
f-подуровня.
Пример: Ta(Тантал)(
:
1s22s22p6
. Валентными не являются электроны
f-подуровня.
Пример: Ta(Тантал)( ).
Валентными являются электроны последнего
уровня
).
Валентными являются электроны последнего
уровня
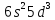 .
Ион
.
Ион
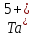 при
взаимодействии отдает пять электронов.
В результате чего, его электронная
формула:
при
взаимодействии отдает пять электронов.
В результате чего, его электронная
формула:
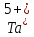 (
(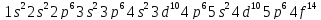 ).
).
-
Правило Гунда: при данном значении побочного квантового числа (L) электроны в атоме располагаются так, чтобы суммарное спиновое число было максимальным.
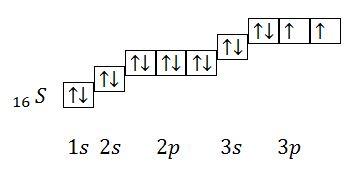
15. Переодический закон Д.И.Менделеева
1) 1869г. – уточнее атомных масс многих элементов, свойства оксидов и т.д.
2) отклонение в законе: ar-k; c0-N; te-y;тв-p0.
3) Свойства простых тел , а так же формы и свойства соединений, находятся в переодической зависимости от величин атомных весов.
закон мозли. Если облучать элемент рентгеновским излучением, то возникает новое излучениеЮ причем этого излучения является линейной функцией от заряда.
