
Mec-lab-2006
.pdf
δη = áηñ |
VA |
- VB |
1 |
|
. |
(7) |
||
|
|
× |
|
|
|
|||
(V2 |
- V1 ) |
|
|
|
||||
|
n |
|||||||
5. Оценить систематическую погрешность коэффициента вязкости для одного из опытов. Из формулы (5) согласно формуле (10) на с. 10 следует
θη = áηñ |
æ |
θ t ö2 |
æ |
2θ r ö2 |
æ |
θ l ö |
2 |
|
||||
ç |
|
÷ |
+ ç |
|
÷ |
+ ç |
|
÷ . |
||||
t |
r |
l |
||||||||||
|
è |
ø |
è |
ø |
è |
ø |
|
|
||||
6. Оценить суммарную погрешность
η = 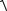
 (θη)2 + (δη)2 .
(θη)2 + (δη)2 .
Если одна из погрешностей меньше другой более чем в три раза, то меньшей пре- небречь.
7. Записать ответ в виде
η = áηñ ± η , Р = 0,95.
81
РАБОТА № 15
ИЗУЧЕНИЕ ВЯЗКОСТИ ВОЗДУХА
Цель: определение коэффициента вязкости воздуха и исследование зависимости объёма воздуха, протекающего через капилляр, от его раз- меров.
Оборудование: набор капилляров, стеклянный баллон, насос, мано- метр, барометр, секундомер.
Описание метода измерений
Явления переноса – это процессы установления равновесия в систе- ме путём переноса массы (диффузия), энергии (теплопроводность) и им- пульса молекул (внутреннее трение или динамическая вязкость).
В явлении вязкости наблюдается пе-
ренос импульса от более быстрых участков потока к менее быстрым. При течении газа или жидкости, на- пример внутри трубы, скорости слоев различны: их распределение при ла- минарном течении показано на рис. 1 (длина стрелки показывает скорость данного слоя). Причиной этого явля-
Рис. 1 ется хаотическое тепловое движение молекул, при котором они непрерыв-
но переходят из слоя в слой и в соударениях с другими молекулами обме- ниваются импульсами. Так, молекулы второго слоя, попадая в слой 1, пе- реносят свой импульс направленного движения m0u2 , а в слой 2 приходят
молекулы с меньшим импульсом m0u1. В результате второй слой тормо-
зится, а первый – ускоряется. Опыт показывает, что импульс dp, переда- ваемый от слоя к слою через поверхность S, пропорционален градиенту скорости du/dx, площади S и времени переноса dt:
dp = −η dudx Sdt .
В результате между слоями возникает сила внутреннего трения (закон Ньютона)
F = |
dp |
|
= η |
du |
S , |
(1) |
dt |
|
|||||
|
|
|
dx |
|
||
где η – коэффициент вязкости среды.
82

Для идеального газа коэффициент вязкости |
|
||||
η = |
1 λvρ . |
|
(2) |
||
|
|
3 |
|
|
|
Средняя длина свободного пробега молекул |
|
||||
λ = |
|
kT |
, |
(3) |
|
|
|
πd 2 P |
|||
2 |
|||||
где k = 1,38×10–23 Дж/К – постоянная Больцмана,
d – эффективный диаметр молекул (для воздуха d @ 4×10–10 м), Т, Р – температура и давление газа.
Средняя скорость теплового движения молекул
v = |
|
8RT |
|
, |
(4) |
|
|||||
|
|
πM |
|
||
где R = 8,31 Дж/моль×К – универсальная газовая постоянная, |
|
||||
М – масса одного моля газа (для воздуха М = 28,9 г/моль). |
|
||||
Плотность газа согласно уравнению состояния идеального газа |
|
||||
ρ = PM . |
(5) |
||||
|
|
RT |
|
||
При ламинарном течении через трубу круглого сечения радиусом r (капилляр) и длиной L за время t протекает газ или жидкость, объём V ко- торых определяется по формуле Пуазейля:
V = |
|
1 |
π r4 |
Pt , |
(6) |
|
η |
8 L |
|||||
|
|
|
||||
где Р – разность давлений на концах капилляра.
Если в баллоне создать избыточное над атмосферным Р0 давле-
ние
Р = Р – Р0 = ρжgh (ρж – плотность жидкости в манометре, h – разность уровней жидкости) и соединить капилляр с атмосферой, то за время dt че-
рез капилляр вытечет некоторое количество воздуха, масса которого |
|
dm = ρdV, |
(7) |
где ρ – плотность воздуха в капилляре, зависящая (см. формулу (5)) от давления воздуха, dV – объём вышедшего воздуха.
Давление воздуха в капилляре изменяется от Р0 до Р0 + ρgh, но так, как ρgh << Р0, то с достаточной точностью можно принять давление воздуха в капилляре равным атмосферному Р0. Тогда плотность воздуха (из уравне-
ния Менделеева–Клапейрона) |
|
ρ = Р0 М . |
(8) |
RT
Объём воздуха dV, прошедшего через капилляр за время dt, описы- вается формулой Пуазейля (6):
83
dV = |
πr4 |
P t = |
πr4 |
ρж ghdt , |
(9) |
|
8ηL |
8ηL |
|||||
|
|
|
|
а масса воздуха, вытекающего из баллона, с учётом формул (8) и (9)
|
P Mπr4 |
|
|
|
dm = ρdV = |
0 |
ρж gh dt . |
(10) |
|
8RTηL |
||||
|
|
|
Из уравнения состояния идеального газа выразим изменение массы газа dm в баллоне через уменьшение давления в нём.
Так как dP = ρжgdh, то
dm = |
MVб |
dP = |
MVб |
ρж g dh . |
(11) |
||||
|
|
|
|||||||
|
|
RT |
RT |
|
|||||
Исключая dm из уравнений (10) и (11), получаем |
|
||||||||
|
dh |
|
P πr4 |
|
|
|
|||
|
|
|
0 |
|
|
|
|
||
− |
|
= |
|
dt . |
(12) |
||||
h |
V 8Lη |
||||||||
|
|
|
|
б |
|
|
|
||
Решая это дифференциальное уравнение при условии, что за время опыта давление в баллоне уменьшится от ρжgh0 до ρжgh, получаем
|
πr4P |
|
|
|
lnh = lnh − |
0 |
t . |
(13)* |
|
8LηV |
||||
0 |
|
|
||
|
б |
|
|
Таким образом, формула (13) связывает разность давлений h на концах капилляра с временем t истечения воздуха, его вязкостью η и размерами капилляра r и L.
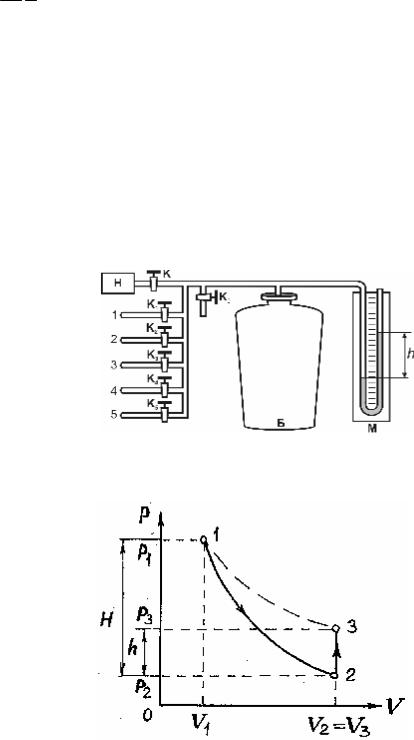
Описание установки
Установка состоит из баллона Б, жидкостного манометра М и набора ка- пилляров (1–5), соединенных с баллоном кранами (К1 – К5). Давление воздуха в
баллоне до необходимого можно повысить с помощью компрессора при открытом кране К и закрытых кранах (К1 – К5) и К0. Кран К0 используется для практически мгновенного выпускания воздуха из баллона.
В установках капилляры соединены параллельно различного сечения (рис. 2). Если при закрытых кранах К и К0 открыть кран К1 (при закрытых кранах К2 – К5), то воздух из баллона будет вытекать через первый капилляр. Если открыть кран К2 (при закрытых кранах К1, К3, К4 и К5), то воздух будет вытекать через второй капилляр и т.д.
84
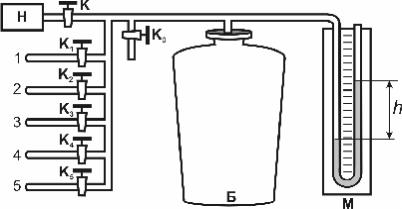
Рис. 2 Примечание: сечение соединительных трубок много больше сечения капил-
ляра и их сопротивление практически равно нулю, так как сопротивление про- порционально r4 (формула Пуазейля (6)).
Выполнение работы
1.Внести в таблицу параметры установки: объем баллона Vб, длину капилляра L, радиусы капилляров и атмосферное давление Р0.
2.Закрыть краны (К1–К5) и К0. Открыть кран К, включить компрессор. Когда давление в баллоне достигнет 200…250 мм водяного столба, вы- ключить компрессор и закрыть кран К.
3.Выждав 1–2 мин, открыть кран К1. Когда установится стационарный
режим течения воздуха через капилляр и избыточное давление в баллоне снизится до выбранного вами давления h0 (скажем, 150 мм водяного стол-
ба), включить секундомер.
4.Когда давление в баллоне уменьшится в 3–5 раза (станет, скажем, 30 мм водяного столба) выключить секундомер и одновременно закрыть
кран К1. В таблицу записать показания секундомера t, h0 и h.
Примечание. Во всех последующих опытах начальные h0 и конечные h давления должны быть точно такими же (их разброс будет определять систематическую погрешность опыта).
5.Повторить этот опыт еще дважды и найти среднее значение t1.
6.Провести аналогичные измерения (п.п. 2–5) для капилляров раз- личного радиуса. Полученные результаты внести в таблицу.
|
|
|
|
|
|
|
|
|
|
Таблица |
№ |
r, м |
t, c |
tср, c |
r4, м4 |
|
η |
áηñ |
Vб = 0,021 м3 |
||
1 |
|
|
|
|
|
|
|
P0 |
= |
Па |
2 |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
h0 |
= |
м |
|
3 |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
85 |
|
|
|
|
|

4 |
|
|
|
|
|
|
|
|
|
|
|
h |
= |
м |
5 |
|
|
|
|
|
|
|
|
|
|
|
L |
= |
м |
|
7. Определить коэффициент вязкости воздуха для каждого значения |
|||||||||||||
радиуса по формуле (13): |
πr4P t |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
η = |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
8LV ln |
h0 |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
б |
h |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|||||
изаписать в таблицу.
8.Рассчитать среднее значение коэффициента вязкости áηñ и записать в таблицу.
9.Оценить случайную погрешность измерения коэффициента вязко- сти воздуха (см. формулу (2) на с. 6):
|
|
|
|
|
|
δη = t p |
å(ηi - η )2 |
. |
|||
n( n - 1 ) |
|||||
|
|
|
|
||
10.Записать ответ в виде η = 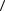 η
η ± δη , Р = 0,95.
± δη , Р = 0,95.
11.Сравнить коэффициент вязкости воздуха с табличным значением. Сделать вывод.
86

ТЕРМОДИНАМИКА
РАБОТА №16
ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ ТЕПЛОЕМКОСТЕЙ ВОЗДУХА
Цель работы: изучить процессы, протекающие в газе при определении отно- шения теплоемкостей методом Клемана — Дезорма и измерить отношение Ср/СV для воздуха.
Оборудование: установка, состоящая из стеклянного баллона, манометра, компрессора, секундомер.
Описание метода
Приращение внутренней энергии идеального газа при изменении его темпе-
ратуры на dT
dU = 0,5iνRdT. |
(1) |
Число степеней свободы i молекулы – это число независимых координат, оп- ределяющих положение молекулы в пространстве: i = 3 для одноатомной, i = 5 для двухатомной, i = 6 для трех- и многоатомной; ν = m/M – количество вещества (число молей).
Молярная теплоемкость С – величина, равная количеству тепла, которое нуж- но сообщить молю вещества, чтобы увеличить его температуру на один кельвин:
С = νdQdT .
Если газ нагревать при постоянном объеме, то подводимое тепло расходуется только на увеличение его внутренней энергии dQV = dU и поэтому теплоемкость
газа при постоянном объеме |
|
CV = 0,5Ri . |
(2) |
При нагревании газа в условиях свободного расширения при постоянном дав- лении Р = const подводимое тепло расходуется как на приращение внутренней энергии, так и на совершение работы. Работа расширения одного моля газа в этих условиях при нагревании его на 1 К равна R. Таким образом, теплоемкость газа
при постоянном давлении определяется соотношением |
|
||||||||
C |
p |
= C |
+ R = |
i + 2 |
R . |
(3) |
|||
|
|
||||||||
|
V |
|
|
2 |
|
|
|
||
Отношение теплоемкостей γ называется показателей адиабаты: |
|
||||||||
|
|
γ = |
С р |
= |
i + 2 |
|
. |
(4) |
|
|
|
С |
|
i |
|||||
|
|
|
|
|
|
|
|||
|
|
|
V |
|
|
|
|
|
|
87
Адиабатическим называют процесс, протекающий без теплообмена с окру- жающей средой: dQ = 0. Из первого начала термодинамики для адиабатического
процесса
m i RdT = −PdV
M 2
следует, что адиабатическое расширение (dV > 0) сопровождается охлаждением (dT < 0) газа, а сжатие (dV < 0) – его нагреванием (dT > 0).
Уравнение адиабатического процесса (уравнение Пуассона)
|
PV γ = const . |
(5) |
Уравнение изотермического процесса |
|
|
|
PV = const. |
(6) |
Описание установки и метода измерений |
|
|
Измерения выполняют |
на установке |
|
(рис. 1), состоящей из большого стеклян- |
|
|
ного баллона Б, насоса Н и водяного ма- |
|
|
нометра 1. Баллон соединяют краном К с |
|
|
насосом, а краном К0 – с атмосферой. |
|
|
Краны К1 ÷ К5 в данной работе не исполь- |
|
|
зуются и должны быть закрыты. |
|
|
Метод, предложенный Клеманом и |
|
|
Дезормом (1819 г.) основан на изучении |
|
|
параметров некоторой массы газа, пере- |
Рис. 1 |
|
ходящей из одного состояния в другое |
||
двумя последовательными |
процессами: |
|
адиабатическим и изохорическим.
Эти процессы на диаграмме P–V (рис. 2) представлены кривыми 1–2 и 2–3 соот- ветственно. Если накачать воздух в бал- лон и выдержать до установления тепло- вого равновесия с окружающей средой, то в этом начальном состоянии 1 газ имеет параметры Р1, V1, T1, причем температура газа в баллоне равна температуре окру- жающей среды, а давление Р1 = Р0 + Р′ немного больше атмосферного Р0.
Рис. 2 При открывании крана К0 воздух в баллоне перейдет в состояние 2. Его давле-
ние снизится до атмосферного Р2 = Р0. Оставшаяся масса воздуха, которая зани- 88
мала в состоянии 1 часть объема баллона, расширяясь, займет весь объем V2. При этом температура воздуха, оставшегося в баллоне, уменьшится. При быстром расширении газа можно пренебречь его теплообменом с окружающей средой че- рез стенки баллона и считать процесс 1–2 адиабатическим:
Р V γ = Р V γ = Р V γ . |
(7) |
|||||
1 |
1 |
2 |
2 |
0 |
2 |
|
После закрытия крана К0 охлажденный адиабатическим расширением воздух в баллоне будет нагреваться (процесс 2–3) до температуры окружающей среды Т3 = Т1 при постоянном объеме V2 = V3. При этом давление в баллоне возрастет до
Р3 = Р2 + Р¢¢.
Избыточное давление воздуха Р′ и Р′′ измеряют с помощью U-образного
манометра по разности уровней жидкости с плотностью ρ: |
|
|
|||||||||||||||||
|
|
Р¢ = ρgH, |
|
|
|
|
|
|
Р¢¢ = ρgh, |
|
|
|
|||||||
где H и h – показания манометра в состояниях 1 и 3 соответственно. |
|
||||||||||||||||||
Тогда |
Р1 = Р0 + ρgH, |
|
|
|
Р3 = Р0 + ρgh. |
(8) |
|||||||||||||
|
|
|
|
||||||||||||||||
Состояния воздуха 1 и 3 принадлежат изотерме, поэтому |
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
Р1V1 = P3V3. |
|
|
|
|
(9) |
||||||
Исключив отношение объемов из уравнений (7) и (9), найдем связь давлений |
|||||||||||||||||||
газа: |
|
|
|
|
|
|
|
|
|
|
öγ |
|
|
|
|
öγ |
|
|
|
|
|
|
Р1 |
æ |
|
Р1 |
|
æ |
Р1 |
/ P0 |
|
|
|
||||||
|
|
|
ç |
|
÷ |
ç |
÷ |
|
|
|
|||||||||
|
|
|
|
|
|
= ç |
|
|
|
|
÷ |
= ç |
|
|
÷ . |
|
|
|
|
|
|
|
Р |
0 |
|
Р |
3 |
|
P / P |
|
|
|
|||||||
|
|
|
|
|
è |
|
|
ø |
è |
3 |
0 |
ø |
|
|
|
||||
Выразим давление Р1 и Р2 через Р0 с учетом (8) и прологарифмируем: |
|
||||||||||||||||||
æ |
|
ρgH |
ö |
|
æ |
|
æ |
|
ρgH |
ö |
æ |
ρgh |
öö |
|
|||||
lnç1 + |
|
÷ |
= γ |
çlnç1 |
+ |
÷ - lnç1 + |
÷÷ . |
|
|||||||||||
|
|
|
|
|
|
|
|||||||||||||
ç |
|
P0 |
÷ |
|
ç |
|
ç |
|
P0 |
÷ |
ç |
P0 |
÷÷ |
|
|||||
è |
|
ø |
|
è |
|
è |
|
ø |
è |
øø |
|
||||||||
С учетом того, что если х << 1, то ln(1 + x) = х, получим расчетную формулу в
следующем виде: |
H |
|
|
|
γ = |
. |
(10)* |
||
H - h |
||||
|
|
|
Таким образом, для определения отношения теплоемкостей воздуха достаточ- но осуществить процессы (1–2–3) и измерить показания манометра H и h в со- стояниях газа 1 и 3 соответственно.
Но осуществить равновесный адиабатический процесс сложно: если прово- дить расширение газа быстро, то процесс не будет равновесным, так как темпера- тура и давление газа не успевают выравниваться по объему. Для проведения мед- ленного адиабатического процесса нужна тепловая изоляция баллона. В данной установке за время t расширения газа подводится тепло. Поэтому при последую- щем изохорическом нагревании давление поднимается меньше, т.е. измеряемое h¢ < h, необходимого для расчета γ. По мере увеличения времени расширения газа
89
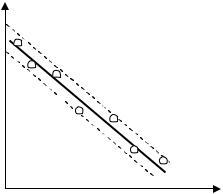
значение h′ снижается, приближаясь к нулю при t → ∞ (изотермическое расшире- ние 1–3). Опытным путем установлено, что
h′ = he−at . |
|
|
Логарифмируя эту функцию, получаем зависимость: |
|
|
′ |
|
(11) |
ln h = lnh − at , |
||
где а – постоянная установки, |
|
|
t – время протекания процесса, в течение которого баллон сообщается с атмо- |
||
сферой. |
lnh′ |
|
График зависимости (11) конечного |
|
|
избыточного давления воздуха в баллоне |
lnhmax |
|
от времени контакта его с атмосферой по- |
lnh |
|
казан на рис. 3. |
lnhmin |
|
Построив по данным эксперимента |
|
|
такой график, можно путем экстраполя- |
|
|
ции опытной прямой до t = 0 определить |
|
|
значение lnh, а по нему значение h, не- |
|
|
обходимое для расчета γ по формуле |
|
|
(10). |
0 |
t |
|
||
|
|
Рис. 3 |
Выполнение работы
1.Закрыть кран К0, открыть кран К, включить компрессор и накачать воздух в баллон до избыточного давления 230…250 мм рт.ст.
2.При закрытых кранах К0 и К выждать 2…3 мин, пока установится постоян- ное давление в баллоне (отсчет Н), это состояние воздуха 1 (см. график рис. 2).
3.Открывая кран К0, соединить баллон с атмосферой и одновременно вклю- чить секундомер. Оставить кран К0 открытым в течение t = 5 с и затем быстро за- крыть его.
4.Выждать 2–3 мин, пока в баллоне установится постоянное давление, и сде-
лать отсчет по манометру h′.
5. Провести аналогичные измерения с различным временем сообщения балло- на с атмосферой (t = 10, 15, 20 и 25 с), но при одинаковом начальном значении H. Для его получения воздух накачивать медленно, приближаясь к нужной величине со стороны меньших значений давления. Результаты всех измерений H и h′ запи- сывать в табл.
|
|
|
|
|
|
|
Таблица |
H±θH = |
t, c |
5 |
10 |
15 |
20 |
25 |
0 |
… |
h′, мм |
|
|
|
|
|
h = |
мм.вод. |
lnh′ |
|
|
|
|
|
lnh = |
ст |
|
|
|
|
|
|
|
|
|
|
|
90 |
|
|
|
