
- •Звездочкой обозначены разрыхляющие молекулярные орбитали. Для молекулы f2:
- •Таким образом, более высокая энергия связи объясняется более высоким её порядком.
- •Звездочкой обозначены разрыхляющие молекулярные орбитали. Для молекулы о2:
- •Таким образом, более высокая энергия связи объясняется более высоким её порядком.
- •Звездочкой обозначены разрыхляющие молекулярные орбитали. Для молекулы о2:
- •Восстановительные свойства могут проявлять катионы ванадия и хрома, так как они находятся в промежуточной степени окисления
- •Чем отличается взаимодействие германия и свинца с концентрированной азотной кислотой? Почему? Составьте электронные и молекулярные уравнения реакций:
- •Составьте электронные и молекулярные уравнения реакций:
- •Составьте электронные и молекулярные уравнения реакций:
- •Кислород в перекиси водорода имеет промежуточную степень окисления –1.
- •Вследствие несимметричности распределения связей о – н, Ме – о молекулы пероксидов сильно полярны. Пероксид – радикал может, не изменяясь переходить из соединения в соединение:
- •Закончите уравнения реакций:
- •Приведенные реакции относятся к реакциям внутримолекулярного окисления-восстановления.
- •Сера способна как окислятся, так и восстанавливаться, ввиду того, что нулевая степень окисления является промежуточной.
Составьте электронные и молекулярные уравнения реакций:





№418
Составьте электронные и молекулярные уравнения реакций:


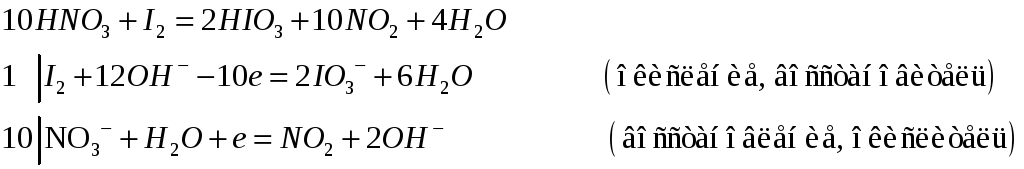

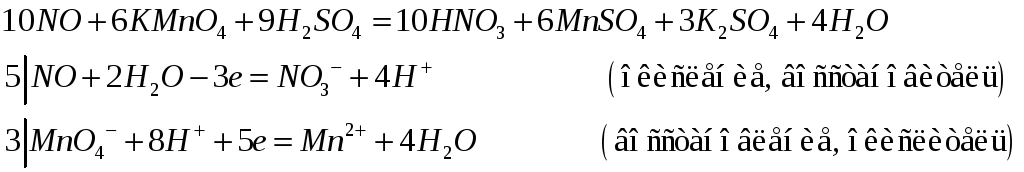
422
3: фосфиды, +1: фосфиновая кислота Н3РО2, +3: оксид фосфора Р2О3 ,
+5: сульфид фосфора Р2S5.
Mg3P2 + 6H2O = 3Mg(OH)2 + PH3
423
HO H
\ /
P
// \
O H
Фосфорноватистая кислота Н3РО2 – сильная одноосновная кислота (однако, предполагается, что в растворах существует равновесие таутомерных форм (HO)H2PO ↔ (HO)2HP). Степень окисления фосфора в кислоте и её солях (гипофосфитах) +1. Так это промежуточная степень окисления для данного элемента, то эти соединения могут быть как восстановителями (чаще), так и окислителями.
I2 + 2e = 2I- / 2
P3- - 4e = P+ / 1
2I2 + 2H2O + PH3 → 4HI + H3PO2
423
HO H
\ /
P
// \
O H
Фосфорноватистая кислота Н3РО2 – сильная одноосновная кислота (однако, предполагается, что в растворах существует равновесие таутомерных форм (HO)H2PO ↔ (HO)2HP). Степень окисления фосфора в кислоте и её солях (гипофосфитах) +1. Так это промежуточная степень окисления для данного элемента, то эти соединения могут быть как восстановителями (чаще), так и окислителями.
I2 + 2e = 2I- / 2
P3- - 4e = P+ / 1
2I2 + 2H2O + PH3 → 4HI + H3PO2
424
4P + 3NaOH + 3H2O → 3NaH2PO2 + PH3
P + 3e = P3- / 1
P - e = P+ / 3
Это процесс диспропорционирования.
425
Фосфористая кислота Н3РО3 – слабая двухосновная кислота.
HO H
\ /
P
/ \\
HO O
Получают гидролизом PCl3
PCl3 + 3H2O → 3HCl + H3PO3
Кислота может диспропорционировать, так как атом фосфора находится в промежуточной степени окисления +3. Например, при нагревании до 2500 безводной фосфористой кислоты протекает реакция:
4H3PO3 → PH3 + 3H3PO4
P3+ - 2e = P5+ / 3
P3+ + 6e = P3- / 1
№426
Чему равна
степень окисления фосфора в фосфорноватистой
кислоте и ее солях гипофосфитах?
Дигидрогипофосфат натрия
![]() получают обработкой красного фосфора
смесью
получают обработкой красного фосфора
смесью
![]() с концентрированным раствором
с концентрированным раствором
![]() .
Составьте электронное и молекулярное
уравнения этой реакции:
.
Составьте электронное и молекулярное
уравнения этой реакции:
Степень
окисления фосфора в фосфорноватистой
кислоте
![]() и
ее солях- гипофосфитах равна +1.
и
ее солях- гипофосфитах равна +1.

427
При последовательной гидратации:
P2O5 + H2O = 2HPO3 метафосфорная кислота
4HPO3 + H2O = H6P4O13 тетрафосфорная кислота
3H6P4O13 + H2O = 4H5P3O10 трифосфорная кислота
2H5P3O10 + H2O = 3H4P2O7 пирофосфорная кислота
H4P2O7 + H2O = 2H3PO4 ортофосфорная кислота.
P восстановитель (окисляется) P0 - 5e = P5+ / 3
HNO3 окислитель (восстанавливается) N5+ + 3e = N2+ / 5
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO
Сa3(PO4)2 + 6HNO3 = 3Сa(NO3)2 + 2H3PO4
428
Белый фосфор - молекула состоит из четырёх атомов (тетраэдр).
Красный фосфор – полимерное вещество сложного строения.
Черный фосфор – имеет слоистую структуру.
2Ca3(PO4)2 + 10C + 6SiO2 = 6CaSiO3 + 10CO + P4
P+5 → +5 P0 *2
C0 → -2 C *5
№ 429
Составьте электронные и молекулярные уравнения реакций:
а)
![]()

б)
![]()
в)
![]()
№ 430
Напишите электронные и молекулярное уравнения реакций: а) растворения фосфора в хлорноватой кислоте, учитывая, что при этом фосфор приобретает максимальную, а хлор — минимальную степень окисления; б) взаимодействия фосфорноватистой и азотной кислот.
а)
![]()

б)
![]()

431
5P2H4 + 14KMnO4 + 21H2SO4 → 14MnSO4 + 10H3PO4 + 7K2SO4 + 16H2O
P2- - 7e = P5+ / 5 / 10
Mn7+ + 5e = Mn2+ / 7 / 14
H3PO2 + HgCl2 + H2O → H3PO3 + 2HCl + Hg
P+ - 2e = P3+ / 1
Hg2+ + 2e = Hg / 1
NaH2PO2 + NiCl2 + H2O → NaH2PO3 + 2HCl + Ni
P+ - 2e = P3+ / 1
Ni2+ + 2e = Ni / 1
432
2P + 3Ca = Ca3P2
Ca3P2 + 6H2O = 3Ca(OH)2 + PH3
2PH3 +4O2 = P2O5 +3H2O
P2O5 + 3Ca(OH)2 = Ca3(PO4)2 + 3H2O
2Ca3(PO4)2 + 10C + 6SiO2 = 6CaSiO3 + 10CO + P4
2P + 3Cl2 = 2PCl3
PCl3 + 3H2O = H3PO3 + 3HCl
H3PO3 + HgCl2 + H2O = H3PO4 + Hg + 2HCl
№433
Почему дифосфин, фосфорноватистая, фосфористая кислоты способны к диспропорционированию? Составьте уравнения реакций, протекающих при нагревании этих соединений.
Решение:
Фосфор в дифосфине, фосфорноватистой, фосфористой кислотах проявляет промежуточные степени окисления:
![]() ,
,
![]() ,
,
![]() ,
поэтому они могут диспропорционировать.
,
поэтому они могут диспропорционировать.
Диспропорционирование дифосфина:
![]()
1|
![]() (восстановление, окислитель)
(восстановление, окислитель)
1|
![]() (окисление, восстановитель)
(окисление, восстановитель)
Диспропорционирование фосфорноватистой кислоты:
![]()
1|
![]() (восстановление, окислитель)
(восстановление, окислитель)
2|
![]() (окисление, восстановитель)
(окисление, восстановитель)
Диспропорционирование фосфористой кислоты:
![]()
1|
![]() (восстановление, окислитель)
(восстановление, окислитель)
3|
![]() (окисление, восстановитель)
(окисление, восстановитель)
434
H3PO2 + CuSO4 + H2O → H3PO3 + H2SO4 + Cu
P+ - 2e = P3+ / 1
Cu2+ + 2e = Cu / 1
PH3 + 3Cl2 → PCl3 + 3HCl
P3- - 6e = P3+ / 1
Cl2 + 2e = 2Cl- / 3
PH4I + 2HClO3 → HIO3 + H3PO3 + 2HCl
P3- - 6e = P3+ / 1
I- - 6e = I5+ / 1
Cl5+ + 6e = Cl- / 2
435
Фосфин является хорошим восстановителем, так как атом фосфора в нем находится в низшей степени окисления –3. В дифосфине степень окисления атома фосфора промежуточна –2, поэтому он может быть и восстановителем, и окислителем (реже).
2PH3 + 4O2 → P2O5 + 3H2O
P3- - 8e = P5+ / 2
O2 + 4e = 2O2- / 4
P2H4 + 2TiCl3 + 2HCl → 2TiCl4 + 2PH3
P2- + e = P3- / 1 / 2
Ti3+ - e = Ti4+ / 1 / 2
436
3As + 5HNO3 + 2H2O = 3H3AsO4 + 5NO
As0 → -5e As+5 *3
N+5 → +3e N+2 *5
3Sb + 5HNO3 = 3HSbO3 + 5NO +H2O
Sb0 → -5e Sb+5 *3
N+5 → +3e N+2 *5
Bi + 4HNO3 = Bi(NO3)3 + NO+2H2O
Bi0 →-3e Bi+3 *3 / 1
N+5 → +3e N+2 *3 / 1
439
3Sb + 5HNO3 = 3HSbO3 + 5NO +H2O
Sb0 → -5e Sb+5 *3
N+5 → +3e N+2 *5
2As + 5Cl2 + 8H2O → 2H3AsO4 + 10HCl
As0 →-5e As+5 *2
Cl20 →+2e 2Cl- *5
440
Хлорид сурьмы (III) гидролизуется в большей степени, так как её гидроксид Sb(OH)3 является более слабым основанием, чем гидроксид висмута Bi(OH)3. Это объясняется общей тенденцией усиления металлических свойств в группе с увеличением порядкового номера.
BiCl3 + H2O = Bi(OH)Cl2 + HCl
Bi3+ + H2O = Bi(OH)2+ + H+
SbCl3 + 2H2O = Sb(OH)2Cl + 2HCl
Sb3+ + 2H2O = Sb(OH)2+ + 2H+
Чтобы избавиться от мути (катионов основных солей) нужно сдвинуть равновесие влево. Для этого достаточно увеличить кислотность этих растворов соляной кислотой.
441
Элементы подгруппы мышьяка образуют с серой следующие соединения:
As2S3 As2S5 Sb2S3 Sb2S5 Bi2S3
2As2S3 + 14HNO3 + 5H2O → 4H3AsO4 + 6H2SO4 + 7N2O
As2S3 + 20H2O – 28e = 2AsO43- + 3SO42- + 40H+ / 8 / 2
2NO3- + 10H+ + 8e = N2O + 5H2O / 28 / 7
2As2S3 + 40H2O + 14NO3- + 70H+ = 7N2O + 35H2O + 4AsO43- + 6SO42- + 80H+
2As2S3 + 5H2O + 14NO3- = 7N2O + 4AsO43- + 6SO42- + 10H+
№442
Метависмутат
калия
![]() может быть получен при пропускании
хлора через суспензию гидроксида висмута
(III) в концентрированном
растворе КОН. Составьте электронные и
молекулярное уравнения этой реакции.
Какие свойства проявляют висмутаты в
окислительно-восстановительных реакциях,
почему?
может быть получен при пропускании
хлора через суспензию гидроксида висмута
(III) в концентрированном
растворе КОН. Составьте электронные и
молекулярное уравнения этой реакции.
Какие свойства проявляют висмутаты в
окислительно-восстановительных реакциях,
почему?
В висмутатах висмут имеет максимальную степень окисления, поэтому в окислительно-восстановительных реакциях проявляют окислительные свойства.

№443
Какой из газообразных гидридов элементов Y-группы – наилучший восстановитель? Почему? Составьте электронные и молекулярные уравнения реакций:
А)
![]()
Б)
![]()
По мере
увеличения размеров электронных облаков
в ряду:
![]() полярность и прочность связи Э-Н
уменьшается, поэтому восстановительные
свойства усиливаются.
полярность и прочность связи Э-Н
уменьшается, поэтому восстановительные
свойства усиливаются.


444
As2S3 + 3(NH4)2S → 2(NH4)3AsS3 тиоарсенит аммония
As2S3 + 3S2- → 2AsS33-
Sb2S3 + 3(NH4)2S → 2(NH4)3SbS3
Sb2S3 + 3S2- → 2SbS33-
(NH4)3AsS4 + 3HCl → 3NH4Cl + H3AsS4
AsS43- + 3H+ → H3AsS4
№ 445
Приведите электронно-ионные, ионно-молекулярные и молекулярные уравнения реакций мышьяка: а) с хлорноватистой кислотой; б) с расплавом гидроксида натрия. В реакции (а) мышьяк приобретает максимальную, а хлор минимальную степень окисления. В реакции (б) мышьяк диспропорционирует в соединения, где его степень окисления —3 и +3.

446
Для висмута наиболее характерна степень окисления +3. Это можно объяснить тем, что возможная степень окисления +5 отвечает неметаллическим кислотным свойствам которые у висмута выражены значительно слабее, чем металлические.
2KBiO3 + 2MnSO4 + 2H2SO4 → 2MnO2 + Bi2(SO4)3 + K2SO4 + 2H2O
BiO3- + 6H+ + 2e = Bi3+ + 3H2O / 1
Mn2+ + 2H2O – 2e = MnO2 + 4H+ / 1
BiO3- + 6H+ + Mn2+ + 2H2O = MnO2 + 4H+ + Bi3+ + 3H2O
BiO3- + 2H+ + Mn2+ = MnO2 + Bi3+ + H2O
NaBiO3 + 6HCl → BiCl3 + NaCl + Cl2 + 3H2O
BiO3- + 6H+ + 2e = Bi3+ + 3H2O / 1
2Cl- – 2e = Cl2 / 1
BiO3- + 6H+ + 2Cl- = Cl2 + Bi3+ + 3H2O
№448
Сильные окислители окисляют сульфид мышьяка (III). При этом мышьяк и сера приобретают высшую степень окисления. Составьте электронные и молекулярные уравнения реакций:
![]()
![]()
 (окисление, восстановители)
(окисление, восстановители)
![]() (восстановление, окислитель)
(восстановление, окислитель)
![]()
 (окисление, восстановители)
(окисление, восстановители)
![]() (восстановление, окислитель)
(восстановление, окислитель)
![]()
449
В ряду As(OH)3 Sb(OH)3 Bi(OH)3 кислотные свойства ослабевают, а основные усиливаются.
Sb(OH)3 + 3HCl → SbCl3 + 3H2O
SbCl3 + 2H2O → Sb(OH)2Cl + 2HCl
Sb(OH)2Cl → SbOCl + H2O
Итоговое: Sb(OH)3 + H+ → SbO+ +2H2O
Sb(OH)3 + 3KOH → K3[Sb(OH)6]
Sb(OH)3 + 3OH- → [Sb(OH)6]3-
AsCl3 + 3H2O → H3AsO3 + 3HCl
As3+ + 3H2O → AsO33- + 6H+
450
Bi + 4HNO3 = Bi(NO3)3 + NO+2H2O
Bi(NO3)3 + KOH = Bi(OH)3 + 3KNO3
Bi(OH)3 + 3HCl = BiCl3 + 3H2O
BiCl3 + Cl2 + 6NaOH = NaBiO3 + 5NaCl + 3H2O
2Mn2+ + 5BiO3- +14H+ = 5Bi3+ + 2MnO4- + 7H2O
Bi3+ + 6Cl- = 2BiCl3
BiCl3 + H2O = BiOCl + 2HCl
BiOCl + 2HCl = BiCl3 + H2O
452
