
- •Звездочкой обозначены разрыхляющие молекулярные орбитали. Для молекулы f2:
- •Таким образом, более высокая энергия связи объясняется более высоким её порядком.
- •Звездочкой обозначены разрыхляющие молекулярные орбитали. Для молекулы о2:
- •Таким образом, более высокая энергия связи объясняется более высоким её порядком.
- •Звездочкой обозначены разрыхляющие молекулярные орбитали. Для молекулы о2:
- •Восстановительные свойства могут проявлять катионы ванадия и хрома, так как они находятся в промежуточной степени окисления
- •Чем отличается взаимодействие германия и свинца с концентрированной азотной кислотой? Почему? Составьте электронные и молекулярные уравнения реакций:
- •Составьте электронные и молекулярные уравнения реакций:
- •Составьте электронные и молекулярные уравнения реакций:
- •Кислород в перекиси водорода имеет промежуточную степень окисления –1.
- •Вследствие несимметричности распределения связей о – н, Ме – о молекулы пероксидов сильно полярны. Пероксид – радикал может, не изменяясь переходить из соединения в соединение:
- •Закончите уравнения реакций:
- •Приведенные реакции относятся к реакциям внутримолекулярного окисления-восстановления.
- •Сера способна как окислятся, так и восстанавливаться, ввиду того, что нулевая степень окисления является промежуточной.
Восстановительные свойства могут проявлять катионы ванадия и хрома, так как они находятся в промежуточной степени окисления
восстановитель (окисляется) V2+ - 3e = V5+
восстановитель (окисляется) Cr3+ - 3e = Cr6+
восстановление N5+ + 3e = N2+ / 10
окисление S2- - 8e = S6+ / 3
окисление Cu+ - e = Cu2+ / 6
коэффициенты подбираются так, чтобы число отданных электронов было равно числу принятых при условии, что атомов меди должно быть в два раза больше, чем атомов серы ( 3 · 8 + 6 · 1 = 10 · 3 ).
3Cu2S + 22HNO3 = 6Cu(NO3)2 + 3H2SO4 + 10NO + 8H2O
146
Восстановительные свойства могут проявлять катионы ванадия и марганца, так как они находятся в промежуточной степени окисления
восстановитель (окисляется) V3+ - 2e = V5+
восстановитель (окисляется) Mn4+ - 3e = Mn7+
NaNO2 восстановитель (окисляется) N3+ - 2e = N5+ / 5
KMnO4 окислитель (восстанавливается) Mn7+ + 5e = Mn2+ / 2
2KMnO4 + 5NaNO2 + 3H2SO4 = 2MnSO4 + 5NaNO3 + K2SO4 + 3H2O
147
Окислительные свойства могут проявлять сульфит-, хлорит- и нитрат-анионы, так как их центальный атом находятся в промежуточной степени окисления
SO32- Окислитель (восстанавливается) S4+ + 6e = S2-
ClO2- Окислитель (восстанавливается) Cl3+ + 4e = Cl-
NO3- Окислитель (восстанавливается) N5+ + 3e = N2+
восстановление Pb4+ + 2e = Pb2+ / 5
окисление Mn2+ - 5e = Mn7+ / 2
2Mn(NO3)2 + 5PbO2 + 6HNO3 = 5Pb(NO3)2 + 2HMnO4 + 2H2O
148
Восстановительные свойства могут проявлять фосфоний-, нитрит-, гипофосфит-ионы, так как их центальный атом находятся в промежуточной степени окисления
PH4+ восстановитель (окисляется) P3- - 3e = P
NO2- восстановитель (окисляется) N3+ - 2e = N5+
H2PO2- восстановитель (окисляется) P+ - 2e = P3+
восстановление Mn7+ + 5e = Mn2+ / 2
окисление 2O- - 2e = O2 / 5
2KMnO4 + 5H2O2 + 3H2SO4 = 2MnSO4 + K2SO4 + 5O2 + 8H2O
150
Восстановительные свойства может проявлять оксид азота (II), фосфин и сероводород, так как их центальный атом находятся в промежуточной степени окисления
PH3 восстановитель (окисляется) P3- - 8e = P5+
NO восстановитель (окисляется) N2+ - 3e = N5+
H2S восстановитель (окисляется) S2- - 8e = S6+
восстановление Mn7+ + 3e = Mn4+ / 8
окисление N3- - 8e = N5+ / 3
8KMnO4 + 3NH3 = 8MnO2 + 3KNO3 + 5KOH + 2H2O
151
Энтальпией данного соединения называют тепловой эффект реакции образования 1 моль этого соединения из простых веществ, взятых в их устойчивом состоянии при нормальных условиях.
Стандартную теплоту находим в справочнике:
½ N2 + 3/2 H2 = NH3 H = - 46.19 кДж
Составляем пропорцию:
46.19 кДж соответствует 11.2 л N2
18.45 кДж ------------------- V
V = 18.45 · 11.2 / 46.19 = 4.47 л N2
152
С2H6 (Г) + 3/2 O2 (Г) = 2CO2 (Г) + 3H2O (Ж)
H = 2 · H0(CO2 (Г)) + 3 · H0(H2O (Ж)) - H0(С2H6 (Г)) =
= 2 · (-393.51) + 3 · (- 285.84) – (-84.67) = -1559.87 кДж
153
С6H6 (Ж) + 7,5 O2 (Г) = 6CO2 (Г) + 3H2O (Г) Н = -3135.48 кДж
Зная теплоты образования углекислого газа и паров воды находим:
H = 6 · H0(CO2 (Г)) + 3 · H0(H2O (Г)) - H0(С6H6 (Ж)) = -3135.48
6 · (-393.51) + 3 · (- 241.83) – H0(С6H6 (Ж)) = -3135.48
H0(С6H6 (Ж)) = +48.93 кДж / моль.
154
Тепловой эффект первых двух реакций есть теплота образования соответствующих соединений.
Зная теплоты образования оксида кальция и воды находим:
H = H0(Cа(OH)2 (К)) - H0(H2O (Ж)) - H0(СаО (К)) = -65.06
H0(Cа(OH)2 (К)) - (- 285.84) –(-635.6) = -65.06
H0(Cа(OH)2 (К)) = -986.5 кДж / моль.
155
Очевидно, что теплота образования пара вещества является суммой теплоты образования жидкости и теплоты парообразования.
H0(С6H6 (Ж)) + 33.9 = H0(С6H6 (Г))
H0(С6H6 (Ж)) = 82.93 – 33.9 = 49.0 кДж / моль
С6H6 (Ж) + 7,5 O2 (Г) = 6CO2 (Г) + 3H2O (Г)
H = 6 · H0(CO2 (Г)) + 3 · H0(H2O (Г)) - H0(С6H6 (Ж)) =
= 6 · (-393.51) + 3 · (- 241.83) – 49.0 = -3135.6 кДж
156
2Н2S (Г) + CН4 (Г) = СS2 (Г) + 4H2 (Г)
Зная энтальпии исходных и конечных продуктов вычислим тепловой эффект данной реакции и запишем термохимическое уравнение:
H = H0(СS2 (Г)) – 2 · H0(H2S (Г)) - H0(CН4 (Г)) =
= 115.28 – 2 · (-20.15) – (-74.85) = 230.43
2Н2S (Г) + CН4 (Г) = СS2 (Г) + 4H2 (Г) H = + 230.43 кДж
реакция эндотермическая.
157
NH3 (Г) + HCl (Г) = NH4Cl (К)
H = H0(NH4Cl (К)) – H0(NH3 (Г)) - H0(HCl (Г)) =
= -315.39 – (-46.19) – (-92.31) = -176.89 кДж
10 л NH3 составляет 10 / 22.4 = 0.45 моль.
Для такого количества вещества тепловой эффект реакции равен
H = -176.89 · 0.45 = - 79.00 кДж.
№158
Восстановление
![]() протекает по уравнению:
протекает по уравнению:
![]() ;
;
![]() кДж.
Возможна ли эта реакция при стандартных
условиях, если изменение энтропии
кДж.
Возможна ли эта реакция при стандартных
условиях, если изменение энтропии
![]() кДж/моль?
При какой температуре начинается
восстановление
кДж/моль?
При какой температуре начинается
восстановление
![]() ?
?
Решение:
Вычислим изменение энергии Гиббса.
![]() кДж
кДж
поскольку
![]() ,то
реакция в стандартных условиях идти не
будет.
,то
реакция в стандартных условиях идти не
будет.
При какой температуре начнется восстановление?
Реакция становится возможной при
![]()
Для данной реакции:
![]()
159
H = H0(CO2 (Г)) - H0(СО (Г)) - H0(Н2О (Ж)) =
= -393.51 - (-110.52) – (-285.84) = 2.85 кДж
S = S0(H2 (Г)) + S0(СO2 (Г)) - S0(СO (Г)) - S0(Н2О (Ж)) =
= 130.59 + 213.65 - 197.91 - 69.94 = 76.39 Дж / K
G = H – T · S = 2.85 – 298 · (0.07639) = -19.91 кДж.
Очевидно, что при стандартных условиях реакция возможна.
160
4HCl + O2 = 2H2O + 2Cl2 H = - 114.42 кДж
S = 2 · S0(H2O (Г)) + 2 · S0(Cl2 (Г)) – 4 · S0(HCl (Г)) - S0(O2 (Г)) =
= 2 · 188.72 + 2 · 222.95 – 4 · 186.68 – 205.03 = - 128.41 Дж
Условие равновесия G = 0. Решаем уравнение:
G = H – T · S = 0
- 114.42 – T · (-0.12841) = 0
T = (-114.42) / (-0.12841) = 891 K
Таким образом при температурах ниже 891 К реакция преимущественно протекает в прямом направлении, а значит более сильным окислителем является кислород. При более высоких температурах пойдет обратная реакция, а значит в этих условиях более сильным окислителем станет хлор.
161
Данная реакция невозможна при стандартных условиях очевидно потому, что энтропия системы уменьшается (из двух моль газа получается только один его моль), а это ведет к положительному изменению энергии Гиббса.
S = S0(СO (Г)) + S0(Н2О (Ж)) – S0(H2 (Г)) - S0(СO2 (Г)) =
= 197.91 + 69.94 – 130.59 – 213.65 = - 76.39 Дж / K
G = H – T · S = -2.85 – 298 · (-0.07639) = 19.91 кДж.
162
H = H0(CН4 (Г)) + 2 · H0(Н2О (Ж)) - H0(СО2 (Г)) =
= -74.85 + 2 · (-285.84) – (-393.51) = -253.02 кДж
S = S0(СH4 (Г)) + 2 · S0(Н2О (Ж)) – 4 · S0(H2 (Г)) - S0(СO2 (Г)) =
= 186.19 + 2 · 69.94 – 4 · 130.59 – 213.65 = - 409.94 Дж / K
G = H – T · S = -253.02 – 298 · (-0.40994) = -130.86 кДж.
Очевидно, что при стандартных условиях реакция возможна.
№163
Определите
![]() реакции, протекающей по уравнению
реакции, протекающей по уравнению
![]() .
.
Возможна ли эта реакция при стандартных условиях?
Решение:
1) Вычислим энтальпию реакции

2) Вычислим энтропию реакции

3)Вычислим энергию Гиббса реакции
![]()
165
а) энтропия увеличивается, так как газ более беспорядочная система, чем жидкость.
S = S0(H2O (Г)) - S0(H2O (Ж)) =
= 188.72 - 69.94 = 118.78 Дж / (моль·К)
б) энтропия уменьшается, так как кристаллическая решетка алмаза – более упорядоченная система (выше порядок симметрии).
S = S0(С (алмаз)) - S0(С (графит)) =
= 2.44 - 5.69 = -3.25 Дж / (моль·К)
При фазовых превращениях изменение энтропии более значительно (в данном примере на два порядка), чем при аллотропических изменениях.
164
Тепловой эффект этой реакции равен теплоте образования сероводорода.
S = S0(H2S (Г)) – S0(H2 (Г)) - S0(S (ромб)) =
= 205.64 – 130.59 – 31.90 = 43.15 Дж / K
G = H – T · S = -20.15 – 298 · (0.04315) = -33.01 кДж.
Очевидно, что при стандартных условиях реакция возможна.
165
а) энтропия увеличивается, так как газ более беспорядочная система, чем жидкость.
S = S0(H2O (Г)) - S0(H2O (Ж)) =
= 188.72 - 69.94 = 118.78 Дж / (моль·К)
б) энтропия уменьшается, так как кристаллическая решетка алмаза – более упорядоченная система (выше порядок симметрии).
S = S0(С (алмаз)) - S0(С (графит)) =
= 2.44 - 5.69 = -3.25 Дж / (моль·К)
При фазовых превращениях изменение энтропии более значительно (в данном примере на два порядка), чем при аллотропических изменениях.
166
По определению константы равновесия имеем:
K = [NO]2 / ([N2] · [O2]) = 4.1 · 10-4
0.052 / (0.10 · [O2]) = 4.1 · 10-4
[O2] = 0.052 / (0.10 · 4.1 · 10-4) = 60.98 моль / л
167
Если было 0.10 моль NO, то прореагировало 0.10 - 0.07 = 0.03 моль. Из такого количества должно было получится также 0.03 моль H2O и 0.015 моль азота, а водорода должно было затратится соответственно 0.03 моль (из уравнения).
[Н2] = 0.05 – 0.03 = 0.02 моль / л
[N2] = 0.015 моль / л
[H2O] = 0.10 + 0.03 = 0.13 моль / л
K = [H2O]2 · [N2] / ([NO]2 · [H2]2) = 0.132 · 0.015 / (0.072 · 0.022) = 129.34
168
Если было 0.5 моль NO, то прореагировало 0.5 · 0.2 = 0.1 моль. Из такого количества должно было получится также 0.1 моль NOCl, а хлора должно было затратится соответственно 0.05 моль (из уравнения).
[NO] = 0.5 – 0.1 = 0.4 моль / л
[Cl2] = 0.2 – 0.05 = 0.15 моль / л
[NOCl] = 0.1 моль / л
K = [NOCl]2 / ([NO]2 · [Cl2]) = 0.12 / (0.42 · 0.15) = 0.42
168
Если было 0.5 моль NO, то прореагировало 0.5 · 0.2 = 0.1 моль. Из такого количества должно было получится также 0.1 моль NOCl, а хлора должно было затратится соответственно 0.05 моль (из уравнения).
[NO] = 0.5 – 0.1 = 0.4 моль / л
[Cl2] = 0.2 – 0.05 = 0.15 моль / л
[NOCl] = 0.1 моль / л
K = [NOCl]2 / ([NO]2 · [Cl2]) = 0.12 / (0.42 · 0.15) = 0.42
169
K = [NH3]2 / ([N2] · [H2]3) = 0.082 / ([N2] · 0.23) = 0.1
[N2] = 0.082 / (0.1 · 0.23) = 8 моль / л
По уравнению реакции на получение 0.08 моль NH3 требуется 0.04 моль N2. Значит исходная концентрация равна
C(N2) = 8.00 + 0.04 = 8.04 моль / л
171
K = [NO2]2 / ([NO]2 · [O2]) = 0.012 / (0.082 · 0.03) = 0.52
По уравнению реакции на получение 0.01 моль NO2 требуется по 0.01 моль NO и 0.005 моль О2. Значит исходные концентрации равны
C(NО) = 0.08 + 0.01 = 0.09 моль / л
C(O2) = 0.03 + 0.005 = 0.035 моль / л
172
K = [СOCl2] / ([CO] · [Cl2]) = 0.001 / (0.001 · 0.001) = 1000 л / моль
По уравнению реакции на получение 0.001 моль СOCl2 требуется по 0.001 моль СO и Cl2. Значит исходные концентрации равны
C(СО) = 0.001 + 0.001 = 0.002 моль / л
C(Cl2) = 0.001 + 0.001 = 0.002 моль / л
173
При уменьшении объема концентрации веществ возрастут во столько же раз.
V1 = k · [O2] · [SO2]2
V2 = k · [ 2 O2] · [ 2 SO2]2 = 8 k · [O2] · [SO2]2 = 8 · V1
Cкорость прямой реакции возрастет в 8 раз.
V1 = k · [SO3]2
V2 = k · [ 2 SO3]2 = 4 k · [SO3]2 = 4 · V1
Cкорость обратной реакции возрастет в 4 раза.
Очевидно, равновесие системы сместится вправо, так как изменение скоростей прямой и обратной реакции не компенсируют друг друга.
№174
При некоторой
температуре константа скорости реакции
![]() равна 0,16. исходные концентрации
реагирующих веществ были
равна 0,16. исходные концентрации
реагирующих веществ были
![]() моль/л,
моль/л,
![]() моль/л.
Вычислите начальную скорость реакции
и ее скорость при
моль/л.
Вычислите начальную скорость реакции
и ее скорость при
![]() моль/л.
моль/л.
Решение:
Начальная скорость реакции равна:
![]()
при
![]() моль/л
прореагировало 0,04 – 0,03=0,01 моль водорода.
Следовательно, по закону эквивалентов
прореагировало 0,01 моль йода, т. е.
Равновесная концентрация йода:
0,05-0,01=0,04.
моль/л
прореагировало 0,04 – 0,03=0,01 моль водорода.
Следовательно, по закону эквивалентов
прореагировало 0,01 моль йода, т. е.
Равновесная концентрация йода:
0,05-0,01=0,04.
Тогда, скорость реакции равна:
![]()
175
K = [CO]2 / [CO2]
Любая система изменяется против внешнего воздействия.
а) равновесие смещается вправо
б) равновесие не смещается
в) равновесие смещается вправо
г) равновесие смещается влево
д) катализатор не влияет на равновесие
е) равновесие смещается вправо
176
K = [PCl3] · [Cl2] / [PCl5]
Любая система изменяется против внешнего воздействия.
а) температура понижается, значит её надо повышать
б) давление повышается (из одного моль газа получается два моль), значит его надо понижать
в) очевидно, нужно увеличивать концентрацию PCl5, и отводить продукты реакции.
177
Исходя из правила Вант-Гоффа получаем:
V2 = V1 · 2(100 – 10) / 10 = V1 · 29 = 512 · V1
Значит скорость возрастет в 512 раз.
178
На образование 0.0022 моль NO2 требуется столько же NO, а кислорода должно было затратится соответственно 0.0011 моль (из уравнения).
[NO] = 0.02 – 0.0022 = 0.0178 моль / л
[О2] = 0.03 – 0.0011 = 0.0289 моль / л
[NO2] = 0.0022 моль / л
K = [NO2]2 / ([NO]2 · [О2]) = 0.00222 / (0.01782 · 0.0289) = 0.53
№179
Почему
изменение давления смещает равновесие
системы
![]() и не смещает равновесие системы
и не смещает равновесие системы
![]() ?
Ответьте на основании расчета скорости
прямой и обратной реакции в этих системах
до и после изменения давления.
?
Ответьте на основании расчета скорости
прямой и обратной реакции в этих системах
до и после изменения давления.
Решение:
1) Скорости
прямой и обратной реакции
![]() до изменения давления:
до изменения давления:

Предположим, что давление повысится в 2 раза, тогда скорости прямой и обратной реакции составят:

Изменение скоростей реакций:

Таким образом, скорость прямой и обратной реакции возрастет в 4 раза, равновесие системы не сместится.
2) Скорости прямой и обратной реакций до изменения давления

Предположим, что давление повысилось в 2 раза

Изменение скоростей реакций составит:

Таким образом, скорость прямой реакции увеличится в 4 раза по сравнению со скоростью обратной реакции, равновесие сместится в сторону прямой реакции.
180
Исходя из правила Вант-Гоффа получаем:
а) V2 = V1 · 2(120 – 80) / 10 = V1 · 24 = 16 · V1
Значит скорость возрастет в 16 раз, а время соответственно в 16 раз уменьшится 16 / 16 = 1 мин.
б) V2 = V1 · 2(60 – 80) / 10 = V1 · 2-2 = 1/4 · V1
Значит скорость уменьшится в 4 раза, а время соответственно в 4 раза возрастет 16 · 4 = 64 мин.
181
m1 (р-ра) = V · ρ = 100 · 1.84 = 184 г
m (H2SO4) = 184 · 0.96 = 176.64 г
m2 (р-ра) = 400 + 184 = 584 г
C = m (H2SO4) · 100 / m2 (р-ра) = 176.64 · 100 / 584 = 30.25 %
Э = m / mЭ = 176.64 / (98 / 2) = 3.605 моль · экв
CN = Э / V = 3.605 / 0.5 = 7.21 н.
182
m1 (р-ра) = V · ρ = 100 · 1.303 = 130.3 г
m (HNO3) = 130.3 · 0.48 = 62.544 г
m2 (р-ра) = m (HNO3) / C = 62.544 / 0.20 = 312.72 г
m (H2O) = 312.72 – 130.3 = 182.4 г
V (H2O) = m / ρ = 182.4 / 1 = 182.4 л
183
m1 (р-ра) = V · ρ = 500 · 1.2 = 600 г
m (HNO3) = 600 · 0.32 = 192 г
m2 (р-ра) = 600 + 1000 = 1600 г
С = m (HNO3) · 100 / m2 (р-ра) = 192 · 100 / 1600 = 12 %
№185
К 100мл 80%
раствора
![]()
![]() прибавили 400мл воды. Получили раствор
с
прибавили 400мл воды. Получили раствор
с
![]() .
Чему равны содержание в % и молярная
концентрация эквивалента (нормальность)
полученного раствора азотной кислоты?
.
Чему равны содержание в % и молярная
концентрация эквивалента (нормальность)
полученного раствора азотной кислоты?
Решение:
Вычислим процентную концентрацию раствора азотной кислоты
Согласно правилу смешивания количества смешиваемых растворов обратно пропорциональны разности концентраций смешиваемых растворов и концентрации смеси:

2) Чему равна нормальная концентрация кислоты?
Молярная
масса кислоты равна
![]()
Молярная масса кислоты и молярная масса эквивалента кислоты равны, поскольку кислота – одноосновная.
В 100г раствора содержится 21,39г кислоты
В 1000*1,128г раствора содержится х г кислоты
![]() г
г
Нормальная
концентрация равна:
![]() н
н
№185
К 100мл 80%
раствора
![]()
![]() прибавили 400мл воды. Получили раствор
с
прибавили 400мл воды. Получили раствор
с
![]() .
Чему равны содержание в % и молярная
концентрация эквивалента (нормальность)
полученного раствора азотной кислоты?
.
Чему равны содержание в % и молярная
концентрация эквивалента (нормальность)
полученного раствора азотной кислоты?
Решение:
Вычислим процентную концентрацию раствора азотной кислоты
Согласно правилу смешивания количества смешиваемых растворов обратно пропорциональны разности концентраций смешиваемых растворов и концентрации смеси:

2) Чему равна нормальная концентрация кислоты?
Молярная
масса кислоты равна
![]()
Молярная масса кислоты и молярная масса эквивалента кислоты равны, поскольку кислота – одноосновная.
В 100г раствора содержится 21,39г кислоты
В 1000*1,128г раствора содержится х г кислоты
![]() г
г
Нормальная
концентрация равна:
![]() н
н
186
m1 (р-ра) = V · ρ = 400 · 1.611 = 644.40 г
m (H2SO4) = 644.40 · 0.70 = 451.08 г
m2 (р-ра) = 644.40 + 500 = 1144.40 г
С = m (H2SO4) · 100 / m2 (р-ра) = 451.08 · 100 / 1144.40 = 39.42 %
187
Э = СN · V = 1.025 · 0.035 = 0.036 моль · экв HCl
Очевидно, израсходовалось столько же карбоната кальция (MЭ = 50 г / моль):
m = Э · МЭ = 0.036 · 50 = 1.8 г
188
Масса эквивалента NaOH равна 40 г / моль. Расчет ведём на 1000 мл:
m1 (р-ра) = V · ρ = 1000 · 1.203 = 1203 г
m (NaOH) = 1203 · 0.18 = 216.54 г
Э = m / mЭ = 216.54 / 40 = 5.41 моль · экв
CN = Э / V = 5.41 / 1= 5.41 н.
T = m (в-ва) / V (р-ра) = 216.54 / 1000 = 0.21654 г / мл
№189
К 1 литру 10%
раствора
![]()
![]() прибавили 0,5л 5% раствора
прибавили 0,5л 5% раствора
![]() .
Смесь разбавили водой до 3л. Вычислите
молярную концентрацию раствора.
.
Смесь разбавили водой до 3л. Вычислите
молярную концентрацию раствора.
Решение:
Сколько
граммов
![]() содержится в 1л 10% раствора?
содержится в 1л 10% раствора?
В 100г раствора содержится 10г КОН
В 1000*1,092г раствора содержится х г КОН
![]() г
КОН
г
КОН
Сколько граммов КОН содержится в 0,5л 5% раствора?
В 100г раствора содержится 5 г КОН
В 500*1,045г раствора содержится х г КОН
![]() г
КОН
г
КОН
Сколько граммов КОН содержится в разбавленном растворе?
![]() г
г
Чему равна молярная концентрация раствора?
![]()
№191
Раствор,
содержащий 5,0г толуола
![]() в 225г бензола, имеет
в 225г бензола, имеет
![]() г/мл.
Вычислите процентную и молярную
концентрации этого раствора.
г/мл.
Вычислите процентную и молярную
концентрации этого раствора.
Решение:
Чему равна процентная концентрация раствора?
Масса раствора равна 225+5=230г
В 230 г раствора содержится 5 г толуола
В 100 г раствора содержится х г толуола
![]()
Чему равна молярная концентрация раствора?
В 230 г раствора содержится 5 г толуола
В 1000*0,876г раствора содержится х г толуола
![]() г
г
Молярная
масса толуола
![]()
Молярная
концентрация раствора равна:
![]() моль/л
моль/л
192
T = m (в-ва) / V (р-ра) = 10.0 / 0.750 = 13.3 г / л
Состовляем пропорцию:
98 г / л ----------- 1 М
13.3 г / л -------- С
С = 13.3 / 98 = 0.136 М
Так как серная кислота двухосновная – фактор эквивалентности равен ½
CN = С / f = 0.136 / ½ = 0.272 н.
193
Молярная масса H2SO4 равна 98 г / моль. Расчет ведём на 1000 мл:
m (р-ра) = V · ρ = 1000 · 1.84 = 1840 г
m (H2SO4) = ν · M = 18 · 98 = 1764 г
C = m (в-ва) · 100 / m (р-ра) = 1764 · 100 / 1840 = 95.87 %
Молярная масса H2O равна 18 г / моль.
m (H2O) = 1840 – 1764 = 76 г
ν (H2O) = m / M = 76 / 18 = 4.22 моль
ν (общее) = ν (H2SO4) + ν (H2O) = 18 + 4.22 = 22.22 моль
æ = ν (H2SO4) / ν (общее) = 18 / 22.22 = 0.81
194
Состовляем пропорцию:
1 М -------------- 58.5 г / л
0.2 М ----------- Т
Т = 0.2 · 58.5 = 11.7 г / л
По титру находим объем:
V = m / T = 300 / 11.7 = 25.64 л
№195
Раствор
содержит20г
![]() в 500г
в 500г
![]() .
Вычислите чему равны молярная доля и
содержание в % йода в этом растворе.
.
Вычислите чему равны молярная доля и
содержание в % йода в этом растворе.
Решение:
1) Чему равно процентное содержание йода?
В 500+20 г
![]() содержится 20 г
содержится 20 г
![]()
В 100г
![]() содержится х г
содержится х г
![]()
![]()
2) Чему равна молярная доля?
Молекулярная
масса йода
![]()
Количество
молей йода в растворе
![]()
Молекулярная
масса
![]() :
:
![]()
Количество
молей
![]() в растворе:
в растворе:
![]()
Мольная доля
йода в растворе:
![]()
№196
Что такое
эбулиоскопическая и криоскопическая
константы растворителя? Вычислите
криоскопическую константу бензола,
зная, что при растворении 0,0125 моль
вещества в 125г бензола температура
кристаллизации понижается на 0,512![]() .
.
Решение:
Эбулиоскопическая константа растворителя, называемая также молекулярным повышением температуры кипения представляет собой величину повышения температуры кипения раствора, содержащего 1моль растворенного вещества в 1000г растворителя, по сравнению с температурой кипения чистого растворителя.
Криоскопическая константа – величина понижения точки замерзания растворителя, содержащего 1 моль вещества в 1000г растворителя по сравнению с температурой замерзания чистого растворителя.
![]()
Концентрация
растворенного вещества равна:
![]() моль/1000г
моль/1000г
![]()
197
Используем формулу
t = Eкип · m (в-ва) · 1000 / (М (в-ва) · m (р-ля))
t = 46.67 – 46.20 = 0.47 0C
M (в-ва) = Eкип · m (в-ва) · 1000 / (t · m (р-ля)) =
= 2.36 · 0.512 · 1000 / (0.47 · 10) = 257 г / моль
N = M (в-ва) / M (S) = 257 / 32 = 8
Молекула серы состоит из восьми атомов S8
198
Используем формулу
t = Eкип · m (в-ва) · 1000 / (М (в-ва) · m (р-ля))
M (в-ва) = Eкип · m (в-ва) · 1000 / (t · m (р-ля)) =
= 2.12 · 15 · 1000 / (0.665 · 400) = 119.55 г / моль
199
Используем формулу
t = Eкр · m (в-ва) · 1000 / (М (в-ва) · m (р-ля))
t = 0 – (-1.39) = 1.39 0C
m (р-ля) = m (р-ра) – m (в-ва) = 155.18 – 5.18 = 150 г воды
M (в-ва) = Eкр · m (в-ва) · 1000 / (t · m (р-ля)) =
= 1.86 · 5.18 · 1000 / (1.39 · 150) = 46.2 г / моль
200
Используем формулу
t = Eкр · ν (в-ва) · 1000 / m (р-ля) =
= 3.9 · 0.1 · 1000 / 125 = 3.12 0C
t = 16.65 – 3.12 = 13.53 0C
201
Используем формулу
t = Eкип · m (в-ва) · 1000 / (М (в-ва) · m (р-ля))
t = 36.13 – 35.60 = 0.53 0C
M (в-ва) = Eкип · m (в-ва) · 1000 / (t · m (р-ля)) =
= 2.12 · 0.6 · 1000 / (0.53 · 40) = 60 г / моль
202
Молекулярная масса мочевины 60 г / моль. Расчет ведем на 1000 мл раствора:
m (мочевины) = 1000 · 0.04 = 40 г
ν (мочевины) = m / M = 40 / 60 = 0.666 моль
m (воды) = 1000 – 40 = 960 г
ν (воды) = m / M = 960 / 18 = 53.333 моль
Используем формулу (следствие закона Рауля):
P = P0 · ν (р-ля) / (ν (р-ля) + ν (в-ва)) =
= 1.01325 · 105 · 53.333 / (53.333 + 0.666) = 100074 Па
204
Росм = CRT
Где С – молярная концентрация растворенного вещества.
Раствор большего количества растворенного вещества (большей молярной концентрации) обладает большим осмотическим давлением.
ν (С10Н8) = m / M = m / 128
ν (С14Н10) = m / M = m / 178
m / 128 > m / 178
Значит осмотическое давление раствора нафталина в 1,39 раз больше, чем данного раствора антрацена.
205
Используем формулу (следствие закона Рауля):
P = P0 · ν (р-ля) / (ν (р-ля) + ν (в-ва))
P · ν (р-ля) + P · ν (в-ва)) = P0 · ν (р-ля)
P · ν (в-ва) = P0 · ν (р-ля) – P ·ν (р-ля)
ν (в-ва) = ν (р-ля) · (P0 – P) / P =
= 40 · 0.013303 · 105 / 0.86392 · 105 = 0.616 моль
207
Учитывая, что единицей измерения объёма является кубический метр:
ν (C6H12O6) = m / M = 270 / 180 = 1.5 моль
C = ν / V = 1.5 / 0.003 = 500 моль / м3
Росм = CRT = 500 · 8.31 · 273 = 1134 кПа
208
Учитывая, что единицей измерения объёма является кубический метр:
ν (C6H12O6) = m / M = 45 / 180 = 0.25 моль
C = ν / V = 0.25 / 0.001 = 250 моль / м3
Росм = CRT
T = Росм /CR = 607800 / (250 · 8.31) = 292.5 K = 19.5 0C
210
Используем формулу
t = Eкип · m (в-ва) · 1000 / (M (в-ва) + m (р-ля)) =
= 2.53 · 0.92 · 1000 / 123 · 5 = 3.8 0C
t = 80.2 + 3.8 = 84.0 0C
211
Для уксусной кислоты 0,01 н раствор равен 0,01 М раствору:
Число молекул кислоты равно:
Nм = NA · C = 6.02 · 1023 · 0.01 = 6.02 · 1021
i = Nм / N = 6.26 · 1021 / 6.02 · 1021 = 1.04
= (i – 1) / (k – 1) = (1.04 – 1) / (2 – 1) = 0.04
где k – число ионов образующих молекулу.
№212
Константа
ионизации хлорноватистой кислоты равна
![]() .
Чему равна степень ионизации
.
Чему равна степень ионизации
![]() в 0,1н растворе? Вычислите концентрацию
ионов в этом растворе.
в 0,1н растворе? Вычислите концентрацию
ионов в этом растворе.
Решение:
![]() -
слабая кислота.
-
слабая кислота.
![]() Кислота
диссоциирует по уравнению
Кислота
диссоциирует по уравнению
![]()
Константа ионизации равна:
![]()
Степень ионизации можно рассчитать по закону Оствальда

Концентрация ионов водорода равна:
![]() моль/л
моль/л
213
K0 = [H+] · [NO2-] / [HNO2] = 5.1 · 10 –4
Пусть [HNO2] = X. Если 20 % кислоты распалось на ионы:
K = [0.20 H+] · [0.20 NO2-] / [0.80 HNO2] = X · 0.20 · 0.20 / 0.80 = 0.05 · X
X = K / 0.05 = 5.1 · 10 –4 / 0.05 = 0.0102 моль / л HNO2
[H+] = 0.20 · X = 0.20 · 0.0102 = 2.04 · 10 –3 моль / л
214
K = [NH4+] · [OH-] / [NH4OH]
Пусть [NH4+] = [OH-] = Х, тогда:
K · [NH4OH] = Х2
Х2 = 2.0 · 10-5 · 0.01 = 2.0 · 10-7
X = 4.5 · 10-4
= X / [NH4OH] = 4.5 · 10-4 / 0.01 = 0.045
214
K = [NH4+] · [OH-] / [NH4OH]
Пусть [NH4+] = [OH-] = Х, тогда:
K · [NH4OH] = Х2
Х2 = 2.0 · 10-5 · 0.01 = 2.0 · 10-7
X = 4.5 · 10-4
= X / [NH4OH] = 4.5 · 10-4 / 0.01 = 0.045
№215
Чему равны
изотонический коэффициент и степень
ионизации 0,2М раствора соляной кислоты,
если в литре этого раствора содержится
![]() ее молекул и ионов?
ее молекул и ионов?
Решение:
1 моль вещества
содержит
![]() частиц.
В 0,2М растворе содержится
частиц.
В 0,2М растворе содержится
![]() молекул. Степень ионизации равна
отношению
молекул. Степень ионизации равна
отношению
![]()
![]() -
число молекул, распавшихся на ионы;
-
число молекул, распавшихся на ионы;
![]() - общее число растворенных молекул,
равное
- общее число растворенных молекул,
равное
![]() .
.
На ионы
распалось
![]() молекул. Из каждой молекулы кислоты
образуется 2 иона, из
молекул. Из каждой молекулы кислоты
образуется 2 иона, из
![]() молекул 2
молекул 2![]() ионов. В растворе присутствует (
ионов. В растворе присутствует (![]() -
-![]() )-
недиссоциированных молекул и всего
(
)-
недиссоциированных молекул и всего
(![]() -
-![]() )+2
)+2![]() =(
=(![]() +
+![]() )=
)=![]() .
.
Отсюда
![]() =
=![]()
![]()
изотонический коэффициент равен
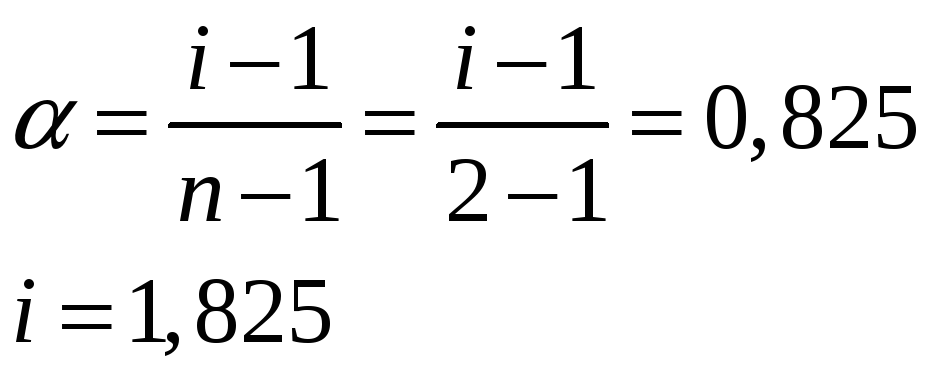
№215
Чему равны
изотонический коэффициент и степень
ионизации 0,2М раствора соляной кислоты,
если в литре этого раствора содержится
![]() ее молекул и ионов?
ее молекул и ионов?
Решение:
1 моль вещества
содержит
![]() частиц.
В 0,2М растворе содержится
частиц.
В 0,2М растворе содержится
![]() молекул. Степень ионизации равна
отношению
молекул. Степень ионизации равна
отношению
![]()
![]() -
число молекул, распавшихся на ионы;
-
число молекул, распавшихся на ионы;
![]() - общее число растворенных молекул,
равное
- общее число растворенных молекул,
равное
![]() .
.
На ионы
распалось
![]() молекул. Из каждой молекулы кислоты
образуется 2 иона, из
молекул. Из каждой молекулы кислоты
образуется 2 иона, из
![]() молекул 2
молекул 2![]() ионов. В растворе присутствует (
ионов. В растворе присутствует (![]() -
-![]() )-
недиссоциированных молекул и всего
(
)-
недиссоциированных молекул и всего
(![]() -
-![]() )+2
)+2![]() =(
=(![]() +
+![]() )=
)=![]() .
.
Отсюда
![]() =
=![]()
![]()
изотонический коэффициент равен

216
При 100 градусах вода кипит, а значит давление её паров равно атмосферному и составляет 101,3 кПа.
ν(H2O) = m / M = 450 / 18 = 25 моль
По закону Рауля:
P = P0 · ν(р-ля) / (ν(в-ва) + ν(р-ля)) =
= 101.3 · 25 / (0.05 + 25) = 101.1 кПа
Рвыч = 101,3 – 101,1 = 0,2
Роп = 101,3 – 100,8 = 0,5
i = Роп / Рвыч = 0.5 / 0.2 = 2.5
= (i – 1) / (k – 1) = (2.5 – 1) / (3 – 1) = 0.75
где k – число ионов, образующих молекулу.
217
Используем формулу
tвыч = Eкип · m(в-ва) · 1000 / m (р-ля) · M (в-ва) =
= 0.52 · 9.09 · 1000 / 100 · 101 = 0.468 0C
tоп = 100,8 – 100 = 0,8
i = tоп / tвыч = 0.8 / 0.468 = 1.71
= (i – 1) / (k – 1) = (1.71 – 1) / (2 – 1) = 0.71
где k – число ионов, образующих молекулу.
218
Используем формулу
tвыч = Eкр · m(в-ва) · 1000 / m (р-ля) · M (в-ва) =
= 1.86 · 0.53 · 1000 / 200 · 106 = 0.05 0C
tоп = 0,13 – 0 = 0,13
i = tоп / tвыч = 0.13 / 0.05 = 2.80
= (i – 1) / (k – 1) = (2.80 – 1) / (3 – 1) = 0.90
где k – число ионов, образующих молекулу.
№219
Каково будет
при 100![]() давление пара раствора, содержащего
2,5г гидроксида натрия в 90г воды, если
кажущаяся степень диссоциации в растворе
равна 80%.
давление пара раствора, содержащего
2,5г гидроксида натрия в 90г воды, если
кажущаяся степень диссоциации в растворе
равна 80%.
Решение:
вычислим изотонический коэффициент по соотношению:
![]()
Поскольку в
растворе гидроксид натрия распадается
на два иона
![]() ,
то
,
то
![]() ,
тогда
,
тогда
![]() .
Отсюда
.
Отсюда
![]() .
.
По первому закону Рауля
![]()
![]()
![]()
Давление пара
чистой воды при 100С равно:
![]() Па.
Тогда,
Па.
Тогда,

№221
Температура
кипения 3,2% раствора
![]() 100,208С.
Вычислите изотонический коэффициент
и кажущуюся степень ионизации соли в
этом растворе. Эбулиоскопическая
константа воды равна 0,52.
100,208С.
Вычислите изотонический коэффициент
и кажущуюся степень ионизации соли в
этом растворе. Эбулиоскопическая
константа воды равна 0,52.
Решение:
Вычислим изотонический коэффициент по закону Рауля

Вычислим кажущуюся степень ионизации в растворе:
Хлорид бария
диссоциирует по уравнению
![]() ,
т.е
,
т.е
![]() (при
диссоциации образуются 3 иона). Степень
ионизации связана с изотоническим
коэффициентом соотношением:
(при
диссоциации образуются 3 иона). Степень
ионизации связана с изотоническим
коэффициентом соотношением:
![]()
№219
Каково будет
при 100![]() давление пара раствора, содержащего
2,5г гидроксида натрия в 90г воды, если
кажущаяся степень диссоциации в растворе
равна 80%.
давление пара раствора, содержащего
2,5г гидроксида натрия в 90г воды, если
кажущаяся степень диссоциации в растворе
равна 80%.
Решение:
вычислим изотонический коэффициент по соотношению:
![]()
Поскольку в
растворе гидроксид натрия распадается
на два иона
![]() ,
то
,
то
![]() ,
тогда
,
тогда
![]() .
Отсюда
.
Отсюда
![]() .
.
По первому закону Рауля
![]()
![]()
![]()
Давление пара
чистой воды при 100С равно:
![]() Па.
Тогда,
Па.
Тогда,

220
CH3COOH = CH3COO- + H+
М раствор содержит
0,01 · 6,02 · 1023 = 6,02 · 1021 молекул кислоты. Из них распалось на ионы 6,02 · 1021 · 0,2 = 1,20 · 1021 частиц. Из уравнения видно, что ионов
получается в два раза больше, чем было молекул 2 · 1,20 · 1021 = 2,40 · 1021. Значит молекул остается 6,02 · 1021 – 1,20 · 1021 = 4,82 · 1021. Сумма числа молекул и ионов равна 4,82 · 1021 + 2,40 · 1021 = 7,22 · 1021.
i = 1 + · (k –1) = 1 + 0.2 · (2-1) = 1.2
№221
Температура
кипения 3,2% раствора
![]() 100,208С.
Вычислите изотонический коэффициент
и кажущуюся степень ионизации соли в
этом растворе. Эбулиоскопическая
константа воды равна 0,52.
100,208С.
Вычислите изотонический коэффициент
и кажущуюся степень ионизации соли в
этом растворе. Эбулиоскопическая
константа воды равна 0,52.
Решение:
Вычислим изотонический коэффициент по закону Рауля

Вычислим кажущуюся степень ионизации в растворе:
Хлорид бария
диссоциирует по уравнению
![]() ,
т.е
,
т.е
![]() (при
диссоциации образуются 3 иона). Степень
ионизации связана с изотоническим
коэффициентом соотношением:
(при
диссоциации образуются 3 иона). Степень
ионизации связана с изотоническим
коэффициентом соотношением:
![]()
ф№222
Вычислите
изотонический коэффициент и кажущуюся
степень ионизации
![]() в растворе, содержащем 0,398 моль этой
соли в 2 л воды. Температура кристаллизации
раствора –0,74
в растворе, содержащем 0,398 моль этой
соли в 2 л воды. Температура кристаллизации
раствора –0,74![]() .
Криоскопическая константа воды равна
1,86.
.
Криоскопическая константа воды равна
1,86.
Решение:
1) Вычислим
мольную концентрацию хлорида кальция
![]() моль/1000г
моль/1000г
Вычислим изотонический коэффициент по закону Рауля

Вычислим кажущуюся степень ионизации в растворе:
Хлорид кальция
диссоциирует по уравнению
![]() ,
т.е
,
т.е
![]() (при
диссоциации образуются 3 иона). Степень
ионизации связана с изотоническим
коэффициентом соотношением:
(при
диссоциации образуются 3 иона). Степень
ионизации связана с изотоническим
коэффициентом соотношением:
![]()
223
= (К / С)1/ 2 = (1,8 · 10-5 / 0,3)1/ 2 = 7,75 · 10 –3
K = [H+] · [CH3COO-] / [CH3COOH]
Так как [H+] = [CH3COO-] получаем
K = [H+]2 / [CH3COOH]
[H+] = (К · [CH3COOH])1/ 2 = (1,8 · 10-5 · 0,3)1/ 2 = 2,32 · 10 –3
224
Используем формулу
tвыч = Eкр · m(в-ва) · 1000 / m (р-ля) · M (в-ва) =
= 1.86 · 1.70 · 1000 / 250 · 136 = 0.093 0C
tоп = 0,23 – 0 = 0,23
i = tоп / tвыч = 0.23 / 0.093 = 2.47
= (i – 1) / (k – 1) = (2.47 – 1) / (3 – 1) = 0.74
где k – число ионов, образующих молекулу.
225
Используем формулу
tвыч = Eкр · ν(в-ва) · 1000 / m (р-ля) =
= 1.86 · 0.25 · 1000 / 2500 = 0.186 0C
tоп = 0,35 – 0 = 0,35
i = tоп / tвыч = 0.35 / 0.186 = 1.88
= (i – 1) / (k – 1) = (1.88 – 1) / (2 – 1) = 0.88
где k – число ионов, образующих молекулу.
226
[H+] · [OH-] = 10 –14 это константа.
Количество протонов в растворе равно числу распавшихся молекул
[H+] = 0.01 · 0.042 = 0.00042 моль / л
pH = - lg [H+] = 3.38
pOH = 14 - pH = 14 - 3.38 = 10.62
227
H2SO4 = 2H+ + SO42-
m (р-ра) = V · ρ = 2 · 1.84 = 3.68 г
m (H2SO4) = 3.68 · 0.96 = 3.53 г
ν (H2SO4) = m / M = 3.53 / 98 = 0.036 моль
С (H2SO4) = ν / V = 0.036 / 3 = 0.012 моль / л
Концентрация протонов в два раза больше концентрации кислоты, и если последняя полностью диссоциирована получаем:
[H+] = 2 · 0.012 = 0.024 моль / л
pH = -lg [H+] = 1.62
№228
Чему равен рН раствора, в литре которого содержится 0,0051г гидроксильных ионов?
Решение:
![]()
Молярная
масса гидроксильных ионов равна
![]()
Концентрация ионов в молях на литр равна :
![]() моль/л
моль/л
![]()
229
HCl = H+ + Cl-
Расчет ведем на один литр раствора:
m (р-ра) = V · ρ = 1000 · 1.015 = 1015 г
m (HСl) = 1015 · 0.0312 = 31.668 г
ν (HCl) = m / M = 31.668 / 36.5 = 0.868 моль
С (HCl) = ν / V = 0.868 / 1 = 0.868 моль / л
Концентрация протонов равна концентрации кислоты, и если последняя полностью диссоциирована получаем:
[H+] = 0.868 моль / л
pH = -lg [H+] = 0.06
№230
1г 72% азотной
кислоты разбавили до 3,3л. Чему будет
равно рН раствора при
![]() =1?
=1?
Решение:
Вычислим содержание азотной кислоты в 1 г 72% раствора.
в 100г раствора содержится 72г кислоты
в 1 г раствора содержится х г кислоты
![]() г
г
Чему равна молярная концентрация раствора?

концентрация
ионов водорода в растворе при
![]() =1
равна молярной концентрации кислоты
0,0035моль/л
=1
равна молярной концентрации кислоты
0,0035моль/л
![]()
231
HNO3 = H+ + NO3-
m (р-ра) = V · ρ = 2 · 1.43 = 2.86 г
m (HNO3) = 2.86 · 0.72 = 2.06 г
ν = m / M = 2.06 / 63 = 0.033 моль
C = ν / V = 0.033 / 2 = 0.016 моль / л
Концентрация протонов равна концентрации кислоты, и если последняя полностью диссоциирована получаем:
[H+] = 0.016 моль / л
pH = -lg [H+] = 1.79
232
Если [H+] = 1 моль / л pH = -lg [H+] = 0
Если [ОH-] = 1 моль / л pОH = -lg [ОH-] = 0
Возможно концентрации этих ионов могут быть больше одного моль на литр, тогда рН и рОН будут меньше нуля.
pH = -lg [H+] = -lg 10 -4 = 4
pОH = 14 - рН = 14 – 4 = 10
233
рН – водородный показатель – это отрицательный логарифм активности протонов.
рН = - lg [H+]
рОН – гидроксильный показатель – это отрицательный логарифм активности гидроксид-ионов.
рOН = - lg [OH-]
Эти величины определяют кислотность среды. Например для воды:
Kw = [H+] · [OH-] = 10-14
- lg Kw = - lg [H+] - lg [OH-]
pKw = pН + pOH = 14
pH = 14 – pOH
Среда кислая при рН < 7 или pOH > 7
- Среда щелочная при рН > 7 или pOH < 7
HCN = H+ + CN-
K = [H+] · [CN-] / [HCN]
Так как [H+] = [CN-] и учитывая, что синильная кислота очень слабый электролит (практически не диссоциирует) будем считать
[HCN] ≈ 0.1 н = 0.1 М
K = [H+]2 / [HCN] = 7.2 · 10-10
[H+] = (К · [HCN])1/ 2 = (7.2 · 10-10 · 0.1)1/ 2 = 8.49 · 10 –6
pH = - lg [H+] = 5.07
pOH = 14 – pH = 14 – 5.07 = 8.93
№236
Смешали равные объемы растворов сильных кислот с рН=1 и рН=2. Вычислите рН полученного раствора.
Решение:
Вычислим концентрацию раствора с рН=1

Вычислим концентрацию раствора с рН=2

При смешении равных объемов растворов, концентрация каждого из растворов уменьшится вдвое:

Суммарная
концентрация ионов водорода:
![]()
рН полученного раствора равен:
![]()
№234
5г раствора
98% серной кислоты разбавили до 5л. Чему
равно рН полученного раствора при
![]() ?
?
Решение:
Сколько граммов кислоты содержится в 5 граммах раствора?
В 100г раствора
содержится 98 г
![]()
В 5 г раствора
содержится х г
![]()
![]() г
г
Вычислим молярную концентрацию раствора.
![]()
![]() моль/л
моль/л
поскольку
![]() диссоциирует по уравнению:
диссоциирует по уравнению:
![]() ,
т.е. из каждого моля кислоты образуется
2 моля ионов водорода, то при
,
т.е. из каждого моля кислоты образуется
2 моля ионов водорода, то при
![]() концентрация ионов водорода равна
концентрация ионов водорода равна
![]() моль/л
моль/л
Чему равна рН раствора кислоты?
![]()
235
NaOH = Na+ + OH-
ν = m / M = 1 / 40 = 0.025 моль
C = ν / V = 0.025 / 10 = 0.0025 моль / л
Концентрация гидроксид-ионов равна концентрации щелочи, и если последняя полностью диссоциирована получаем:
[ОH-] = 0.0025 моль / л
pОH = -lg [ОH-] = 2.60
pH = 14 - pОH = 14 - 2.60 = 11,40
237
Пусть смешали по 1 литру каждого раствора, тогда:
[H+]1 = 10-12 моль / л
[H+]2 = 10-11моль / л
ν = [H+]1 + [H+]2 = 10-12 + 10-12 = 1.1 · 10-11 моль
Раствора стало два литра:
[H+] = ν / V = 1.1 · 10-11 / 2 = 5.5 · 10-12 моль / л
pH = -lg [H+] = 11.26
№238
Смешали равные объемы растворов сильных кислоты и щелочи с рН=2 и рН=11. Вычислите рН полученного раствора.
Решение:
1) Вычислим концентрацию ионов водорода в растворе с рН=2.
![]()
![]() моль/л
моль/л
2) Вычислим
концентрацию ионов
![]() в растворе с рН=11.
в растворе с рН=11.

![]() моль/л
моль/л
3) при сливании растворов произойдет нейтрализация растворов.
Кислота и щелочь прореагируют в эквивалентных количествах, поскольку концентрация кислоты выше, то реакция среды останется кислой, концентрация кислоты уменьшится:
![]()
рН полученного раствора равно:
![]()
239
Если кислота диссоциирована полностью:
H2SO4 = 2H+ + SO42-
[H+] = 10-2,2 = 6.31 ·10-3 моль / л
Эта величина также является нормальностью кислоты. Кроме того, из уравнения видно, что концентрация кислоты в два раза меньше концентрации протонов:
[H2SO4] = [H+] / 2 = 6.31 ·10-3 / 2 = 3.15 · 10-3 моль / л
240
[H+] = 10 – 4,3 = 5 · 10-5 моль / л
pОH = 14 - рН = 14 – 4,3 = 9,7
[ОH-] = 10 – 9,7 = 2 · 10-10 моль / л
241
Гидролиз протекает преимущественно по первой ступени.
CrCl3 + H2O = Cr(OH)Cl2 + HCl
Cr3+ + 3Cl- + H2O = Cr(OH)2+ + 2Cl- + H+ + Cl-
Cr3+ + H2O = Cr(OH)2+ + H+ pH < 7
2FeSO4 + 2H2O = (FeOH)2SO4 + H2SO4
2Fe2+ + 2SO42- + 2H2O = 2(FeOH)+ + SO42- + 2H+ + SO42-
2Fe2+ + 2H2O = 2(FeOH)+ + 2H+
Fe2+ + H2O = (FeOH)+ + H+ pH < 7
Na2S + H2O = NaHS + NaOH
2Na+ + S2- + H2O = Na+ + HS- + Na+ + OH-
S2- + H2O = HS- + OH- pH > 7
242
Zn(NO3)2 + H2O = Zn(OH)NO3 + HNO3
Zn2+ + 2NO3- + H2O = Zn(OH)+ + NO3- + H+ + NO3-
Zn2+ + H2O = Zn(OH)+ + H+ кислая реакция рН < 7
Al2(SO4)3 + 2H2O = 2Al(OH)SO4 + H2SO4
2Al3+ + 3SO42- + 2H2O = 2Al(OH)2+ + 2SO42- + 2H+ + SO42-
2Al3+ + 2H2O = 2Al(OH)2+ + 2H+
Al3+ + H2O = Al(OH)2+ + H+
pH < 7
K2CO3 + H2O = KHCO3 + KOH
2K+ + CO32- + H2O = K+ + HCO3- + K+ + OH-
CO32- + H2O = HCO3- + OH-
pH > 7 реакция щелочная
Нитрат калия не гидролизуется, так как эта соль образована сильной кислотой и сильным основанием.
NaCN + H2O = NaOH + HCN
Na+ + CN- + H2O = Na+ + OH- + HCN
CN- + H2O = HCN + OH-
pH > 7 реакция щелочная
№244
Как зависит
степень гидролиза от температуры?
почему? В какую сторону сместится
равновесие гидролиза
![]() ,
если к раствору добавить: а) щелочь; б)
кислоту; в) хлорид аммония?
,
если к раствору добавить: а) щелочь; б)
кислоту; в) хлорид аммония?
Поскольку гидролиз усиливается при повышении температуры, равновесие сдвигается в сторону образования продуктов гидролиза, то степень гидролиза повышается с ростом температурыю
Гидролиз
![]() .
.
![]() - соль, образованная слабой кислотой и
сильным основанием, в растворе будет
идти гидролиз по аниону:
- соль, образованная слабой кислотой и
сильным основанием, в растворе будет
идти гидролиз по аниону:
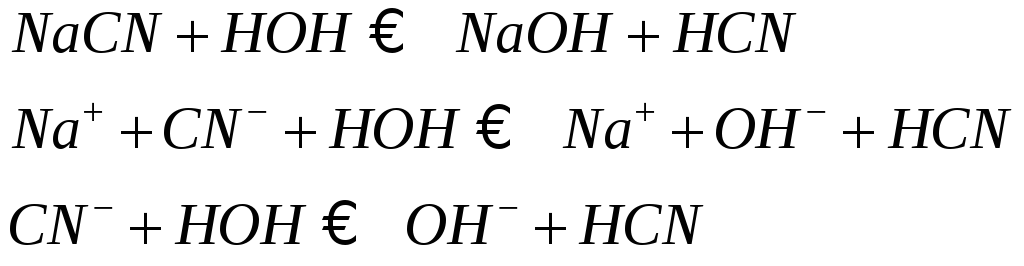
реакция среды
щелочная,
![]() .
.
А) при добавлении
щелочи, повышается концентрация
![]() в растворе, равновесие сдвигается в
сторону обратной реакции, гидролиз
уменьшается.
в растворе, равновесие сдвигается в
сторону обратной реакции, гидролиз
уменьшается.
Б) при добавлении
кислоты, ионы
![]() будут связывать ионы
будут связывать ионы
![]() ,
образуя молекулы воды, равновесие
сместится в сторону образования продуктов
гидролиза, гидролиз усилится.
,
образуя молекулы воды, равновесие
сместится в сторону образования продуктов
гидролиза, гидролиз усилится.
В) При добавлении
хлорида аммония усиливается гидролиз
каждой из солей:
![]() и
и
![]() ,
поскольку в результате реакции обмена
образуется соль слабого основания и
слабой кислоты, гидролизующаяся по
катиону и аниону:
,
поскольку в результате реакции обмена
образуется соль слабого основания и
слабой кислоты, гидролизующаяся по
катиону и аниону:

245
а) 3Na3S + 2Al(NO3)3 = Al2S3 + 6NaNO3
6Na+ + 3S2- + 2Al3+ + 6NO3- = Al2S3 + 6NO3- + 6Na+
3S2- + 2Al3+ = Al2S3
б) 3Na2CO3 + Cr2(SO4)3 = 3Na2SO4 + Cr2(CO3)3
6Na+ + 3CO32- + 2Cr3+ + 3SO42- = Cr2(CO3)3 + 6Na+ + 3SO42-
3CO32- + Cr3+ = Cr2(CO3)3
246
1) FeCl3 + H2O = Fe(OH)Cl2 + HCl
Fe3+ + 3Cl- + H2O = Fe(OH)2+ + 2Cl- + H+ + Cl-
Fe3+ + H2O = Fe(OH)2+ + H+
FeCl2 + H2O = Fe(OH)Cl + HCl
Fe2+ + 2Cl- + H2O = Fe(OH)+ + Cl- + H+ + Cl-
Fe2+ + H2O = Fe(OH)+ + H+
Так как гидроксид железа (III) намного более слабое основание, чем гидроксид железа (II) гидролиз FeCl3 протекает интенсивнее, чем FeCl2.
2) ZnCl2 + H2O = Zn(OH)Cl + HCl
Zn2+ + 2Cl- + H2O = Zn(OH)+ + Cl- + H+ + Cl-
Zn2+ + H2O = Zn(OH)+ + H+
MgCl2 + H2O = Mg(OH)Cl + HCl
Mg2+ + 2Cl- + H2O = Mg(OH)+ + Cl- + H+ + Cl-
Mg2+ + H2O = Mg(OH)+ + H+
Так как гидроксид цинка намного более слабое основание, чем гидроксид магния гидролиз ZnCl2 протекает интенсивнее, чем MgCl2.
3) CH3COONa + H2O = CH3COOH + NaOH
CH3COO- + Na+ + H2O = CH3COOH + Na+ + OH-
CH3COO- + H2O = CH3COOH + OH-
NaCN + H2O = HCN + NaOH
CN- + Na+ + H2O = HCN + Na+ + OH-
CN- + H2O = HCN + OH-
Так как HCN намного более слабая кислота, чем уксусная - гидролиз цианида натрия протекает интенсивнее, чем его ацетата.
247
1) K2S + H2O = KHS + KOH
2K+ + S2- + H2O = K+ + HS- + K+ + OH-
S2- + H2O = HS- + OH-
Лакмус желтеет pH > 7
2) KI не гидролизуется. Среда нейтральная. Цвет лакмуса не меняется.
3) 2CuSO4 + 2H2O = (CuOH)2SO4 + H2SO4
2Cu2+ + 2SO42- + 2H2O = 2(CuOH)+ + SO42- + 2H+ + SO42-
2Cu2+ + 2H2O = 2(CuOH)+ + 2H+
Cu2+ + H2O = (CuOH)+ + H+
Лакмус краснеет рН < 7.
4) NaClO + H2O = HClO + NaOH
Na+ + ClO- + H2O = Na+ + HClO + OH-
ClO- + H2O = HClO + OH-
Лакмус желтеет pH > 7
3) Cd(NO3)2 + H2O = Cd(OH)NO3 + HNO3
Cd2+ + 2NO3- + H2O = Cd(OH)+ + NO3- + H+ + NO3-
Cd2+ + H2O = Cd(OH)+ + H+
Лакмус краснеет pH < 7
248
Гидролиз для указанных соединений протекает преимущественно по первой ступени.
1) Na2CO3 + H2O = NaHCO3 + NaOH
2Na+ + CO32- + H2O = Na+ + HCO3- + Na+ + OH-
CO32- + H2O = HCO3- + OH-
Na2SO3 + H2O = NaHSO3 + NaOH
2Na+ + SO32- + H2O = Na+ + HSO3- + Na+ + OH-
SO32- + H2O = HSO3- + OH-
Так как угольная кислота более слабая, чем сернистая гидролиз карбоната протекает интенсивнее, чем соответствующего сульфита.
2) TlCl3 + H2O = Tl(OH)Cl2 + HCl
Tl3+ + 3Cl- + H2O = Tl(OH)2+ + 2Cl- + H+ + Cl-
Tl3+ + H2O = Tl(OH)2+ + H+
TlCl + H2O = TlOH + HCl
Tl+ + Cl- + H2O = TlOH + Cl- + H+
Tl+ + H2O = TlOH + H+
Так как гидроксид таллия (III) намного более слабое основание, чем гидроксид таллия (I) гидролиз TlCl3 протекает интенсивнее, чем TlCl.
3) SnCl4 + H2O = Sn(OH)Cl3 + HCl
Sn4+ + 4Cl- + H2O = Sn(OH)3+ + 3Cl- + H+ + Cl-
Sn4+ + H2O = Sn(OH)3+ + H+
SnCl2 + H2O = Sn(OH)Cl + HCl
Sn2+ + 2Cl- + H2O = SnOH+ + Cl- + H+ + Cl-
Sn2+ + H2O = SnOH+ + H+
Так как гидроксид олова (IV) намного более слабое основание, чем гидроксид олова (II) гидролиз SnCl4 протекает интенсивнее, чем SnCl2
249
Влияние на степень гидролиза оказывает кислотность среды и температура. Основные соли образуются, если гидролизующаяся соль образована сильной кислотой и слабым основанием
ZnCl2 + H2O = Zn(OH)Cl + HCl
Zn2+ + 2Cl- + H2O = Zn(OH)+ + Cl- + H+ + Cl-
Zn2+ + H2O = Zn(OH)+ + H+
Кислые соли образуются, если гидролизующаяся соль образована слабой кислотой и сильным основанием
Na2CO3 + H2O = NaHCO3 + NaOH
2Na+ + CO32- + H2O = Na+ + HCO3- + Na+ + OH-
CO32- + H2O = HCO3- + OH-
250
Гидролиз для указанных соединений протекает преимущественно по первой ступени.
1) CH3COONa + H2O = CH3COOH + NaOH
CH3COO- + Na+ + H2O = CH3COOH + Na+ + OH-
CH3COO- + H2O = CH3COOH + OH-
HCOONa + H2O = HCOOH + NaOH
HCOO- + Na+ + H2O = HCOOH + Na+ + OH-
HCOO- + H2O = HCOOH + OH-
Так как уксусная кислота более слабая кислота, чем муравьиная - гидролиз ацетата натрия протекает интенсивнее, чем его формиата.
2) K2S + H2O = KHS + KOH
2K+ + S2- + H2O = K+ + HS- + K+ + OH-
S2- + H2O = HS- + OH-
K2Te + H2O = KHTe + KOH
2K+ + Te2- + H2O = K+ + HTe- + K+ + OH-
Te2- + H2O = HTe- + OH-
Так как сероводородная кислота более слабая кислота, чем теллуроводородная - гидролиз сульфида калия протекает интенсивнее, чем его теллурида.
3) NaNO2 + H2O = HNO2 + NaOH
Na+ + NO2- + H2O = HNO2 + Na+ + OH-
NO2- + H2O = HNO2 + OH-
Хлорид натрия совсем не гидролизуется, так как он образован сильной кислотой и сильным основанием.
№251
Растворы
кислоты и основания смешали в эквивалентных
соотношениях: а)
![]() ;
;
Б)
![]() ;
в)
;
в)
![]() .
Как окрасится лакмус в растворах? Почему?
Составьте молекулярные и ионно-молекулярные
уравнения соответствующих реакций.
.
Как окрасится лакмус в растворах? Почему?
Составьте молекулярные и ионно-молекулярные
уравнения соответствующих реакций.
Поскольку данные реакции – реакции нейтрализации, то среда в растворах при смешении в эквивалентных количествах будет нейтральная, лакмус в нейтральной среде имеет синюю окраску.



252
FeCl3 + H2O = Fe(OH)Cl2 + HCl
Fe3+ + 3Cl- + H2O = Fe(OH)2+ + 2Cl- + H+ + Cl-
Fe3+ + H2O = Fe(OH)2+ + H+
А) при добавлении кислоты равновесие сместится влево.
Б) при добавлении щелочи гидролиз усилится, так как связываются образующиеся ионы водорода H+ + OH- = H2O
и соль гидролизуется полностью
FeCl3 + 3H2O = Fe(OH)3 + 3HCl
Fe3+ + 3Cl- + 3H2O = Fe(OH)3 + 3Cl- + 3H+
Fe3+ + 3H2O = Fe(OH)3 + 3H+
В) хлорид цинка уменьшит гидролиз , так как его водные растворы имеют кислую реакцию
ZnCl2 + H2O = Zn(OH)Cl + HCl
Zn2+ + 2Cl- + H2O = Zn(OH)+ + Cl- + H+ + Cl-
Zn2+ + H2O = Zn(OH)+ + H+
г) карбонат натрия усилит гидролиз , так как его водные растворы имеют щелочную реакцию
Na2CO3 + H2O = NaHCO3 + NaOH
2Na+ + CO32- + H2O = Na+ + HCO3- + Na+ + OH-
CO32- + H2O = HCO3- + OH-
Хотя можно предположить образование основного карбоната железа.
д) Цинк на гидролиз не влияет, но будет вытеснять железо из его соли.
Е) Увеличение концентрации воды усилит гидролиз.
253
CH3COONa + H2O = CH3COOH + NaOH
CH3COO- + Na+ + H2O = CH3COOH + Na+ + OH-
CH3COO- + H2O = CH3COOH + OH-
Фенолфталеин в щелочной среде приобретает малиновую окраску. Усиление окраски при нагревании, очевидно, связано с увеличением степени гидролиза. Наоборот, при охлаждении соль гидролизуется в меньшей степени.
№254
Какие из солей взаимно усиливают гидролиз друг друга:
А)
![]() ;
;
Б)
![]() ;
;
В)
![]() ;
;
Г)
![]() ;
;
Д)
![]() ?
?
Составьте ионно-молекулярные уравнения соответствующих реакций.
Решение:
А)
![]()
В растворе хлорида алюминия гидролиз обусловливает катион:
![]()
В растворе сульфида натрия гидролиз обусловливает анион:
![]()
Гидролиз этих
солей обычно ограничивается первой
ступенью. При смешивании растворов ионы
![]() и
и
![]() взаимодействуют друг с другом, образуя
молекулы слабого электролита
взаимодействуют друг с другом, образуя
молекулы слабого электролита
![]() ,
который уходит из сферы реакции. Это
приводит к тому, что усиливается гидролиз
каждой из солей до образования
,
который уходит из сферы реакции. Это
приводит к тому, что усиливается гидролиз
каждой из солей до образования
![]() и
и
![]() :
:

б)
![]()
В растворе хлорида хрома гидролиз обусловливает катион:
![]()
В растворе карбоната натрия гидролиз обусловливает анион:
![]()
Гидролиз этих
солей обычно ограничивается первой
ступенью. При смешивании растворов ионы
![]() и
и
![]() взаимодействуют друг с другом, образуя
молекулы слабого электролита
взаимодействуют друг с другом, образуя
молекулы слабого электролита
![]() ,
который уходит из сферы реакции. Это
приводит к тому, что усиливается гидролиз
каждой из солей до образования
,
который уходит из сферы реакции. Это
приводит к тому, что усиливается гидролиз
каждой из солей до образования
![]() и
и
![]() :
:

в)
![]()
В растворе сульфата железа гидролиз обусловливает катион:
![]()
В растворе хлорида цинка гидролиз тоже обусловливает катион:
![]() ,
,
поэтому соли будут взаимно ослаблять гидролиз друг друга.
Г)
![]()
В растворе нитратаа хрома гидролиз обусловливает катион:
![]()
хлорид магния гидролизу не подвергается. Реакция между веществами идти небудет, усиления гидролиза не произойдет.
Д)
![]()
В растворе хлорида железа гидролиз обусловливает катион:
![]()
В растворе сульфита натрия гидролиз обусловливает анион:
![]()
Гидролиз этих
солей обычно ограничивается первой
ступенью. При смешивании растворов ионы
![]() и
и
![]() взаимодействуют друг с другом, образуя
молекулы слабого электролита
взаимодействуют друг с другом, образуя
молекулы слабого электролита
![]() ,
который уходит из сферы реакции. Это
приводит к тому, что усиливается гидролиз
каждой из солей до образования
,
который уходит из сферы реакции. Это
приводит к тому, что усиливается гидролиз
каждой из солей до образования
![]() и
и
![]() :
:

255
Обычно, сода гидролизуется по первой ступени:
Na2CO3 + H2O = NaHCO3 + NaOH
2Na+ + CO32- + H2O = HCO3- + 2Na+ + OH-
CO32- + H2O = HCO3- + OH-
Но в кислой среде сода гидролизуется полностью, так как связываются образующиеся гидроксид-ионы H+ + OH- = H2O :
Na2CO3 + 2H2O = H2О + CO2 + 2NaOH
2Na+ + CO32- + 2H2O = H2CO3 + 2Na+ + 2OH-
CO32- + 2H2O = H2O + CO2 + 2OH-
А) Сульфат натрия имеет нейтральную реакцию водных растворов и не влияет на гидролиз.
Б) хлорид хрома усилит гидролиз , так как его водные растворы имеют кислую реакцию
CrCl3 + H2O = Cr(OH)Cl2 + HCl
Cr3+ + 3Cl- + H2O = Cr(OH)2+ + 2Cl- + H+ + Cl-
Cr3+ + H2O = Cr(OH)2+ + H+
В) хлорид магния имеет нейтральную реакцию водных растворов и не влияет на гидролиз.
Г) сульфат алюминия усилит гидролиз , так как его водные растворы имеют кислую реакцию
Al2(SO4)3 + 2H2O = 2Al(OH)SO4 + H2SO4
2Al3+ + 3SO42- + 2H2O = 2Al(OH)2+ + 2SO42- + 2H+ + SO42-
2Al3+ + 2H2O = 2Al(OH)2+ + 2H+
Al3+ + H2O = Al(OH)2+ + H+
Д) Аналогично:
Fe(NO3)3 + H2O = Fe(OH)(NO3)2 + HNO3
Fe3+ + 3NO3- + H2O = Fe(OH)2+ + 2NO3- + H+ + NO3-
Fe3+ + H2O = Fe(OH)2+ + H+
Cтоит также учесть образование малорастворимых карбонатов.
256
С (SO42-) = C (Ca2+) = 0.04 / 2 = 0.02 моль / л
Так как смешивают равные объемы, то концентрация этих ионов уменьшается в двое. Значит:
[SO42-] · [Ca2+] = 0.01 · 0.01 = 0.0001
Данное произведение концентраций ионов больше произведения растворимости сульфата кальция, значит осадок будет образовываться.
257
Sr2+ + CO32- = SrCO3
ν (SrCO3) = m / M = 0.05 / 148 = 3.38 · 10 - 4 моль
C (SrCO3) = ν / V = 3.38 · 10 - 4 / 5 = 6.76 · 10 - 5 моль / л
Концентрация карбонат-ионов равна концентрации ионов стронция и, собственно, концентрации данной соли в растворе.
То есть
[Sr2+] = [CO32-] = 6.76 · 10 - 5 моль / л
ПР = [Sr2+] · [CO32-] = 6.76 · 10 - 5 · 6.76 · 10 - 5 = 4,57 · 10-9
258
Sr2+ + SO42- = SrSO4
Растворимость SrSO4 равна концентрации каждого из ионов, то есть ПР = S2 , отсюда
S = (ПР)1/ 2 = (3.6 · 10-7 )1/ 2 = 6.0 · 10 – 4 моль / л
Масса этого колличества вещества, содержащегося в одном литре раствора равна
S · M = 6.0 · 10 – 4 · 184 = 0.11 г.
259
Fe2+ + 2OH- = Fe(OH)2
ν (Fe(OH)2) = m / M = 9.6 · 10-5 / 90 = 1.07 · 10 - 6 моль
S (Fe(OH)2) = ν / V = 1.07 · 10 - 6 / 0.1 = 1.07 · 10 - 5 моль / л
Концентрация гидроксид-ионов в два раза больше концентрации ионов железа и, собственно, растворимости данного соединения.
То есть
[Fe2+] = 1.07 · 10 - 5 моль / л
[OH-] = 2 · [Fe2+] = 2 · 1.07 · 10 - 5 = 2,13 · 10-5 моль / л
ПР = [Fe2+] · [OH-]2 = 1.07 · 10 - 5 · (2,13 · 10-5)2 = 4,85 · 10-15
№260
Произведение
растворимости
![]() равно
равно
![]() .
Вычислите растворимость этой соли в
молях на литр и в граммах на литр.
.
Вычислите растворимость этой соли в
молях на литр и в граммах на литр.
Решение:
![]() диссоциирует по уравнению:
диссоциирует по уравнению:
![]()
При диссоциации
![]() ионов
ионов
![]() получается в 2 раза больше, чем ионов
получается в 2 раза больше, чем ионов
![]() .
Следовательно,
.
Следовательно,
![]()
Произведение концентрации соли
![]()
Выразим
концентрацию ионов
![]() через концентрацию ионов
через концентрацию ионов
![]() :
:
![]()
Концентрация
ионов
![]() равна:
равна:
![]()
Следовательно,
растворимость соли
![]() моль/л.
моль/л.
Молярная
масса фторида магния
![]()
Растворимость
соли в граммах на литр:
![]() г/л
г/л
261
Перейдем к молярным концентрациям:
С (SO42-) = 1.00 · ½ = 0.5 моль / л
C (Ag+) = 0.02 · 1 = 0.02 моль / л
Так как смешивают равные объемы, то концентрация этих ионов уменьшается в двое. Значит:
[I-] · [Ag+] = 0.01 · 0.25 = 2.50 · 10 -3
Данное произведение концентраций ионов больше произведения растворимости сульфата серебра, значит осадок будет образовываться.
262
ПР = [Ba2+] · [CO32-] = 1.9 · 10-9
SM = [Ba2+] = [CO32-] = ПР1/2 = 4.36 · 10-5 моль / л
S = SM · M = 4.36 · 10-5 · 197 = 8.59 · 10-3 г / л
Где М = 137 + 12 + 3 · 16 = 197 г / моль.
8.59 · 10-3 г растворится в 1 л
1 г -------------------- V
V = 1 / 8.59 · 10-3 = 116.5 л.
263
Найдем массу ионов иода:
0.0268 г Х
PbI2 = Pb2+ + 2I-
207 г 2 · 127 = 254 г
Х = 0.0268 · 254 / 207 = 0.0329 г иода
Перейдем к молярным концентрациям:
[Pb2+] = ( m / M ) / V = (0.0268 / 207) / 0.1 = 0.0013 моль / л
[I-] = ( m / M ) / V = (0.0329 / 127) / 0.1 = 0.0026 моль / л
ПР = [Pb2+] · [I-]2 = 0.0013 · (0.0026)2 = 7.79 · 10-9
№264
Концентрация
ионов магния в насыщенном растворе
![]() составляет
составляет
![]() г/л.
Вычислите произведение растворимости
гидроксида.
г/л.
Вычислите произведение растворимости
гидроксида.
Решение:
Молекулярная
масса
![]() равна:
равна:
![]()
Молярная
концентрация
![]() равна:
равна:
![]() моль/л
моль/л
Гидроксид
магния диссоциирует по уравнению:
![]() ,
т.е. ионов
,
т.е. ионов
![]() образуется в 2 раза больше ионов магния,
значит,
образуется в 2 раза больше ионов магния,
значит,
![]()
Произведение растворимости гидроксида равно:
![]()
265
Так как фактор эквивалентности равен единице для обоих соединений:
С (I-) = C (Ag+) = 0.002 моль / л
Так как смешивают равные объемы, то концентрация этих ионов уменьшается в двое. Значит:
[I-] · [Ag+] = 0.001 · 0.001 = 10 - 6
Данное произведение концентраций ионов больше произведения растворимости йодида серебра, значит осадок будет образовываться.
№266
Произведение
растворимости
![]()
![]() .
Вычислите растворимость соли в молях
и в граммах на литр.
.
Вычислите растворимость соли в молях
и в граммах на литр.
Решение:
Сульфат свинца
диссоциирует по уравнению:
![]()
Произведение растворимости равно:
![]()
Растворимость соли равна концентрации ионов свинца в растворе:
![]() моль/л
моль/л
Молекулярная
масса сульфата свинца:
![]()
Растворимость соли в г/л равна:
![]() г/л
г/л
268
SM = [AgCl] = [Ag+] = [Cl-]
ПР = [Ag+] · [Cl-] = (SM)2 = (1.3 · 10-5)2 = 1.7 · 10-10
S = SM · M = 1.3 · 10-5 · 143.4 = 0.0019 г / л
Где М = 107.9 + 35.5 = 143.4 г / моль.
269
СaCO3 = Ca2+ + CO32-
ПР = [Ca2+] · [CO32-] = 4.8 · 10-9
SM = [Ca2+] = [CO32-] = ПР1/2 = 6.9 · 10-5 моль / л
S = SM · M = 4.36 · 10-5 · 100 = 6.9 · 10-3 г / л
Где М = 40 + 12 + 3 · 16 = 100 г / моль.
№270
Растворимость
![]() в воде при 20
в воде при 20![]() С
равна 0,0065г/л. Вычислите произведение
растворимости этой соли.
С
равна 0,0065г/л. Вычислите произведение
растворимости этой соли.
Решение:
Вычислим молярную концентрацию соли:
Молекулярная
масса
![]() равна:
равна:
![]()
Молярная
концентрация равна:
![]() моль/л
моль/л
![]() в растворе диссоциирует на ионы по
уравнению:
в растворе диссоциирует на ионы по
уравнению:
![]() ,
,
следовательно,
концентрация
![]() в три раза выше концентрации
в три раза выше концентрации
![]() :
:
![]() моль/л
моль/л
![]()
![]()
№271
Как строится
ряд напряжений металлов? Увеличится,
уменьшится или останется без изменения
масса цинковой пластинки при взаимодействии
с растворами: а)
![]() ;
;
Б)
![]() ;
в)
;
в)
![]() ?
Почему?
?
Почему?
Решение:
Электродным потенциалом называют ЭДС гальванического элемента, который составлен из исследуемого электрода, погруженного в раствор его соли с концентрацией ионов металла 1моль/л, и стандартного водородного электрода.
Располагая металлы в порядке возрастания алгебраической величины их стандартных электродных потенциалов, получают ряд стандартных электродных потенциалов металлов.
Ряд стандартных электродных потенциалов характеризует химические свойства металлов. Чем меньше алгебраическое значение потенциала, тем выше восстановительная способность этого металла и тем ниже окислительная способность его ионов, поэтому каждый металл в ряду стандартных электродных потенциалов способен вытеснять все следующие за ним металлы из растворов их солей.
Сравним потенциалы металлов, заданных по условию задачи:
|
Металл |
Mg |
Zn |
Pb |
Cu |
|
Стандартный потенциал, В |
-2,37 |
-0,76 |
-0,13 |
+0,34 |
На основании потенциалов можно сделать вывод, что цинк вытеснит из солей медь и свинец, масса цинковой пластинки уменьшится. Поскольку магний активнее цинка, то масса цинковой пластинки останется без изменения.
Уравнения реакций, соответствующим растворению цинковой пластинки в растворах сульфата меди и нитрата свинца:

![]()
![]()
273
Используем уравнение Нернста:
E = E0 + lg C · 0.059 / n
-1.23 = -1.18 + lg C · 0.059 / 2
lg C · 0.059 / 2 = -1.23 + 1.18
lg C = - 0.05 / 0.029 = -1.72
C = 10 –1.72 = 0.019 моль / л
274
Сущность коррозии – в образовании гальванических пар, в которых металл-анод особенно подвержен воздействию окружающей среды.
Коррозия луженого железа при нарушении покрытия происходит очень быстро, так как в этой системе железо является анодом (E0(Fe2+/Fe) = -0.44 В), а олово катодом (E0(Sn2+/Sn) = -0.136 В).
Во влажном воздухе:
Анод Fe – 2e = Fe2+
Катод O2 + 2H2O + 4e = 4OH –
Fe2+ + 2OH- = Fe(OH)2
В кислоте:
Анод Fe – 2e = Fe2+
Катод 2Н+ + 2е = Н2
Образуется соответствующая соль железа.
Коррозия оцинкованного железа начнется когда весь цинк перейдет в раствор. Железо является катодом, а цинк – анодом (E0(Zn2+/Zn) = -0.763 В).
Во влажном воздухе:
Анод Zn – 2e = Zn2+
Катод O2 + 2H2O + 4e = 4OH –
Zn2+ + 2OH- = Zn(OH)2
В кислоте:
Анод Zn – 2e = Zn2+
Катод 2Н+ + 2е = Н2
Образуется соответствующая соль цинка.
275
Серебро не вытесняет водород, так как в ряду напряжений оно стоит правее; стандартный потенциал серебра (+0,80 В) больше стандартного потенциала водородного электрода (0,000 В). В паре с цинком образуется гальванический элемент, где серебро является катодом, а цинк – анодом (-0,763 В).
Анод Zn – 2e = Zn2+
Катод 2H+ + 2e = H2
Цинк растворяется, а выделение водорода происходит на серебре.
№276
Составьте
схемы электролиза водных растворов
![]() при
угольных электродах, а
при
угольных электродах, а
![]() при медном аноде.
при медном аноде.
Решение:
Электролиз
водного раствора
![]()
Анод:
![]()
Катод:
![]()
Суммарное
уравнение:
![]()
Электролиз
водного раствора
![]()
Анод:
![]()
Катод:
![]()
Суммарное
уравнение:
![]()
Электролиз
водного раствора
![]()
Анод:
![]()
Катод:
![]()
Суммарное
уравнение:

Электролиз
![]() с медными анодами
с медными анодами
Анод:
![]()
Катод:
![]()
277
При электролизе раствора NaCl:
анод (+) 2Cl- – 2e = Cl2
катод (-) 2H2O + 2e = H2 + 2OH-
Видно, что расходуется хлор, а значит количество соли уменьшается.
При электролизе раствора Na3PO4:
анод (+) 2H2O – 4e = O2 + 4H+
катод (-) 2H2O + 2e = H2 + 2OH-
Ионы соли не участвуют в этом процессе, а значит её количество не изменяется. Но увеличивается концентрация соли в связи с расходом воды.
278
В концентрационном гальваническом элементе разность потенциалов возникает вследствие различной концентрации солевых растворов у катода и анода выполненных из одного металла.
анод (-) Ag / Ag+ // Ag+ / Ag (+) катод
анод Ag – e = Ag+
катод Ag+ + e = Ag
E = E0 + lg C · 0.059 / n
E1 = E0(Ag+/Ag) + lg C · 0.059 / n =
= 0.80 + lg 0.01 · 0.059 / 1 = 0.68 В
E2 = E0(Ag+/Ag) + lg C · 0.059 / n =
= 0.80 + lg 0.1 · 0.059 / 1 = 0.74 В
ЭДС = E2 – E1 = 0.74 – 0.68 = 0.06 В
№279
Составьте
схему, напишите электронные уравнения
электродных процессов и вычислите ЭДС
гальванического элемента, состоящего
из свинцовой и магниевой пластин,
опущенных в растворы солей с концентрацией
![]() моль/л.
Изменится ли ЭДС этого элемента, если
концентрацию каждого из ионов увеличить
в одинаковое число раз?
моль/л.
Изменится ли ЭДС этого элемента, если
концентрацию каждого из ионов увеличить
в одинаковое число раз?
Решение:
Вычислим потенциалы электродов:

ЭДС гальванического элемента
![]()
При изменении концентрации ионов ЭДС изменится.
280
Стандартный электродный потенциал водорода равен нулю.
Используем уравнение Нернста:
E = E0 + lg C · 0.059 / n
Для нашего случая, учитывая что рН = - lg C получаем:
E = - рН · 0.059 / n
а) E = - 10 · 0.059 / 1 = - 0,59 В
б) E = - 3 · 0.059 / 1 = - 0,177 В
№281
Составьте
электронные уравнения процессов,
происходящих при электролизе раствора
![]() .
Сколько граммов меди выделилось на
катоде, если на аноде выделилось (н.у.)
350мл кислорода?
.
Сколько граммов меди выделилось на
катоде, если на аноде выделилось (н.у.)
350мл кислорода?
Решение:
Электролиз
раствора
![]() :
:
Катод:
![]()
Анод:
![]()
Суммарное уравнение:
![]()
По уравнению реакции рассчитаем, сколько меди выделится на катоде:
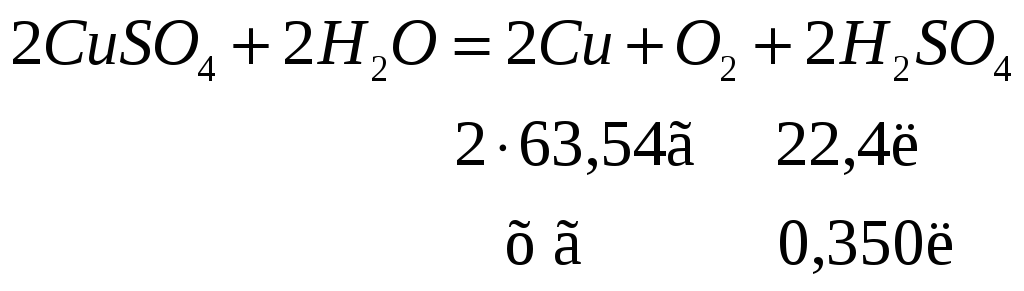
![]() г
г
282
а) анод (+) 2Cl- – 2e = Cl2
катод (-) 2H2O + 2e = H2 + 2OH-
б) анод (+) 2H2O – 4e = O2 + 4H+
катод (-) Cu2+ + 2e = Cu
в) анод (+) 2H2O – 4e = O2 + 4H+
катод (-) 2H2O + 2e = H2 + 2OH-
катод (-) Zn2+ + 2e = Zn
Щелочная среда появляется при электролизе KCl. Гидроксид-ионы появляются и при электролизе ZnSO4 , но они могут связываться ионами цинка в нерастворимый гидроксид.
283
В данной гальванической паре железо является катодом: его стандартный потенциал (-0,44 В) больше чем у алюминия (-1,70 В). Алюминий является анодом.
При кислородной деполяризации:
Анод Al – 3e = Al3+
Катод O2 + 2H2O + 4e = 4OH –
Al3+ + 3OH- = Al(OH)3
При водородной деполяризации:
Анод Al – 3e = Al3+
Катод 2H+ + 2e = H2
Продуктом коррозии является алюминиевая соль соответствующей кислоты.
284
Стандартный электродный потенциал водорода равен нулю.
Используем уравнение Нернста:
E = E0 + lg C · 0.059 / n
Для нашего случая, учитывая что рН = - lg C получаем:
E = - рН · 0.059 / n
E1 = - 2 · 0.059 / 1 = - 0,118 В
E2 = - 4 · 0.059 / 1 = - 0,236 В
ЭДС = E1 – E2 = - 0.118 – (-0.236) = 0.118 В
286
Стандартные электродные потенциалы определяются измерением ЭДС при нормальных условиях между индикаторным электродом и электродом сравнения, потенциал которого хорошо известен.
NO3- + 4H+ + 3e = NO + 2H2O E0Ox = +0.96 B / 6 / 2
2Сr3+ + 7H2O – 6e = Cr2O72- + 14H+ E0Red = +1.33 B / 3 / 1
2Сr3+ + 7H2O + 2NO3- + 8H+ = 2NO + 4H2O + Cr2O72- + 14H+
2Сr3+ + 3H2O + 2NO3- = 2NO + Cr2O72- + 6H+
E = E0Ox - E0Red = 0.96 – 1.33 = -0.37 B
Пойдет обратная реакция.
№287
Исходя из значений стандартных потенциалов, определите, прямая или обратная реакция будет протекать в этой системе при стандартных условиях:
![]() .
.
Решение:
Для определения направления окислительно-восстановительного процесса необходимо найти ЭДС гальванического элемента, образованного из данного окислителя и восстановителя. ЭДС (Е) равна:
![]() ,
,
если Е > 0, то реакция возможна.
Для данной системы стандартные потенциалы равны:

ЭДС положительна
для прямой реакции
![]() ,
т.е. в стандартных условиях будет идти
прямая реакция:
,
т.е. в стандартных условиях будет идти
прямая реакция:
1|
![]() (восстановление, окислитель)
(восстановление, окислитель)
6|
![]() (окисление,
восстановитель)
(окисление,
восстановитель)

288
Стандартные электродные потенциалы определяются измерением ЭДС при нормальных условиях между индикаторным электродом и электродом сравнения, потенциал которого хорошо известен.
Сl2 + 2e = 2Cl- E0Ox = +1.36 B / 5
Mn2+ + 4H2O – 5e = MnO4- + 8H+ E0Red = +1.51 B / 2
5Сl2 + 2Mn2+ + 8H2O = 2MnO4- + 16H+ + 10Cl-
E = E0Ox - E0Red = 1.36 – 1.51 = -0.15 B
Пойдет обратная реакция.
289
Стандартные электродные потенциалы определяются измерением ЭДС при нормальных условиях между индикаторным электродом и электродом сравнения, потенциал которого хорошо известен.
СrO42- + 2H2O + 3e = CrO2- + 4OH- E0Ox = -0.13 B / 2
2Br - – 2e = Br2 E0Red = +1.07 B / 3
2СrO42- + 4H2O + 6Br - = 3Br2 + 2CrO2- + 8OH-
E = E0Ox - E0Red = -0.13 – 1.07 = -1.20 B
Пойдет обратная реакция.
№290
Исходя из значений стандартных потенциалов, определите, прямая или обратная реакция будет протекать в этой системе при стандартных условиях:
![]() .
.
Решение:
Для определения направления окислительно-восстановительного процесса необходимо найти ЭДС гальванического элемента, образованного из данного окислителя и восстановителя. ЭДС (Е) равна:
![]() ,
,
если Е > 0, то реакция возможна.
Для данной системы стандартные потенциалы равны:

ЭДС положительна
для прямой реакции
![]() ,
т.е. в стандартных условиях будет идти
прямая реакция:
,
т.е. в стандартных условиях будет идти
прямая реакция:

291
Стандартные электродные потенциалы определяются измерением ЭДС при нормальных условиях между индикаторным электродом и электродом сравнения, потенциал которого хорошо известен.
NO3- + 4H+ + 3e = NO + 2H2O E0Ox = +0.96 B / 1
Fe2+ – e = Fe3+ E0Red = +0.77 B / 3
3Fe2+ + NO3- + 4H+ = NO + 2H2O + 3Fe3+
E = E0Ox - E0Red = 0.96 – 0.77 = 0.19 B
Пойдет прямая реакция.
№292
Исходя из значений стандартных потенциалов, определите, прямая или обратная реакция будет протекать в этой системе при стандартных условиях:
![]() .
.
Решение:
Для определения направления окислительно-восстановительного процесса необходимо найти ЭДС гальванического элемента, образованного из данного окислителя и восстановителя. ЭДС (Е) равна:
![]() ,
,
если Е > 0, то реакция возможна.
Для данной системы стандартные потенциалы равны:

ЭДС положительна
для обратной реакции
![]() ,
т.е. в стандартных условиях будет идти
обратная реакция:
,
т.е. в стандартных условиях будет идти
обратная реакция:

293
Стандартные электродные потенциалы определяются измерением ЭДС при нормальных условиях между индикаторным электродом и электродом сравнения, потенциал которого хорошо известен.
Fe3+ + e = Fe2+ E0Ox = +0.77 B / 6
I- + 3H2O - 6e = IO3- + 6H+ E0Red = +1.09 B / 1
6Fe3+ + I- + 3H2O = IO3- + 6H+ + 6Fe2+
E = E0Ox - E0Red = 0.77 – 1.09 = -0.32 B
Пойдет обратная реакция.
№294
Исходя из значений стандартных потенциалов, определите, прямая или обратная реакция будет протекать в этой системе при стандартных условиях:
![]() .
.
Решение:
Для определения направления окислительно-восстановительного процесса необходимо найти ЭДС гальванического элемента, образованного из данного окислителя и восстановителя. ЭДС (Е) равна:
![]() ,
,
если Е > 0, то реакция возможна.
Для данной системы стандартные потенциалы равны:

ЭДС положительна
для обратной реакции
![]() ,
т.е. в стандартных условиях будет идти
обратная реакция:
,
т.е. в стандартных условиях будет идти
обратная реакция:

Стандартные электродные потенциалы определяются измерением ЭДС при нормальных условиях между индикаторным электродом и электродом сравнения, потенциал которого хорошо известен.
№296
Исходя из значений стандартных потенциалов, определите, прямая или обратная реакция будет протекать в этой системе при стандартных условиях:
![]() .
.
Решение:
Для определения направления окислительно-восстановительного процесса необходимо найти ЭДС гальванического элемента, образованного из данного окислителя и восстановителя. ЭДС (Е) равна:
![]() ,
,
если Е > 0, то реакция возможна.
Для данной системы стандартные потенциалы равны:

ЭДС положительна
для прямой реакции
![]() ,
т.е. в стандартных условиях будет идти
прямая реакция:
,
т.е. в стандартных условиях будет идти
прямая реакция:

297
Стандартные электродные потенциалы определяются измерением ЭДС при нормальных условиях между индикаторным электродом и электродом сравнения, потенциал которого хорошо известен.
MnO4- + 2H2O + 3e = MnO2 + 4OH- E0Ox = +0.59 B / 2
SO32- + 2OH- - 2e = SO42- + H2O E0Red = -0.93 B / 3
2MnO4- + 4H2O + 3SO32- + 6OH- = 3SO42- + 3H2O + 2MnO2 + 8OH-
2MnO4- + H2O + 3SO32- + = 3SO42- + 2MnO2 + 2OH-
E = E0Ox - E0Red = 0.59 – (- 0.93) = 1.52 B
Пойдет прямая реакция.
298
Стандартные электродные потенциалы определяются измерением ЭДС при нормальных условиях между индикаторным электродом и электродом сравнения, потенциал которого хорошо известен.
Fe3+ + e = Fe2+ E0Ox = +0.77 B / 6
2Сr3+ + 7H2O – 6e = Cr2O72- + 14H+ E0Red = +1.33 B / 1
2Сr3+ + 7H2O + 6Fe3+ = 6Fe2+ + Cr2O72- + 14H+
E = E0Ox - E0Red = 0.77 – 1.33 = -0.56 B
Пойдет обратная реакция.
фф299
Стандартные электродные потенциалы определяются измерением ЭДС при нормальных условиях между индикаторным электродом и электродом сравнения, потенциал которого хорошо известен.
MnO4- + 8H+ + 5e = Mn2+ + 4H2O E0Ox = +1.51 B / 5
H2O2 + 2H+ + 2e = 2Н2O E0Red = +1.77 B / 2
5MnO4- + 40H+ + 2H2O2 + 4H+ = 4Н2O + 5Mn2+ + 20H2O
5MnO4- + 44H+ + 2H2O2 = 24Н2O + 5Mn2+
Но такая система существовать не может, так как есть два окислителя, но нет восстановителя. Скорее всего в данном задании имеет место опечатка.
300
Стандартные электродные потенциалы определяются измерением ЭДС при нормальных условиях между индикаторным электродом и электродом сравнения, потенциал которого хорошо известен.
2ClO3- + 12H+ + 10e = Cl2 + 6H2O E0Ox = +1.47 B / 3
MnO2 + 2H2O - 3e = MnO4- + 4H+ E0Red = +1.69 B / 10
6ClO3- + 36H+ + 10MnO2 + 20H2O = 10MnO4- + 40H+ + 3Cl2 + 18H2O
6ClO3- + 10MnO2 + 2H2O = 10MnO4- + 4H+ + 3Cl2
E = E0Ox - E0Red = 1.47 – 1.69 = -0.22 B
Пойдет обратная реакция.
№ 301
Определите заряд комплексного иона, координационное число и степень окисления комплексообразователя в соединениях:


302
[Co(NH3)6](NO2)3 нитрит гексааминкобальта (III)
[Co(NH3)6](NO2)3 = [Co(NH3)6]3+ + 3NO2-
[Co(NH3)5(NO2)](NO2)2 нитрит нитритопентааминкобальта (III)
[Co(NH3)5(NO2)](NO2)2 = [Co(NH3)5(NO2)]2+ + 2NO2-
[Co(NH3)4(NO2)2](NO2) нитрит динитритотетраааминкобальта (III)
[Co(NH3)4(NO2)2](NO2) = [Co(NH3)4(NO2)2]+ + NO2-
[Co(NH3)3(NO2)3] тринитритотриаминкобальт (III)
неэлектролит
К [Co(NH3)2(NO2)4] калия тетранитритодиаминкобальтат (III)
К [Co(NH3)2(NO2)4] = К+ + [Co(NH3)2(NO2)4]-
К2 [Co(NH3)(NO2)5] калия пентанитритоаминкобальтат (III)
К2 [Co(NH3)(NO2)5] = 2К+ + [Co(NH3)(NO2)5]2-
К3 [Co(NO2)6] калия гексанитритокобальтат (III)
К3 [Co(NO2)6] = 3К+ + [Co(NO2)6]3-
303
[Pt(NH3)4]Cl2 = [Pt(NH3)4]2+ + 2Cl-
[PtCl(NH3)3]Cl = [PtCl(NH3)3]+ + Cl-
[PtCl2(NH3)2] неэлектролит
K [PtCl3(NH3)] = K+ + [PtCl3(NH3)]-
K2 [PtCl4] = 2K+ + [PtCl4]2-
304
[Co(NH3)4(H2O)2]Br3 = [Co(NH3)4(H2O)2]3+ + 3Br-
[Co(NH3)4Cl2]Cl = [Co(NH3)4Cl2]+ + Cl-
[Co(NH3)4(H2O)Cl]Cl2 = [Co(NH3)4(H2O)Cl]2+ + 2Cl-
K3 [Co(CN)6] = 3K+ + [Co(CN)6]3-
305
а) x = +1 [Pd(NH3)2(H2O)Cl]Cl = [Pd(NH3)2(H2O)Cl]+ + Cl-
б) x = -1 K[Co(NO2)4(NH3)2] = K+ + [Co(NH3)4(H2O)Cl]-
в) x = -2 K2 [PtCl(OH)5] = 2K+ + [PtCl(OH)5]2-
г) x = -1 K [Au(CN)2Br2] = K+ + [Au(CN)2Br2]-
306
Пусть х – степень окисления, N – координационное число.
Катионные комплексы:
[Co(NH3)6](NO2)3 нитрит гексааминкобальта (III)
x = +3 N = 6
[Pd(NH3)2(H2O)Cl]Cl хлорид хлораквадиаминпалладия (II)
x = +2 N = 4
Анионные комплексы:
К3 [Co(NO3)6] калия гексанитрокобальтат (III)
x = +3 N = 6
Na [Au(CN)4] натрия тетрацианоаурум (III)
x = +3 N = 4
Нейтральные комплексы:
[Co(NH3)3(NO2)3] тринитритотриаминкобальт (III)
x = +3 N = 6
[Fe(CO)5] карбонил железа
x = 0 N = 5
307
Константой нестойкости комплексного иона называется константа равновесия диссоциации его внутренней сферы.
[CuCl2]- = Cu+ + 2Cl-
K = [Cu+] · [Cl-]2 / [CuCl2]-
[Cu(NH3)4]2+ = Cu2+ + 4NH3
K = [Cu2+] · [NH3]4 / [Cu(NH3)4]2+
[Fe(CN)6]3- = Fe3+ + 6CN-
K = [Fe3+] · [CN]6 / [Fe(CN)6]3-
309
Растворимость иодида много меньше, чем хлорида. То есть, ион диаминсеребра более прочен, чем хлорид серебра. Однако, иодид серебра – более прочное соединение, чем данный комплексный ион.
AgNO3 + 2NH3 = [Ag(NH3)2]NO3
[Ag(NH3)2]NO3 + KI = AgI ↓ + 2NH3 + KNO3
310
Прочность комплекса возрастает с увеличением заряда центрального атома (x) и уменьшением степени окисления лиганда (y), то есть прямопропорциональна притяжению между частицами.
А) [Сo(NH3)6]2+ x = +2
[Сo(NH3)6]3+ x = +3 более прочен.
Б) [Fe(CN)6]3- x = +3 более прочен.
[Fe(CN)6]4- x = +2
B) [Cd(NH3)4]2+ y = 0
[Cd(CN)4]2- y = -1 более прочен.
311
Двойными солями называются соединения с малоустойчивой внутренней сферой, которые диссоциируют на простые ионы и молекулы.
K4 [Fe(CN)6] = 4K+ + [Fe(CN)6]4-
(NH4)2Fe(SO4)2 = 2NH4+ + Fe2+ + 2SO42-
Fe2+ + 2OH- = Fe(OH)2
(NH4)2Fe(SO4)2 + 2KOH = Fe(OH)2 ↓ + (NH4)2SO4 + K2SO4
311
Двойными солями называются соединения с малоустойчивой внутренней сферой, которые диссоциируют на простые ионы и молекулы.
K4 [Fe(CN)6] = 4K+ + [Fe(CN)6]4-
(NH4)2Fe(SO4)2 = 2NH4+ + Fe2+ + 2SO42-
Fe2+ + 2OH- = Fe(OH)2
(NH4)2Fe(SO4)2 + 2KOH = Fe(OH)2 ↓ + (NH4)2SO4 + K2SO4
312
[Ag(NH3)2]Сl → [Ag(NH3)2]+ + Cl-
[Ag(NH3)2]+ + 2H+ → 2NH4+ + Ag+
[Ag(NH3)2]Cl + 2HNO3 = AgCl ↓ + 2NH4NO3
Выпадение осадка и разрушение комплекса обусловлено образованием более прочного иона аммония, а появляющиеся в растворе ионы серебра мгновенно связываются хлорид-ионами.
313
Растворимость данного cульфида много меньше, чем гидроксида. То есть, ион тетрааминмеди более прочен, чем гидроксид меди. Однако, сульфид меди – более прочное соединение, чем данный комплексный ион.
[Сu(NH3)4]2+ + 2OH- ← Cu(OH)2 ↓ + 4NH3
[Сu(NH3)4]2+ + S2- → CuS ↓ + 4NH3
[Сu(NH3)4]SO4 + H2S → CuS ↓ + 2NH3 + (NH4)2SO4
314
AgI + 2KCN = K[Ag(CN)2] + KI
Значит данный комплексный ион имеет большее значение константы устойчивости, а константа нестойкости [Ag(CN)2]- меньше, чем у комплексного иона диаминсеребра.
316
Соли некоторых металлов, особенно в концентрированных растворах, способны образовывать аутокомплексы (cочетание молекул одного и того же вещества), за счет чего концентрация соответствующих катиона и аниона в растворе уменьшается. Например:
2СuCl2 = Cu[CuCl4]
3CdI2 = Cd[CdI3]2
Ацидокомплексы содержат во внутренней сфере анионы кислот и комплексный ион обыкновенно заряжен отрицательно. Например:
Na3[AlF6] = 3Na+ + [AlF6]3- гексафторалюминат натрия
K3[Fe(CN)6] = 3K+ + [Fe(CN)6]3- гексацианоферрат (III) калия
№ 317
Какие комплексные соединения называют изомерами? Приведите примеры гидратной, ионизационной и пространственной изомерии комплексных соединений.
Изомерия также характерна для координационных соединений. Так, изомерны соединения, различающиеся по способу координации лигандов (ионизационная изомерия), напр., изомерны
[Со(NН3)5Вг]+SО![]() ;
и [Со(NН3)5SО4]+Вг
;
и [Со(NН3)5SО4]+Вг![]() .
.
Здесь, по существу, имеется аналогия со структурной изомерией орг. соединений. Др. тип изомерии комплексных соед. обусловлен пространств, причинами (в приводимых ниже формулах аа - ацетилацетон):

318
|
3d |
4s |
4p |
|||||||
|
Cr |
↑ |
↑ |
↑ |
↑ |
↑ |
↑ |
|||
|
Cr * |
↑↓ |
↑↓ |
↑↓ |
||||||
Таким образом, происходит d2sp3 – гибридизация шести свободных орбиталей (октаэдрическое строение) возбужденного атома хрома на которые донируются электронные пары лигандов и координационное число по этому равно шести Сr(CO)6.
319
|
3d |
4s |
4p |
|||||||
|
Zn |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
|||
|
Zn2+ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
||||
Таким образом, происходит sp3 – гибридизация четырех свободных орбиталей (тетраэдрическое строение) иона цинка на которые донируются электронные пары лигандов и координационное число по этому равно четырем.
320
|
3d |
4s |
4p |
|||||||
|
Ni |
↑↓ |
↑↓ |
↑↓ |
↑ |
↑ |
↑↓ |
|||
|
Ni * |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
||||
Таким образом, происходит sp3 – гибридизация четырех свободных орбиталей (тетраэдрическое строение) возбужденного атома никеля на которые донируются электронные пары лигандов и координационное число по этому равно четырем.
321
|
3d |
4s |
4p |
|||||||
|
Fe |
↑↓ |
↑ |
↑ |
↑ |
↑ |
↑↓ |
|||
|
Fe * |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
|||||
Таким образом, происходит dsp3 – гибридизация пяти свободных орбиталей (строение тригональной бипирамиды) возбужденного атома железа на которые донируются электронные пары лигандов и координационное число по этому равно пяти Fe(CO)5.
322
|
2s |
2p |
|||
|
N |
↑↓ |
↑ |
↑ |
↑ |
|
B |
↑↓ |
↑ |
||
|
В * |
↑ |
↑ |
↑ |
|
В атоме азота три неспаренных 2р электрона, которые образуют связи с тремя атомами водорода. Для образования иона аммония требуется донирование 2s-электронной пары на свободную орбиталь иона водорода. Но, так как все четыре связи равноценны имеет место sp3-гибридизация.
В возбужденном атоме бора три неспаренных электрона, которые образуют связи с тремя атомами водорода. Для образования иона BH4- требуется донирование электронной пары гидрид-иона на свободную 2р-орбиталь BH3. Но, так как все четыре связи равноценны имеет место sp3-гибридизация, которой соответствует тетраэдрическое строение образующейся частицы.
Таким образом, происходит sp3 – гибридизация четырех свободных орбиталей (тетраэдрическое строение) возбужденного атома никеля на которые донируются электронные пары лигандов и координационное число по этому равно четырем.
№323
Какие орбитали
третьего ичетвертого энергетических
уровней хрома (III) принимают
участие в образовании химических связей
высокоспинового внешнеорбитального
парамагнитного комплексного иона
![]() ?
Как метод ВС объясняет октаэдрическое
строение этого иона?
?
Как метод ВС объясняет октаэдрическое
строение этого иона?
Теория метода ВС рассматривает образование комплексных ионов при донорно-акцепторном взаимодействии неподеленных электронных пар лигандов и свободн№323
Какие орбитали
третьего ичетвертого энергетических
уровней хрома (III) принимают
участие в образовании химических связей
высокоспинового внешнеорбитального
парамагнитного комплексного иона
![]() ?
Как метод ВС объясняет октаэдрическое
строение этого иона?
?
Как метод ВС объясняет октаэдрическое
строение этого иона?
Теория метода
ВС рассматривает образование комплексных
ионов при донорно-акцепторном
взаимодействии неподеленных электронных
пар лигандов и свободных орбиталей
комплексообразователя. Ион-
комплексообразователь
![]() в комплексном ионе
в комплексном ионе
![]() имеет электронную конфигурацию
имеет электронную конфигурацию
![]() .
В соответствии с правилом Хунда эти 3
электрона в d-состоянии
располагаются по энергетическим ячейкам
следующим образом:
.
В соответствии с правилом Хунда эти 3
электрона в d-состоянии
располагаются по энергетическим ячейкам
следующим образом:

Лиганды
комплексного иона – полярные молекулы
![]() .
Координационное число хрома в данном
ионе равно 6, .е. ион-комплексообразователь
присоединяет 6 лигандов. Атом кислорода
в молекуле
.
Координационное число хрома в данном
ионе равно 6, .е. ион-комплексообразователь
присоединяет 6 лигандов. Атом кислорода
в молекуле
![]() имеет неподеленные электронные пары,
являясь донором электронов. Для размещения
6 электронных пар шести лигандов
ион-комплексообразователь должен
предоставить 6 свободных орбиталей. Ион
имеет строение:
имеет неподеленные электронные пары,
являясь донором электронов. Для размещения
6 электронных пар шести лигандов
ион-комплексообразователь должен
предоставить 6 свободных орбиталей. Ион
имеет строение:
 №
325
№
325
Как метод ВС
объясняет строение молекулярного
комплекса
![]() и диамагнетизм
и диамагнетизм
![]()
Электронная
формула центрального иона
![]() .
Распределение электронов по энергетическим
ячекам:
.
Распределение электронов по энергетическим
ячекам:
![]()
При образовании
комплекса ион железа предоставляет
свободные орбитали для электронных пар
ионов
![]() .
Строение комплексного иона:
.
Строение комплексного иона:

Данный комплексный ион не содержит неспаренных электронов, поэтому данный комплексный ион – диамагнитный.
![]()
Электронная
формула бора
![]() ,
в возбужденном состоянии
,
в возбужденном состоянии
![]() Распределение электронов по энергетическим
ячейкам:
Распределение электронов по энергетическим
ячейкам:
![]()
При образовании
молекулы образуются 4
![]() гибридных орбитали, из них три образуют
гибридных орбитали, из них три образуют
![]() -связи
с атомами фтора, а на одной орбитали
находятся неспаренная пара электронов
атома азота. Строение комплекса:
-связи
с атомами фтора, а на одной орбитали
находятся неспаренная пара электронов
атома азота. Строение комплекса:

![]() -гибридизация
обусловливает тетраэдрическое строение
молекулы.
-гибридизация
обусловливает тетраэдрическое строение
молекулы.
При образовании
комплексного иона имеет место
![]() -гибридизация,
она осуществляется при участии внутренних
d-орбиталей третьего
энергетического уровня иона
-гибридизация,
она осуществляется при участии внутренних
d-орбиталей третьего
энергетического уровня иона
![]()
Наличие
неспаренных электронов в комплексных
ионах дает возможность определить иъх
магнитные свойства. В комплексном ионе
![]() 3 неспаренных электрона, поэтому он
парамагнитен.
3 неспаренных электрона, поэтому он
парамагнитен.
![]() -гибридизации
соответсвует окиаэдрическое строение.
-гибридизации
соответсвует окиаэдрическое строение.
ых орбиталей
комплексообразователя. Ион-
комплексообразователь
![]() в комплексном ионе
в комплексном ионе
![]() имеет электронную конфигурацию
имеет электронную конфигурацию
![]() .
В соответствии с правилом Хунда эти 3
электрона в d-состоянии
располагаются по энергетическим ячейкам
следующим образом:
.
В соответствии с правилом Хунда эти 3
электрона в d-состоянии
располагаются по энергетическим ячейкам
следующим образом:

Лиганды
комплексного иона – полярные молекулы
![]() .
Координационное число хрома в данном
ионе равно 6, .е. ион-комплексообразователь
присоединяет 6 лигандов. Атом кислорода
в молекуле
.
Координационное число хрома в данном
ионе равно 6, .е. ион-комплексообразователь
присоединяет 6 лигандов. Атом кислорода
в молекуле
![]() имеет неподеленные электронные пары,
являясь донором электронов. Для размещения
6 электронных пар шести лигандов
ион-комплексообразователь должен
предоставить 6 свободных орбиталей. Ион
имеет строение:
имеет неподеленные электронные пары,
являясь донором электронов. Для размещения
6 электронных пар шести лигандов
ион-комплексообразователь должен
предоставить 6 свободных орбиталей. Ион
имеет строение:

При образовании
комплексного иона имеет место
![]() -гибридизация,
она осуществляется при участии внутренних
d-орбиталей третьего
энергетического уровня иона
-гибридизация,
она осуществляется при участии внутренних
d-орбиталей третьего
энергетического уровня иона
![]()
Наличие
неспаренных электронов в комплексных
ионах дает возможность определить иъх
магнитные свойства. В комплексном ионе
![]() 3 неспаренных электрона, поэтому он
парамагнитен.
3 неспаренных электрона, поэтому он
парамагнитен.
![]() -гибридизации
соответсвует окиаэдрическое строение.
-гибридизации
соответсвует окиаэдрическое строение.
326
|
3d |
4s |
4p |
|||||||
|
Co |
↑↓ |
↑↓ |
↑ |
↑ |
↑ |
↑↓ |
|||
|
Co3+ |
↑↓ |
↑ |
↑ |
↑ |
↑ |
||||
|
Co3+ * |
↑↓ |
↑↓ |
↑↓ |
||||||
Таким образом, происходит d2sp3 – гибридизация шести свободных орбиталей возбужденного иона кобальта на которые донируются электронные пары лигандов. Данному типу гибридизации соответствует октаэдрическое строение.
327
|
3d |
4s |
4p |
|||||||
|
Ni |
↑↓ |
↑↓ |
↑↓ |
↑ |
↑ |
↑↓ |
|||
|
Ni2+ |
↑↓ |
↑↓ |
↑↓ |
↑ |
↑ |
||||
|
Ni2+ * |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
|||||
Из строения комплексного иона делаем вывод, что занято электронными парами монодентатных лигандов четыре орбитали Ni2+ *.
Таким образом, происходит dsp2 – гибридизация четырех из пяти свободных орбиталей (квадратно-плоское строение) возбужденного атома никеля на которые донируются электронные пары лигандов и координационное число по этому равно четырем.
№328
Какие орбитали
внешнего энергетического уровня никеля
(II) гибридизуются при
образовании комплексного иона
![]() .
Известно, что этот ион парамагнитен и
содержит два неспаренных электрона.
Какую пространственную конфигурацию
имеет этот ион?
.
Известно, что этот ион парамагнитен и
содержит два неспаренных электрона.
Какую пространственную конфигурацию
имеет этот ион?
Теория
метода ВС рассматривает образование
комплексных ионов при донорно-акцепторном
взаимодействии неподеленных электронных
пар лигандов и свободных орбиталей
комплексообразователя! Ион-комплексообразователь
![]() в этих комплексных ионах имеет электронную
конфигурацию
в этих комплексных ионах имеет электронную
конфигурацию
![]() .
В соответствии с правилом Хунда эти
8 электронов в d-состоянии
располагаются по энергетическим ячейкам
следующим образом:
.
В соответствии с правилом Хунда эти
8 электронов в d-состоянии
располагаются по энергетическим ячейкам
следующим образом:

Лиганды
комплексного иона — полярные ионы
![]() .
Координационное число
.
Координационное число
![]() в данных ионах равно 4, т. е.
ион-комплексообразователь присоединяет
четыре лиганда. Каждый из лигандов
имеет неподеленную электронную пару,
являясь донором электронов. Для размещения
4 электронных пар четырех лигандов
ион-комплексообразователь
в данных ионах равно 4, т. е.
ион-комплексообразователь присоединяет
четыре лиганда. Каждый из лигандов
имеет неподеленную электронную пару,
являясь донором электронов. Для размещения
4 электронных пар четырех лигандов
ион-комплексообразователь
![]() (акцептор электронов) должен предоставить
четыре свободных орбитали. Четыре
неподеленные электронные пары ионов
хлора располагаются в свободных s-,
р-орбиталях четвертого энергетического
уровня. Комплексный ион
(акцептор электронов) должен предоставить
четыре свободных орбитали. Четыре
неподеленные электронные пары ионов
хлора располагаются в свободных s-,
р-орбиталях четвертого энергетического
уровня. Комплексный ион
![]() имеет строение:
имеет строение:

Этот
комплексный ион образуется при
![]() -гибридизации,
в образовании этого нона участвуют s-,
р -орбитали иона
-гибридизации,
в образовании этого нона участвуют s-,
р -орбитали иона
![]() четвертого -энергетического уровня
(внешнего). Эти ионы имеют тетраэдрическую
структуру. Наличие неспаренных электронов
в комплексном ионе дает возможность
определить их магнитные свойства:
комплексный ион
четвертого -энергетического уровня
(внешнего). Эти ионы имеют тетраэдрическую
структуру. Наличие неспаренных электронов
в комплексном ионе дает возможность
определить их магнитные свойства:
комплексный ион
![]() ,
содержит два
неспаренных электрона, парамагнитен.
,
содержит два
неспаренных электрона, парамагнитен.
№329
Какие орбитали
внешнего энергетического уровня кобальта
(III) гибридизуются при
образованиии комплексного иона
![]() ?
Известно, что этот внутриорбитальный,
низкоспиновый ион диамагнитен и не
содержит неспаренных электронов.
?
Известно, что этот внутриорбитальный,
низкоспиновый ион диамагнитен и не
содержит неспаренных электронов.
Теория
метода ВС рассматривает образование
комплексных ионов при донорно-акцепторном
взаимодействии неподеленных электронных
пар лигандов и свободных орбиталей
комплексообразователя! Ион-комплексообразователь
![]() в этих комплексных ионах имеет электронную
конфигурацию
в этих комплексных ионах имеет электронную
конфигурацию
![]() .
В соответствии с правилом Хунда эти
шесть электронов в d-состоянии
располагаются по энергетическим ячейкам
следующим образом^
.
В соответствии с правилом Хунда эти
шесть электронов в d-состоянии
располагаются по энергетическим ячейкам
следующим образом^

Лиганды
комплексного иона — полярные ионы
![]() .
Координационное число Со3+
в данных ионах равно 6, т. е.
ион-комплексообразователь присоединяет
шесть лигандов. Каждый из лигандов
имеет неподеленную электронную пару,
являясь донором электронов. Для размещения
шести электронных пар шести лигандов
ион-комплексообразователь Со3+
(акцептор электронов) должен предоставить
шесть свободных орбиталей. Шесть
неподеленных электронных ионов фтора
располагаются в свободных s-,
р-, d-орбиталях четвертого энергетического
уровня. Комплексный ион
.
Координационное число Со3+
в данных ионах равно 6, т. е.
ион-комплексообразователь присоединяет
шесть лигандов. Каждый из лигандов
имеет неподеленную электронную пару,
являясь донором электронов. Для размещения
шести электронных пар шести лигандов
ион-комплексообразователь Со3+
(акцептор электронов) должен предоставить
шесть свободных орбиталей. Шесть
неподеленных электронных ионов фтора
располагаются в свободных s-,
р-, d-орбиталях четвертого энергетического
уровня. Комплексный ион
![]() имеет строение:
имеет строение:

Этот
комплексный ион образуется при
![]() -гибридизации,
в образовании этого нона участвуют
-гибридизации,
в образовании этого нона участвуют
![]() -орбитали
иона Со3+
четвер-энергетического уровня
(внешнего). Эти ионы имеют октаэдрическую
структуру. Наличие неспаренных электронов
в комплексномных ионе дает возможность
определить их магнитные свойства:
комплексный ион [СоF6]3
+
, содержит четыре
неспаренных электрона, парамагнитен.
С помощью метода ВС можно, предсказать
реакционную способность комплексных
соединений.
-орбитали
иона Со3+
четвер-энергетического уровня
(внешнего). Эти ионы имеют октаэдрическую
структуру. Наличие неспаренных электронов
в комплексномных ионе дает возможность
определить их магнитные свойства:
комплексный ион [СоF6]3
+
, содержит четыре
неспаренных электрона, парамагнитен.
С помощью метода ВС можно, предсказать
реакционную способность комплексных
соединений.
330
|
3d |
4s |
4p |
|||||||
|
Co |
↑↓ |
↑↓ |
↑ |
↑ |
↑ |
↑↓ |
|||
|
Co3+ |
↑ |
↑ |
↑ |
↑ |
↑ |
↑ |
|||
|
Co3+ * |
↑↓ |
↑↓ |
↑↓ |
||||||
Таким образом, происходит sp3d2 – гибридизация шести свободных орбиталей возбужденного иона кобальта на которые донируются электронные пары лигандов.
331
Натрий может быть только восстановителем.
Na – e = Na+
2Na + H2 = 2NaH гидрид натрия H2 + 2e = 2H-
NaH + H2O = NaOH + H2
2Na + O2 = Na2O2 пероксид натрия О2 + 2e = О22-
Na2O2 + 2H2O = 2NaOH + H2О2
2Na + S = Na2S сульфид натрия S + 2e = S2-
Na2S + 2H2O = 2NaOH + H2S
C азотом натрий не реагирует.
№ 333
Напишите уравнения реакций, лежащих в основе получения соды по аммиачному способу. Можно ли таким путем получить поташ? Почему?
![]()
335
Поташ или карбонат калия применяется при производстве мыла, при изготовлении туговлавкого стекла, в фотографии и т.д. Поташ получают действием двуокиси углерода на раствор едкого кали, образующийся при электролизе раствора хлористого калия:
KOH + CO2 = KHCO3
KHCO3 + KOH = K2CO3 + H2O
K2SO4 + Ba(OH)2 = BaSO4 ↓ + 2KOH
CaCO3 + 2HCl = CaCl2 + H2O + CO2 ↑
2KOH + CO2 = K2CO3 + H2O
336
Кислород в пероксиде натрия имеет степень окисления равную –1. Данная процесс относится к реакциям диспропорционирования:
O22- + 2e = 2O2-
O22- - 2e = O2
2Na2O2 + 2CO2 → 2Na2CO3 + O2
Эта реакция очень полезна, так как одновременно поглощается углекислый газ и выделяется кислород.
№337
При высокой
температуре щелочные металлы
восстанавливают соли кислородсодержащих
кислот. Напишите электронные и молекулярное
уравнение реакции, происходящей при
сплавлении калия с
![]() .
Окислитель в этой реакции восстанавливается
максимально.
.
Окислитель в этой реакции восстанавливается
максимально.

№338
Озонид калия
образуется при действии озона на твердый
КОН. Составьте электронно-ионные и
молекулярные уравнения этой реакции.
Озон, окисляя гидроксид-ион, восстанавливается
до озонид-иона
![]() .
.

339
Be + 2HCl → BeCl2 + H2
BeCl2 + 2NaOH → Be(OH)2 ↓ + 2NaCl
Be(OH)2 + 2NaOH → Na2[Be(OH)4]
Na2[Be(OH)4] + Na2SO4 → BeSO4 ↓ + 4NaOH
341
Из компонентов воздуха кальций взаимодействует при нагревании с кислородом и азотом:
2Сa + O2 → 2CaO
3Ca + N2 → Ca3N2
Продукты взаимодействуют с водой:
CaO + H2O → Ca(OH)2 + Q
Сa3N2 + 6H2O → 3Ca(OH)2 + 2NH3
342
Ca + H2 = CaH2
CaH2 + 2H2O → Ca(OH)2 + 2H2
Ca(OH)2 + CO2 → CaCO3 ↓ + H2O
CaCO3 + H2O + CO2 → Ca(HCO3)2 ↓
Ca(HCO3)2 + 2HCl → CaCl2 + 2H2O + 2CO2 ↑
CaCl2 + 2HNO3 → Ca(NO3)2 + 2HCl ↑
№343
Оксид бериллия
при сплавлении взаимодействует с
![]() и
и
![]() .
Напишите уравнения соответствующих
реакций. О каких свойствах
.
Напишите уравнения соответствующих
реакций. О каких свойствах
![]() говорят эти реакции?
говорят эти реакции?
Оксид бериллия – амфотерный. Основные свойства оксида проявляются при взаимодействии с кислотными оксидами:
![]()
Кислотные свойства проявляются при взаимодействии с основными оксидами:
![]()
344
Сa – 2e = Ca2+ / 1
C + e = C- / 2
Ca + 2C = CaC2 – Q
CaC2 + 2H2O → Ca(OH)2 + C2H2
Be – 2e = Be2+ / 4 / 2
C + 4e = C4- / 2 / 1
2Be + C = Be2C – Q
Be2C + 4H2O → 2Be(OH)2 + CH4
№345
Являясь сильными восстановителями, магний, кальций и барий применяются в металлотермии для получения металлов из их оксидов. Составьте электронные и молекулярные уравнения реакций кальция:
А) с
![]() ;
;
Б) с
![]() .
.
В каждой из этих реакций окислитель восстанавливается максимально.
А)

б)

№346
Присутствие
каких солей обусловливает жесткость
природной воды? Рассчитайте, сколько
граммов
![]() содержится в 1
содержится в 1![]() водя, жесткость которой равна 3мэкв.
водя, жесткость которой равна 3мэкв.
Жесткость
воды – совокупность свойств, обусловленных
содержанием в воде ионов кальция
![]() и магния
и магния
![]() .
.

347
mэ (Сa(HCO3)2) = M · f = 162 · ½ = 81 г
1 мэкв -------- 81 мг
X ------------ 100 мг
Х = 100 / 81 = 1.235 мэкв Сa(HCO3)2
mэ (Mg(HCO3)2) = M · f = 146 · ½ = 73 г
1 мэкв -------- 73 мг
X ------------ 100 мг
Х = 100 / 73 = 1.370 мэкв Mg(HCO3)2
mэ (Fe(HCO3)2) = M · f = 178 · ½ = 89 г
1 мэкв -------- 89 мг
X ------------ 100 мг
Х = 100 / 89 = 1.124 мэкв Fe(HCO3)2
Таким образом общая карбонатная жесткость равна:
1.234 + 1.370 + 1.124 = 1.728 мэкв / л
348
Жесткость воды измеряется суммарным количеством эквивалентов солей растворенных в единице объема. Единица измерения (мэкв / л).
mэ (СaСl2) = M · f = 111 · ½ = 55.5 г
1 мэкв -------- 55.5 мг
X ------------ 6000 мг
Х = 6000 / 55.5 = 108.11 мэкв СaCl2
Таким образом жесткость равна:
G = 108.11 / 10 = 10.81 мэкв / л
№ 349
Чему равна жесткость воды, если для ее устранения к 100 л воды потребовалось прибавить 15,9 г соды?

350
2,5 мэкв содержится в 1 литре
ν =========== 5000 л
ν = 2,5 · 5000 = 12500 мэкв = 12,5 экв
По закону эквивалентов соды понадобится столькоже:
Масса эквивалента соды Na2CO3 равна mэ = 106 / 2 = 53 г / экв.
M = mэ · ν = 53 · 12,5 = 662,5 г.
352
Сущность ионитного способа устранения жесткости воды состоит в способности некоторых алюмосиликатов типа Na2Al2Si2O8 · nH2O обменивать входящие в их состав ионы натрия на содержащиеся в воде ионы кальция и магния и таким образом уводить последние из раствора.
Сa(HCO3)2
f = ½ фактор эквивалентности
Э = ν / f = 0.005 / ½ = 0.010 экв = 10 мэкв / л.
№354
Минеральная вода содержит 0,3894г/л ионов кальция и 0,0844г /л ионов магния. Какова жесткость этой воды?
Решение:
Вычислим эквивалентную концентрацию ионов:
![]() н
н
![]() н
н
Жесткость воды равна:
![]()
№353
Чему равна жесткость воды, в 100л которой содержится 14,632г гидрокарбоната магния?
Решение:

ф№ 355
Какие
химические реакции произойдут при
кипячении жесткой воды, содержащей
гидрокарбонат кальция, и при добавлении
к ней: а) соды; б) гидроксида натрия?
Вычислите жесткость воды, зная, что для
ее устранения пришлось к 50 л воды
прибавить 10,8 г безводной буры
![]() ;.
Ответ: 2.14
мэкв/л.
;.
Ответ: 2.14
мэкв/л.
а№353
Чему равна жесткость воды, в 100л которой содержится 14,632г гидрокарбоната магния?
Решение:
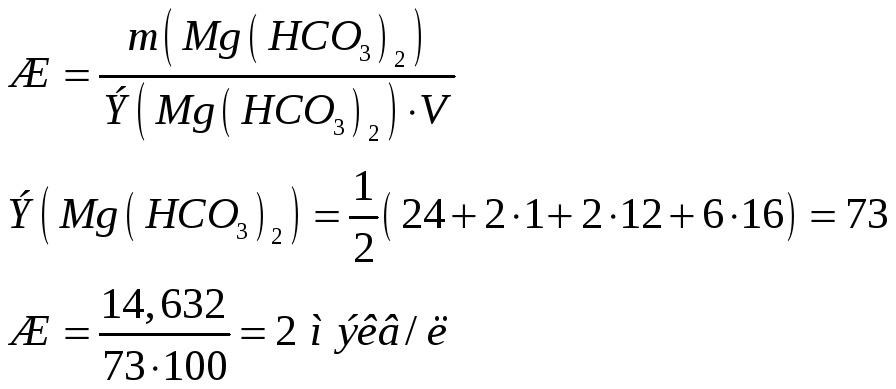
№354
Минеральная вода содержит 0,3894г/л ионов кальция и 0,0844г /л ионов магния. Какова жесткость этой воды?
Решение:
Вычислим эквивалентную концентрацию ионов:
![]() н
н
![]() н
н
Жесткость воды равна:
![]()
№ 355
Какие
химические реакции произойдут при
кипячении жесткой воды, содержащей
гидрокарбонат кальция, и при добавлении
к ней: а) соды; б) гидроксида натрия?
Вычислите жесткость воды, зная, что для
ее устранения пришлось к 50 л воды
прибавить 10,8 г безводной буры
![]() ;.
Ответ: 2.14
мэкв/л.
;.
Ответ: 2.14
мэкв/л.
а)
![]()
б)

№358
Определите
временную жесткость воды, если на
титрование 0,1л ее израсходовано 0,0072л
0,13н
![]() .
.
Решение:
При титровании воды соляной кислотой происходит химическая реакция:
![]()
В соответствии
с законом эквивалентов количество
эквивалентов всех участвующих в
химической реакции веществ должно быть
одинаково. На титрование 0,1л воды
израсходовано
![]() моль
моль
![]() .
Следовательно, такое же количество
ионов магния содержится в воде, т.е.
.
Следовательно, такое же количество
ионов магния содержится в воде, т.е.

359
Сa(HCO3)2 + 2HCl → CaCl2 + 2CO2 + 2H2O
2HCO3- + 2H+ → 2CO2 + 2H2O
Э = N · V = 0.101 · 0.00525 = 5.30 · 10-4 экв
Ж = Э / Vводы = 5.30 · 10-4 / 0.1 = 5.30 · 10-3 экв = 5.30 мэкв.
360
3.18 мэкв содержится в 1 литре
ν =========== 1000 л
ν = 3.18 · 1000 = 3180 мэкв = 3.18 экв
По закону эквивалентов соли понадобится столькоже:
Масса эквивалента Na3РO4 равна mэ = 164 / 3 = 54.67 г / экв.
m = mэ · ν = 54.67 · 3.18 = 173.84 г Na3РO4
)
![]()
б)

№362
Метаборат можно получить растворением аморфного бора в концентрированном растворе щелочи или взаимодействием его со щелочным раствором пероксида водорода. Составьте электронные и молекулярные уравнения соответствующих реакций.
Получение метабората при взаимодействии оксида бора со щелочью. Степени окисления в реакции не изменяются.
![]()

364
Al – 3e = Al3+ / 6 / 2
N2 + 6e = 2N3- / 3 / 1
2Al + N2 → AlN
AlN + 3H2O → Al(OH)3 + NH3
Al – 3e = Al3+ / 2
S + 2e = S2- / 3
2Al + 3S → Al2S3
Al2S3 + 6H2O → 2Al(OH)3 + 3H2S
Al – 3e = Al3+ / 4
C + 4e = C4- / 3
4Al + 3C → Al4C3
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4
№ 365
Тетрафтороборная
кислота в свободном виде не получена.
Она устойчива только в водных растворах.
Составьте уравнения реакций получения
этой кислоты: а) при гидролизе
![]() ;
б) исходя из
;
б) исходя из
![]() .
.
![]()
366
B – 3e = B3+ / 1
N5+ + e → N4+ / 3
B + 3HNO3 → H3BO3 + 3NO2
Al – 3e = Al3+ / 2
2H+ + 2e → H2 / 3
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
№367
Для очистки
боксита
![]() от примеси
от примеси
![]() боксит сплавляют с
боксит сплавляют с
![]() ,
обрабатывают сплав водой, фильтруют
полученный раствор и пропускают через
него
,
обрабатывают сплав водой, фильтруют
полученный раствор и пропускают через
него
![]() .
Образовавшийся осадок отфильтровывают
и прокаливают. Напишите уравнения всех
происходящих реакций и укажите, в какой
стадии процесса идет отделение
.
Образовавшийся осадок отфильтровывают
и прокаливают. Напишите уравнения всех
происходящих реакций и укажите, в какой
стадии процесса идет отделение
![]() .
.
Сплавление
с
![]()
![]()
при сплавлении образуются алюминат и феррит натрия.
при обработке водой феррит натрия разрушается
![]()
при фильтрации раствора отделяют осадок гидроксида железа (III)
реакция
алюмината натрия с
![]()
![]()
осадок гидроксида алюминия отфильтровывают.
прокаливание гидроксида алюминия
![]()
369
Для таллия более характерна степень окисления +1, а соли таллия (III) являются сильными окислителями, поэтому происходит окисление сероводорода вероятнее всего до свободной серы.
Tl3+ + 2e = Tl+ / 2 / 1
S2- + 2e → S / 2 / 1
2TlСl3 + 3H2S → Tl2S ↓ + 6HCl + 2S
Возможно также, что образующийся вначале сульфид талия (III) вступает в реакцию внутримолекулярного самоокисления-самовосстановления.
№ 370
Какая степень окисления наиболее характерна для солей галлия? Почему при растворении в воде хлорида галлия (II) выделяется водород? Составьте уравнение соответствующей реакции.
Для солей Ga наиболее характерна степень окисления +3

371
Tl – 3e = Tl3+ / 1
N5+ + e → N4+ / 3
Tl + 6HNO3 → Tl(NO3)3 + 3NO2 + 3H2O
Tl+ – 2e = Tl3+ / 5 / 10
Mn7+ + 5e → Mn2+ / 2 / 4
5Tl2SO4 + 4KMnO4 + 16H2SO4 → 5Tl2(SO4)3 + 4MnSO4 + 2K2SO4 + 16H2O
№373
При взаимодействии галлия и его гидроксида с растворами щелочей образуются гидрокомплексы галлия (III). Закончите уравнения реакций:


374
2Al + 3F2 → 2AlF3
AlF3 + 3NaF → Na3[AlF6]
Al(OH)3 + 6HF → H3[AlF6] + 3H2O
2H3[AlF6] + 3Na2CO3 → 2Na3[AlF6] + 3H2O + 3CO2
375
4Ga + 3O2 → 2Ga2O3
Ga2O3 + 6HCl → 2GaCl3 + 3H2O
GaCl3 + 4LiH = Li[GaH4] + 3LiCl в неводных средах.
Li[GaH4] + 4H2O → Ga(OH)3 + LiOH + 4H2
Ga(OH)3 + 3KOH → K3[Ga(OH)6]
376
C- - 5e = C4+ / 2 восстановитель
2H+ + 2e = H2 / 5 окислитель
CaC2 + 5H2O → CaCO3 + CO2 + 5H2
Тогда как в обычных условиях реакция протекает как вытеснение сильной кислотой (водой) слабой кислоты (ацетилена) из её соли:
СaC2 + 2H2O → Ca(OH)2 + C2H2
377
Карбиды – соединения металлов (и некоторых неметаллов) с углеродом, нерастворимые без разложения ни в одном известном растворителе. По характеру связей и кристаллической структуре делятся на 4 группы: солеобразные (СaC2, Al4C3); с ковалентной связью (SiC, B4C); фазы внедрения (TiC, Mo2C); типа Fe3C (Mn3C, Co3C). Карбиды получают прокаливанием смеси металла или его оксида с углем в инертной (Ar, He) или восстановительной (CO, H2) атмосфере.
Силициды – соединения металлов (и некоторых неметаллов) с кремнием. По характеру связей делятся на 2 группы: ионно-ковалентные (Mg2Si, Ca2Si) и металлоподобные (CoSi2, V3Si) . Силициды получают прокаливанием смеси металла или его оксида с кремнием в инертной (Ar, He) или восстановительной (CO, H2) атмосфере.
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4
Mg2Si + 4HCl → 2MgCl2 + SiH4
№378
Карбид кремния (карборунд) - химически стойкое вещество. Однако в присутствии кислорода он взаимодействует с расплавленными щелочами. Составьте электронные и молекулярное уравнения этого процесса, учитывая, что углерод приобретает максимальную степень окисления.

379
С + e = C- / 2
C – 2e = C2+ / 1
CaO + 3C = CaC2 + CO
С + 4e = C4- / 2 / 1
C – 2e = C2+ / 4 / 2
SiO2 + 3C = SiC + 2CO
Это реакции диспропорционирования.
380
Угарный газ получается при соприкосновении углекислого газа с раскаленным углем (обязательным условием является высокая температура, так как процесс равновесный эндотермический) или горении угля при недостатке кислорода:
СO2 + C = 2CO – Q
2C + O2 = 2CO
Окись углерода применяется в металлургии как хороший восстановитель металлов из их окислов при повышенных температурах, например:
СuO + CO → Cu + CO2
СО соединяется на свету с хлором и образуется фосген, а взаимодействием с аммиаком можно получить мочевину (карбамид):
СO + Cl2 → COCl2
CO + NH3 → CO(NH2)2 + H2
№ 381
Какую степень окисления имеет углерод в цианистой кислоте и цианидах? Цианид натрия можно получить при восстановлении соды углеродом в присутствии аммиака. Составьте электронные и молекулярное уравнения этой реакции.
В цианистой кислоте и цианидах С имеет степень окисления +2

382
Хлористый кремний получается нагреванием смеси двуокиси кремния с углем в струе хлора
SiO2 + 2C + 2Cl2 → SiCl4 + 2CO
Или хлорированием технического кремния
Si + 2Cl2 → SiCl4.
При высоких температурах в получается нитрид:
3Si + 2N2 → Si3N4
Галиды кремния дымят во влажном воздухе вследствии ярко выраженного гидролиза:
SiCl4 + 3H2O → H2SiO3 + 4HCl
№383
Роданид калия
![]() можно получить:
можно получить:
А) при взаимодействии цианида калия с дисульфидом аммония;
Б) при кипячении его раствора с серой. Отразите в электронных уравнениях изменение степени окисления углерода и серы в этих реакциях и напишите их уравнения.
А) реакция цианида калия с дисульфидом аммония

б) реакция цианида калия с серой

384
Si + 2KOH + H2O → K2SiO3 + 2H2
K2SiO3 + 2H2O = H2SiO3 + 2KOH
SiH4 + 2O2 → SiO2 + 2H2O
№ 385
Каков состав обычного силикатного стекла? Какие вещества исходные для его получения? Напишите уравнение реакции, лежащие; в основе получения стекла. За счет чего стеклу придают различную окраску?
Для оксосиликатов, как и для SiO2, очень характерно стеклообразное состояние. Обычное стекло получают сплавлением смеси соды (или Na2SO4), известняка и кварцевого песка. При этом образуется стекло приблизительного состава NazO • СаО • 6SiO2, состоящее из больших полимерных анионов; оно нерастворимо, химически неактивно. Обыкновенное стекло в той или иной степени окрашено в зеленый цвет содержащимися в нем силикатами железа.
Для придания стеклу тех или иных физико-химических свойств (прозрачности, химической, термической и механической прочности и пр.) вводятся соответствующие добавки, изменяющие состав и структуру стекол. Так, у стекла, содержащего вместо натрия калий (калиевое стекло), температура размягчения выше, чем у обычного натриевого стекла, поэтому оно используется для изготовления специальных лабораторных приборов. Замена кальция на свинец, а натрия на калий придает стеклу повышенный показатель преломления, большую плотность. Из свинцового стекла (хрусталя) изготовляют вазы, фужеры и пр. Добавление к стеклу соединений кобальта придает им синюю окраску, Сг2О3 — изумрудно-зеленую, соединений марганца — фиолетовую окраску и т. д. Существенно изменяются свойства стекол, содержащих В2О3.
Стекло химически очень стойко, но хрупко, что препятствует широкому применению его для изготовления труб и аппаратуры химических производств. В последнее время прочность стекол повышают, придавая им мелкокристаллическую структуру. В результате управляемой кристаллизации расплавленных стекол удается получить очень мелкокристаллические однородные материалы — ситаллы (стеклокристал-лы), прочность которых иногда более чем в 5 раз превышает прочность исходных стекол и приближается к прочности чугуна.
386
СS2 + NaOH → NaHCOS2 кислая натриевая соль дитиоугольной кислоты
СS2 + 3O2 → CO2 + 2SO2
CS2 + K2S → K2CS3 тиокарбонат калия
COCl2 + 2H2O → 2HCl + H2O + CO2
387
SiO2 + 2C → 2CO + Si
2Mg + Si → Mg2Si
Mg2Si + 4HCl → 2MgCl2 + SiH4
SiH4 + 2O2 → 2H2O + SiO2
SiO2 + 2NaOH → Na2SiO3 + H2O сплавление
Na2SiO3 + 2HCl → H2SiO3 + 2NaCl
№388
Углерод восстанавливает концентрированную серную кислоту и серу при высокой температуре. Какие вещества при этом получаются? Составьте электронные и молекулярные уравнения соответствующих реакций.


390
Mg + CO2 = MgO + CO
3Si + 4HNO3 + 18HF → 3H2SiF6 + 4NO↑ + 8H2O
SiH4 + 2NaOH + H2O → Na2SiO3 + 4H2 гидролиз в щелочной среде.
Na2CO3 + SiO2 → K2SiO3 + CO2 сплавление.
391
Это смешанные оксиды свинца (II) и свинца (IV):
Pb2O3 = PbO · PbO2 как свинцовая соль метасвинцовой кислоты
O
/ \
Pb Pb = O
\ /
O
Pb3O4 = 2PbO · PbO2 cурик, как свинцовая соль ортосвинцовой кислоты
O O
/ \ / \
Pb Pb Pb
\ / \ /
O O
Pb3O4 + 4HNO3 → 2Pb(NO3)2 + PbO2 + 2H2O
Pb2O3 + 2KI + 3H2SO4 → 2PbSO4 + I2 + K2SO4 + 3H2O
393
Для этих элементов более характерна степень окисления +4, поэтому соединения свинца (II) легко окисляются.
Sn2+ - 2e = Sn4+ / 1
Hg2+ + e = Hg+ / 2
SnCl2 + 2HgCl2 → Hg2Cl2 + SnCl4
Sn2+ - 2e = Sn4+ / 2
As5+ + 2e = As3+ / 2
2SnCl2 + 2Na3AsO4 + 10HCl → As2O3 + 2SnCl4 + 6NaCl + 5H2O
Sn2+ - 2e = Sn4+ / 1
Bi5+ + 2e = Bi3+ / 1
SnCl2 + NaBiO3 + 4HCl → (BiO)Cl + SnCl4 + NaCl + 2H2O
395
У германия слабо выражены металлические свойства и он является слабым восстановителем. В разбавленной серной кислоте окислительную функцию выполняют протоны, а они не могут отнимать электроны у германия, так как соответствующие стандартные электродные потенциалы данных систем равны (0.00 В).
Но в концентрированной серной кислоте такую функцию выполняет сульфат-ион, котрый является много более сильным окислителем:
Ge + 2H2SO4 = GeO2 + 2SO2 + 2H2O.
В растворах щелочей германий растворяется с образованием германатов:
Ge + 2NaOH + 4H2O = Na2[Ge(OH)6] + 2H2
396
2SnO2 + 2Na2CO3 + 9S → 2Na2SnS3 + 3SO2 + 2CO2
S + 2e = S2- / 2 / 6
S - 4e = S4+ / 1 / 3
Это процесс диспропорционирования.
№397
Ортоплюмбат свинца (сурик) образуется при сплавлении его оксида (II) и (IY). Какие свойства проявляют эти оксиды в данной реакции? Допишите уравнения реакций:
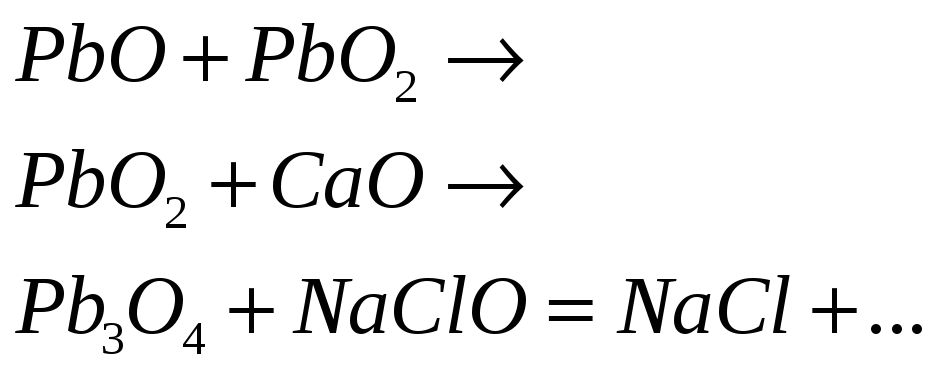
![]()
Данная реакция не является окислительно-восстановительной, поскольку сурик – смешанный оксид.
![]()

398
Указанные соединения обладают амфотерными свойствами, то есть реагируют как с кислотами, так и с основаниями.
PbO + 2NaOH → Na2PbO2 + H2O
Pb(OH)2 + 2HCl → PbCl2 + 2H2O
Na2PbO2 + 2HCl → H2PbO2 + 2NaCl
Na2PbO2 + 4HCl → PbCl2 + 2NaCl + 2H2O
399
Для свинца характерна степень окисления +2, так как наиболее легко этот атом отдает два имеющихся 6р-электрона .
Pb2+ - 2e = Pb4+ / 1
Cl+ + 2e = Cl- / 1
PbO + СaOCl2 → PbO2 + CaCl2
Pb2+ - 2e = Pb4+ / 1
Cl2 + 2e = 2Cl- / 1
Pb(CH3COO)2 + Cl2 + 4NaOH → Pb(OH)4 + 2CH3COONa + 2NaCl
Pb2+ - 2e = Pb4+ / 1
Cl+ + 2e = Cl- / 1
Pb(NO3)2 + NaClO + 2NaOH + H2O → Pb(OH)4 + NaCl + 2NaNO3
№ 400
