
- •Звездочкой обозначены разрыхляющие молекулярные орбитали. Для молекулы f2:
- •Таким образом, более высокая энергия связи объясняется более высоким её порядком.
- •Звездочкой обозначены разрыхляющие молекулярные орбитали. Для молекулы о2:
- •Таким образом, более высокая энергия связи объясняется более высоким её порядком.
- •Звездочкой обозначены разрыхляющие молекулярные орбитали. Для молекулы о2:
- •Восстановительные свойства могут проявлять катионы ванадия и хрома, так как они находятся в промежуточной степени окисления
- •Чем отличается взаимодействие германия и свинца с концентрированной азотной кислотой? Почему? Составьте электронные и молекулярные уравнения реакций:
- •Составьте электронные и молекулярные уравнения реакций:
- •Составьте электронные и молекулярные уравнения реакций:
- •Кислород в перекиси водорода имеет промежуточную степень окисления –1.
- •Вследствие несимметричности распределения связей о – н, Ме – о молекулы пероксидов сильно полярны. Пероксид – радикал может, не изменяясь переходить из соединения в соединение:
- •Закончите уравнения реакций:
- •Приведенные реакции относятся к реакциям внутримолекулярного окисления-восстановления.
- •Сера способна как окислятся, так и восстанавливаться, ввиду того, что нулевая степень окисления является промежуточной.
Нет, так как значение эквивалента элемента зависит от характера превращения, претерпеваемого им при образовании химического соединения.
76.47 ед. м. Cr соединены с 23.53 ед. м. О
mэ 1 Cr ---------------------- 8 ед. м. О.
mэ 1 = 76.47 * 8 / 23.53 = 26.00,
аналогично:
mэ 2 = 68.42 * 8 / 31.58 = 17.33,
mэ 3 = 52.0 * 8 / 48.0 = 8.67.
В1 = М(Cr) / mэ 1 = 52 / 26.00 = 2 CrO
В2 = М(Cr) / mэ 2 = 52 / 17.33 = 3 Cr2O3
В3 = М(Cr) / mэ 3 = 52 / 8.67 = 6 CrO3.
2
Фактор эквивалентности для кислорода равен ½, следовательно объем эквивалента 22.4 * ½ = 11.2 литра.
Э(О) = 0.23 / 11.2 = 0.02 моль-экв.
Значит, количество эквивалента металла должно быть тоже равно 0.02. Отсюда
0.5 г (Ме) -------- 0.02 моль-экв
mЭ (Me) ---------- 1 моль-экв
mэ = 0.5 / 0.02 = 25.00 г / моль.
М = mэ * В = 25.00 * 2 = 50 г / моль.
3.
8.9 ед. м. Н соединены с 91.1 ед. м. Х
1 ед. м. Н ----------------- mэ
mэ = 91.1 * 1 / 8.9 = 10.2 г / моль.
М = mэ * В = 10.2 * 3 = 30.6 г / моль.
Формула гидрида РН3.
4.
Фактор эквивалентности для водорода равен ½, следовательно объем эквивалента 22.4 * ½ = 11.2 литра.
Э(Ме) = 0.45 / 20 = 0.0225 моль-экв.
Значит, количество эквивалента израсходованной кислоты и выделившегося водорода должно быть тоже равно 0.0225. Отсюда
V л. (Н2) -------- 0.0225 моль-экв
11.2 л. (Н2) ---------- 1 моль-экв
V = 0.0225 * 11.2 / 1 = 0.252 л.
Масса эквивалента КОН равна 56 г / моль, следовательно
Э(Н3РО3) = Э(КОН) = 1.291 / 56 = 0.023 моль-экв.
0.943 г (Н3РО3) -------- 0.023 моль-экв
mЭ (Н3РО3) ------------ 1 моль-экв
mэ = 0.943 * 1 / 0.023 = 41.000 г / моль.
основность кислоты равна М(Н3РО3) / mЭ (Н3РО3) = 82 / 41 = 2.
Н3РО3 + 2КОН = К2РНО3 + 2Н2О.
6
Фактор эквивалентноси для CuOHNO3 равен ½, следовательно
mэ = ½ * М(CuOHNO3) = ½ * 143 = 71.5 г / моль.
Фактор эквивалентноси для Na2HPO4 равен 1/3, следовательно
mэ = 1/3 * М(Na2HPO4) = 1/3 * 142 = 47.33 г / моль.
№7
На нейтрализацию
7,330г фосфорноватистой кислоты
![]() пошло 4,4444г
пошло 4,4444г
![]() .
Вычислите количества вещества эквивалента
и молярную массу эквивалента
фосфорноватистой кислоты, ее основность
и напишите уравнение реакции нейтрализации.
.
Вычислите количества вещества эквивалента
и молярную массу эквивалента
фосфорноватистой кислоты, ее основность
и напишите уравнение реакции нейтрализации.
Решение:
Молярная
масса эквивалента
![]() равна его молярной массе
равна его молярной массе
![]()
Вещества взаимодействуют между собой в массах, пропорциональных их молярным массам эквивалента:
![]()
Молекулярная
масса
![]() :
:
![]()
Т.е. эквивалент
![]() в данной реакции равен 1,
в данной реакции равен 1,
Следовательно, уравнение реакции:
![]()
8.
Количество эквивалентов алюминия равно количеству эквивалентов выделившегося водорода, а значит магния нужно тоже столько же.
Э(Mg) = Э(Al) = 26.97 / 8.99 = 3 моль-экв.
m(Mg) = mЭ(Mg) * Э(Mg) = 12.16 * 3 = 36.48 г.
9.
Фактор эквивалентноси для Fe(OH)2CH3COO равен 1/3 поскольку по уравнению с одним его моль реагирует 3 моль-экв азотной кислоты, следовательно
mэ = 1/3 * М(Fe(OH)2CH3COO) = 1/3 * 149 = 49.66 г / моль.
Фактор эквивалентноси для КН2РО4 равен 1 поскольку по уравнению с одним его моль реагирует 1 моль-экв едкого кали, следовательно
mэ = 1 * М(КН2РО4) = 1 * 136 = 136 г / моль.
10
2.5 / 4.1 = (mэ(Ме) + mэ(СО32-)) / (mэ(Ме) + mэ(NO3-))
Обозначим молярную массу эквивалента металла за Х:
2.5 / 4.1 = (Х + ½ * 60) / (Х + 62)
2.5 * (Х + 62) = 4.1 * (Х + 30)
2.5Х + 155 = 4.1Х + 123
1.6Х = 32
Х = 20 г / моль.
№11
Вычислите
количество вещества эквивалента и
молярную массу эквивалента гидрокарбоната
кальция
![]() и хлорида дигидроксоалюминия
и хлорида дигидроксоалюминия
![]()
![]()
![]()
Решение:
Значение
эквивалента равно количеству замещенных
атомов водорода или гидроксильных
групп. В реакции
![]() ,
эквивалент
,
эквивалент
![]() равен
1. Эквивалентная масса
равен
1. Эквивалентная масса
![]() равна
молярной массе вещества, поскольку в
реакции замещается 1 эквивалент КОН.
равна
молярной массе вещества, поскольку в
реакции замещается 1 эквивалент КОН.
Молярная
масса эквивалента равна:![]()
Во второй
реакции
![]() .
Один моль
.
Один моль
![]() реагирует
с 2 молями
реагирует
с 2 молями
![]() ,
эквивалент
,
эквивалент
![]() равен
2. Молярная масса эквивалента
равен
2. Молярная масса эквивалента
![]() равна ее молярной массе. Молярная масса
эквивалента эквивалента
равна ее молярной массе. Молярная масса
эквивалента эквивалента
![]() равна половине молярной массы
равна половине молярной массы
![]()
12
Э(Н3РО4) = Э(NaOH) = m(NaOH) / mЭ(NaOH) = 7.998 / 40 = 0.2 моль.
9.797 г Н3РО4 ------- 0.2 моль-экв.
mЭ Н3РО4 -------------- 1моль-экв.
mЭ = 9.797 / 0.2 = 49 г / моль
Основность равна М(Н3РО4) / mЭ(Н3РО4) = 98 / 49 = 2
Н3РО4 + 2NaOH = Na2HPO4 + 2H2O
Ответ: 49 г / моль; 0.2 моль; 2.
13
2.7 / 6.3 = (mэ(Ме) + mэ(О2-)) / (mэ(Ме) + mэ(NO3-))
Обозначим молярную массу эквивалента металла за Х:
2.7 / 6.3 = (Х + ½ * 16) / (Х + 62)
2.7 * (Х + 62) = 6.3 * (Х + 8)
2.7Х + 167.4 = 6.3Х + 50.4
3.6Х = 117
Х = 32.5 г / моль.
14
1.3 / 2.85 = (mэ(Ме) + mэ(ОН-)) / (mэ(Ме) + mэ(SO42-))
Обозначим молярную массу эквивалента металла за Х:
1.3 / 2.85 = (Х + 17) / (Х + ½ * 96)
1.3 * (Х + 48) = 2.85 * (Х + 17)
1.3Х + 62.4 = 2.85Х + 48.45
1.55Х = 13.95
Х = 9 г / моль.
15.
а) n = 6.02*1021 / 6.02*1023 = 0.01 моль NH3.
mЭ(N) = 1/3 * M(N) = 1/3 * 14 = 4.67 г / моль.
б) n = 1.20*1024 / 6.02*1023 = 2 моль H2S.
mЭ(S) = 1/2 * M(S) = 1/2 * 32 = 16 г / моль.
в) n = 2.00*1023 / 6.02*1023 = 0.32 моль HСl.
mЭ(Cl) = 1 * M(Cl) = 1 * 35.5 = 35.5 г / моль.
16
а) Из закона Авогадро вытекает, что массы равных объёмов различных газов, взятых при одинаковых условиях, относятся друг к другу как их молекулярные массы. Данное отношение называется относительной плотностью. Приведём массы к одному объёму 0.2 л.:
0.5 л Н2 ------ 0.045 г Н2
0.2 л Н2 ------ m
m = 0.2 * 0.045 / 0.5 = 0.018 г
DH = m(X) / m(H2) = 0.328 / 0.018 = 18.222
M(X) = DH * M(H2) = 18.222 * 2 = 36.444 г / моль.
б) 22.4 л ------ 1 моль
0.2 л -------- n
n = 0.2 / 22.4 = 0.009 моль.
M = m / n = 0.328 / 0.009 = 36.444 г / моль
17
n = 3.01*1021 / 6.02*1023 = 0.005 моль
22.4 л ---------- 1 моль
V ------------ 0.005 моль
V = 22.4 * 0.005 = 0.112 л.
M = m / n = 0.22 / 0.005 = 44 г / моль.
18
а) Из закона Авогадро вытекает, что массы равных объёмов различных газов, взятых при одинаковых условиях, относятся друг к другу как их молекулярные массы. Данное отношение называется относительной плотностью. Приведём массы к одному объёму 0.5 л.:
0.25 л О2 ------ 0.3572 г О2
0.5 л О2 ------ m
m = 0.5 * 0.3572 / 0.25 = 0.7144 г
DH = m(X) / m(О2) = 0.3805 / 0.7144 = 0,5326
M(X) = DH * M(О2) = 0.5326 * 32 = 17 г / моль.
б) 22.4 л ------ 1 моль
0.5 л -------- n
n = 0.5 / 22.4 = 0.0223 моль.
M = m / n = 0.3805 / 0.0223 = 17 г / моль.
19
Найдём массу атома углерода и по определению умножим на 1/12:
mo(C) = M(C) / NA = 12.01 / 6.02*1023 = 1.20*10-23 г
mo = mo(C) * 1/12 = 1.20*10-23 * 1/12 = 1.66*10-24 г
mо(H2SO4) = M(H2SO4) * mo = 98 * 1.66*10-24 = 1.628*10-22 г.
№19
Какой объём при н.у. занимает эквивалентная масса кислорода? Вычислите мольную и атомную массу двухвалентного металла, если на окисление 8,34 г этого металла пошло 0,68 л кислорода (н.у.)

№20
Какой объем
(н.у.) занимает
![]() молекул газа? Определите относительную
молекулярную массу газа, зная, что
вычисленный объем имеет массу 1,25г.
Выразите в молях это количество газа.
молекул газа? Определите относительную
молекулярную массу газа, зная, что
вычисленный объем имеет массу 1,25г.
Выразите в молях это количество газа.
Решение:
Какой объем
занимают
![]() молекул газа?
молекул газа?
![]() молекул занимают объем 22,4л
молекул занимают объем 22,4л
![]() молекул
занимают объем х л
молекул
занимают объем х л
![]() л
л
Какое количество
молей составляют
![]() молекул газа?
молекул газа?
![]() моль
моль
Чему равна относительная молекулярная масса газа?
Вычислим относительную молекулярную массу по уравнению Менделеева-Клапейрона, подставив значения давления и температуру, соответствующие стандартным условиям.
![]()
21.
Масса одной углеродной единицы 1.66*10-24 г, значит один грамм равен 1 / 1.66*10-24 = 6.02*1023 ед. м..
34 г Н2S -------- 6.02*1023
8.5 г Н2S -------- N
N = 8.5 * 6.02*1023 / 34 = 1.5*1023
mo(Н2S) = M(Н2S) / NA = 34 / 6.02*1023 = 5.66*10-23 г.
22.
n = 0.25 / 22.4 = 0.011 моль некоторого газа.
M = m / n = 0.1898 / 0.011 = 17 г / моль.
mo = M / NA = 17 / 6.02*1023 = 2.8*10-23 г.
№23
Элемент образует несколько газообразных соединений с водородом. Рассчитайте относительную молекулярную массу элемента и назовите этот элемент, если
|
Соединение элемента с водородом |
I |
II |
III |
IY |
|
Плотность по водороду |
8 |
15 |
22 |
29 |
|
Содержание элемента в % |
75,0 |
80,0 |
81,8 |
82,7 |
Решение:
Относительная плотность первого газа по второму равна отношению их мольных масс. Отсюда молекулярная масса I соединения равна:

По процентному содержанию вычисляем содержание элемента и водорода в соединении:
![]()
Атомная масса элемента равна 12, т.е. данный элемент – углерод,
Молекулярная
формула данного вещества
![]() - метан.
- метан.
2) молекулярная масса II соединения равна:

По процентному содержанию вычисляем содержание элемента и водорода в соединении:
![]()
Формула
соединения:
![]() - этан.
- этан.
молекулярная масса III соединения равна:
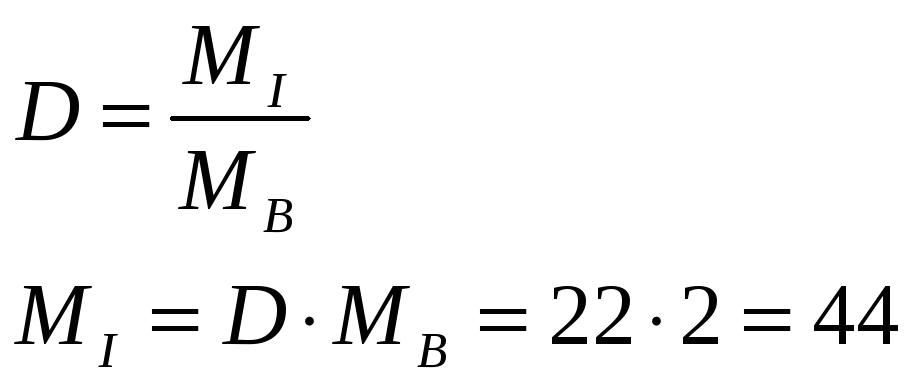
По процентному содержанию вычисляем содержание элемента и водорода в соединении:
![]()
Формула
соединения:
![]() -пропан.
-пропан.
4) молекулярная масса III соединения равна:
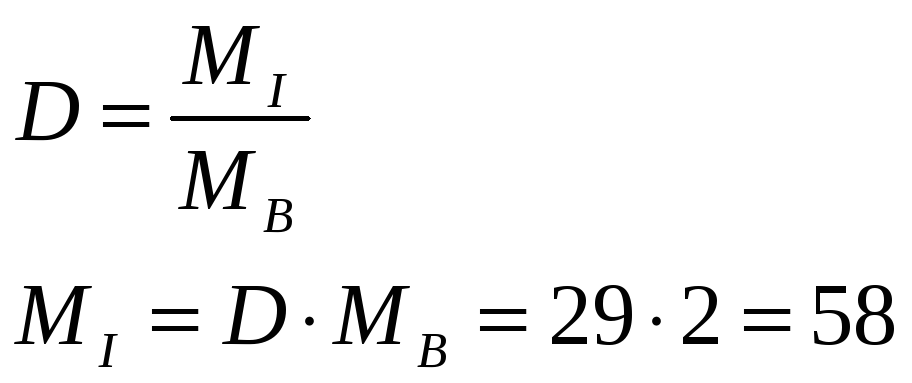
По процентному содержанию вычисляем содержание элемента и водорода в соединении:
![]()
Формула
соединения:
![]() -
бутан.
-
бутан.
24
А = 0.750 * 16 = 12 ед. м.
А = 0.274 * 44 = 12 ед. м.
А = 0.522 * 46 = 24 ед. м.
А = 0.620 * 58 = 36 ед. м.
Наименьшее число, кратное всем остальным относительным атомным массам 12. Делаем вывод, что этот элемент – углерод.
25
Из формулы DH = M(X) / M(H2) вытекает
M(X) = DH * M(H2)
M1 = 13 * 2 = 26 г / моль
M2 = 14 * 2 = 28 г / моль
M3 = 39 * 2 = 78 г / моль
M4 = 37 * 2 = 74 г / моль
А = 0.9231 * 26 = 24 ед. м.
А = 0.4286 * 28 = 12 ед. м.
А = 0.9231 * 78 = 72 ед. м.
А = 0.6486 * 74 = 48 ед. м.
Наименьшее число, кратное всем остальным относительным атомным массам 12. Делаем вывод, что этот элемент – углерод.
26.
А = 0.9725 * 36.45 = 35.45 ед. м.
А = 0.6850 * 103.50 = 70.90 ед. м.
А = 0.7976 * 133.33 = 106.35 ед. м.
А = 0.4755 * 74.55 = 35.45 ед. м.
Наименьшее число, кратное всем остальным относительным атомным массам 35.45. Делаем вывод, что этот элемент – хлор.
27.
Находим массу эквивалента металла, помня, что вещества соединяются в эквивалентных количествах:
0.28 л О2 ----------- Э
11.2 л О2 --------- 1 моль-экв.
Э(Ме) = Э = 0.28 / 11.2 = 0.025 моль-экв.
mЭ = m / Э = 1.5326 / 0.025 = 61.304 г / моль.
На основании правила Дюлонга-Пти определяем приблизительный атомный вес металла:
26.36 / 0.138 = 191.
Затем делением приблизительного атомного веса на эквивалент находим валентность металла (целое число):
В = 191 / 61.304 = 3.12 = 3.
Умножая эквивалент на валентность находим точный атомный вес
А = 3 * 61.304 = 183.912 ед. м.
mo(W) = A(W) / NA = 183.912 / 6.022*1023 = 3.054*10-22 г.
№28
Удельная теплоемкость металла 0,385кДж/моль*К. определите точную относительную атомную массу металла, если его молярная масса эквивалента равна 32,68г/моль. Вычислите среднюю массу одного атома этого металла в граммах. Атомная теплоемкость 26,36кДж/моль*К.
Решение:
Между удельной и атомной теплоемкостью существует связь:
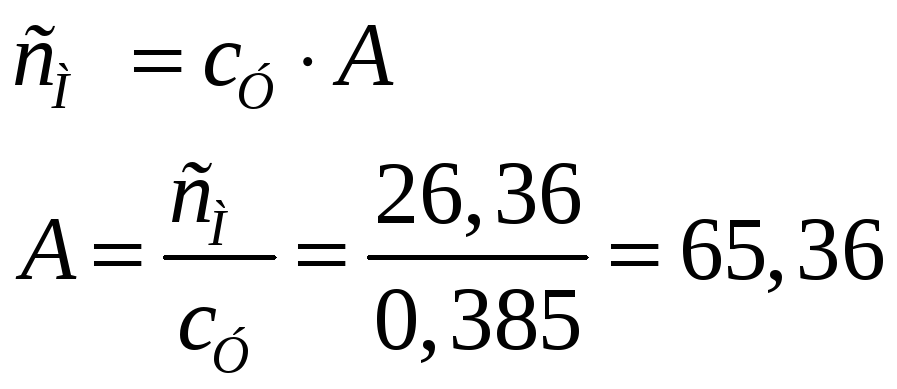
Таким образом, атомная масса металла 65,36
Масса одного атома в граммах:
![]() г
г
29.
Находим массу эквивалента металла, помня, что вещества соединяются в эквивалентных количествах:
66.48 % Ме ----------- mЭ
33.52 % S --------- 16.03 г / моль-экв.
mЭ = 66.48 * 16.03 / 33.52 = 31.79 г / моль-экв.
На основании правила Дюлонга-Пти определяем приблизительный атомный вес металла:
26.36 / 0.381 = 69.
Затем делением приблизительного атомного веса на эквивалент находим валентность металла (целое число):
В = 69 / 31.79 = 2.17 = 2.
Умножая эквивалент на валентность находим точный атомный вес
А = * 31.79 = 63,58 ед. м.
mo(Сu) = A(Cu) / NA = 63.58 / 6.022*1023 = 1.06*10-22 г.
30.
Находим массу эквивалента металла, помня, что вещества соединяются в эквивалентных количествах:
0.16 г О2 ----------- Э
8 г О2 --------- 1 моль-экв.
Э(Ме) = Э = 0.16 / 8 = 0.02 моль-экв.
m(Me) = m(оксида) - m(О) = 1.32 – 0.16 = 1.16 г.
mЭ = m(Ме) / Э(Ме) = 1.16 / 0.02 = 58.00 г / моль-экв.
На основании правила Дюлонга-Пти определяем приблизительный атомный вес металла:
26.36 / 0.117 = 225.
Затем делением приблизительного атомного веса на эквивалент находим валентность металла (целое число):
В = 225 / 58.00 = 3.88 = 4.
Умножая эквивалент на валентность находим точный атомный вес
А = 58.00 * 4 = 232.00 ед. м.
mo(Th) = A(Th) / NA = 232.00 / 6.022*1023 = 3.85*10-22 г.
31
Под изотопами понимают ядра элементов с одинаковым зарядом, но различными массами. Дробность атомных масс связана с относительной распространенностью изотопов данного элемента в природе, так как в одной клетке периодической таблицы собраны все изотопы, вклады которых в общую массу неодинаковы. То есть масса указанная в таблице Д.И.Менделеева есть средняя масса всех изотопов данного элемента взятых со своими статистическими весами. Атомы разных элементов называют изобарами.
32
Испускание электронов при распаде обусловлено превращением нейтрона по схеме
no = p+ + e- + ño
где ñо – антинейтрино.
93 238 Np = 94 238 Pu + e-
95 242 Am = 96 242 Cm + e-
33
99 253 Es + 2 4 He = 101 256 Md + 0 1n
253 Es (, n) 256 Md
34
94 242 Pu + 12 22 Ne = 104 260 Ku + 2 4 He
242 Pu (12 22 Ne, ) 260 Ku
35
При +-распаде происходит превращение протона в нейтрон по схеме:
p+ = no + e+ + o
где e+ - позитрон, o – нейтрино.
6 11 С = 5 11 B + e+
8 15 O = 7 15 N + e+
36
Сущность радиоактивного распада в том, что один элемент превращается в другой с испусканием одной или нескольких частиц.
92 238 U = 84 222 Po + 4 2 4 He
84 222 Po = 86 222 Rn + 2 e-
37
3 6 Li + 0 1n = 1 3 H + 2 4 He
6 Li (n, ) 1 3 H
38
92 238 U + 1 2 D = 93 239 Np + 0 1 n
25 55 Mn + 0 1n = 23 52 V + 2 4 He
30 70 Zn + 1 1 H = 31 70 Ga + 0 1 n
№39
Закончите уравнения ядерных реакций:
a)![]()
b)![]()
c)![]()
d)![]()
a)
![]()
![]()
b)
![]()
![]()
c)
![]()
![]()
d)
![]()
![]()
40
Находим по пропорции число частиц в 1000 г урана и выражаем дефект массы из формулы А.Эйнштейна.
235 г содержит 6,02*1023 частиц
1000 г -------------- N
N = 1000 * 6.02*1023 / 235 = 2.56 * 1024
m = E / (c2 * N) = 8.23*1013 / ((3*108) * 2.56 * 1024) = 3.57 * 10-28 кг.
41
17 35 Cl + 0 1n = 16 35 S + 1 1 H
35 Cl (n, p) 35 S
28 60 Ni + 1 1H = 27 57 Co + 2 4 He
60 Ni (p, ) 57 Co
13 27 Al + 0 1n = 11 24 Na + 2 4 He
27 Al (n, ) 24Na
24 52 Cr + 2 4He = 26 56 Fe
52 Cr () 56 Fe
42
Ион азота должен иметь положительный заряд, так как иначе сумма зарядов в левой части будет меньше заряда ядра эйнштейния. Минимальный возможный заряд азота в данном случае +2, так как при заряде +1 испускающаяся частица невозможна 16Х.
92 238 U + 9 14 N = 99 246 Es + 2 13H
238 U (9 14N, 2 t) 246 Es
43
Находим дефект масс ( зная, что одна единица массы равна 1,66*10-27 кг) и подставляем его в формулу А.Эйнштейна:
m = 2.01410 + 3.01605 – (4.00260 + 1.00866) = 0.01889 ед.м. =
= 0.01889 * 1.66 * 10 -27 кг = 3.13*10 –29 кг.
E = m * c2 * NA = 3.13*10 –29 * (3 * 108)2 * 6.02 * 1023 =
= 1.70 * 1012 Дж / моль.
№44
Теплота сгорания газообразного метана 495 кДж/моль. Вычислите массу эквивалентную этой энергии.
Решение:
Табличное значение теплоты сгорания метана –890,31 кДж/моль.

Молекулярная
масса метана
![]()
Масса
эквивалентная энергии
![]()
45
Находим дефект масс ( зная, что одна единица массы равна 1,66*10-27 кг) и подставляем его в формулу А.Эйнштейна:
m = 2.01410 + 3.01603– (4.00260 + 1.00782) = 0.01971 ед.м. =
= 0.01971 * 1.66 * 10 -27 кг = 3.27*10 –29 кг.
E = m * c2 * NA = 3.27*10 –29 * (3 * 108)2 * 6.02 * 1023 =
= 1.77 * 1012 Дж / моль.
46
Главное квантовое число характеризует общую энергию электрона в атоме водорода и в первом приближении общую энергию любого электрона – его энергетический уровень. n [1, ] в целых числах. Реально n = 1, 2, 3, 4, 5, 6, 7 соответствует номеру периода в периодической системе.
Орбитальное квантовое число определяет форму электронных орбиталей и характеризует различное энергетическое состояние электронов на данном уровне. l [0, n-1] в целых числах. Значения l = 0, 1, 2, 3 описывают электроны всех известных сейчас элементов.
Магнитное квантовое число указывает на ориентацию электронного облака относительно избранного направления. Число возможных значений (2l + 1) определяет количество орбиталей на данном подуровне. ml [-l, +l] в целых числах. Таким образом, максимальный набор реальных значений ml = -3, -2, -1, 0, 1, 2, 3.
Спиновое квантовое число обусловлено движением электрона вокруг своей оси. Принимает только два значения ms = - ½, + ½.
48
На четвертом уровне может существовать одна s-, три p-, пять d- и семь f-орбиталей всего 16 штук.
n = 4 l = 0 ml = 0
n = 4 l = 1 ml = -1, 0, 1
n = 4 l = 2 ml = -2, -1, 0, 1, 2
n = 4 l = 3 ml = -3, -2, -1, 0, 1, 2, 3
49
а) 1, так как указана конкретная ориентация вдоль оси Х.
б) 5, так как ml может принять пять значений –2, -1, 0, 1, 2.
в) 1, так как ml может принять только одно значение 0.
г) 3, так как ml может принять только три значения –1, 0, 1.
д) 1, так как указана конкретная ориентация относительно осей координат.
50
а) n = 1 l = 0 ml = 0
б) n = 2 l = 1 ml = -1, 0, 1
в) n = 3 l = 2 ml = -2, -1, 0, 1, 2
г) n = 4 l = 3 ml = -3, -2, -1, 0, 1, 2, 3
51
Не имею смысла те орбитали, в которых l > n-1
1p n = 1 l = 1 1 > 0
2d n = 2 l = 2 2 > 1
3f n = 3 l = 3 3 > 2
52
n = 4
l = 3
ml = -3, -2, -1, 0, 1, 2, 3
mS = - ½, + ½
53
В атоме не может быть электронов с одинаковым набором квантовых чисел. На одной орбитали может находится только два электрона (mS = - ½, + ½). Чтобы узнать максимальное количество электронов на данном подуровне нужно число орбиталей умножить на два. Число орбиталей определяется количеством значений магнитного квантового числа (2l + 1), которые могут существовать для данной конфигурации электронного облака.
s l = 0 Nm = 2l + 1 = 1 N = 1 * 2 = 2
p l = 1 Nm = 2l + 1 = 3 N = 3 * 2 = 6
d l = 2 Nm = 2l + 1 = 5 N = 5 * 2 = 10
f l = 3 Nm = 2l + 1 = 7 N = 7 * 2 = 14
54
Заполнение атомных орбиталей электронами происходит так, что вначале заполняются орбитали с меньшей энергией, которую можно оценить по сумме главного и орбитального квантовых чисел.
4s n + l = 4 + 0 = 4
3d n + l = 3 + 2 = 5
Значит вначале заполняются орбитали 4s, а потом 3d, так как энергия последних больше.
5s n + l = 5 + 0 = 5
4d n + l = 4 + 2 = 6
Значит вначале заполняются орбитали 5s, а потом 4d, так как энергия последних больше.
.
№55
Сколько и
какие значения может принимать магнитное
квантовое число
![]() для
данного орбитального квантового числа
для
данного орбитального квантового числа
![]()
значения
магнитного квантового числа
![]() :
:
|
|
0 |
1 |
2 |
3 |
|
|
0 |
-1,0,1 |
-2,-1,0,1,2 |
-3,-2,-1,0,1,2,3 |
56
Число орбиталей на данном энергетическом уровне определяется количеством возможных значений магнитного квантового числа.
s l = 0 Nm = 2l + 1 = 1
p l = 1 Nm = 2l + 1 = 3
d l = 2 Nm = 2l + 1 = 5
f l = 3 Nm = 2l + 1 = 7
57
Для р-подуровня магнитное квантовое число может принимать три значения ml = -1, 0, 1 значит существует только 3 р-орбитали. px -, py -, pz – электронные облака имеют форму гантели и расположены перпендикулярно друг другу в пространстве соответственно вдоль осей координат.
58
Электроны по орбиталям располагаются по мере возможности по одиночке, причём с одинаковыми спинами.d-подуровень имеет пять орбиталей, поэтому шестой электрон спарится.
3d
Таким образом, суммарное спиновое число равно
-½ + ½ + ½ + ½ + ½ + ½ = 2
или
½ - ½ - ½ - ½ - ½ - ½ = -2
59
Хлор находится в третьем периоде, порядковый номер 17, следовательно 17 электронов расположены на 3 энергетических уровнях. Общая формула для 3 энергетических уровней:
1s22s22p63s23p63d10
Таким образом, для атомов хлора электронная формула
1s22s22p63s23p5
Медь находится в 4 периоде, порядковый номер 29, следовательно 29 электронов расположены на 4 энергетических уровнях. Общая формула для 4 энергетических уровней:
1s22s22p63s23p63d104s24p64d104f14
Таким образом, с учетом провала одного 4s электрона, для атомов хлора электронная формула
1s22s22p63s23p63d104s1.
№60
Что такое
электронное облако? Какова пространственная
конфигурация
![]() электронных
облаков?
электронных
облаков?
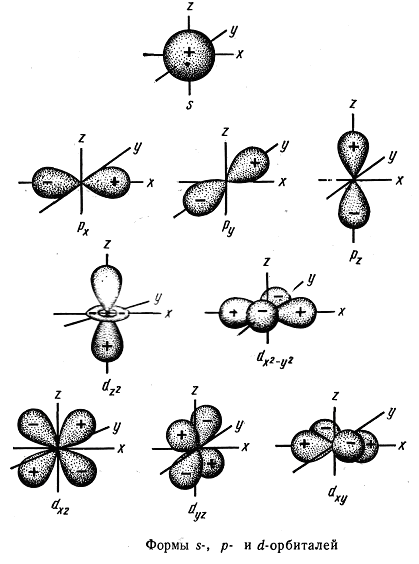
В качестве модели состояния электрона в атоме принято представление об электронном облаке, плотность соответствующих участков которого пропорциональна вероятности нахождения там электрона.
Пространство вокруг ядра, в котором наиболее вероятно пребывание электрона называют орбиталью.
Согласно
квантовомеханическим расчетам
![]() -орбитали
имеют форму шара, р-орбитали— форму
гантели, d-
и f-орбитали — более
сложные формы. Формы граничных поверхностей
-
-орбитали
имеют форму шара, р-орбитали— форму
гантели, d-
и f-орбитали — более
сложные формы. Формы граничных поверхностей
-![]() орбиталей
показаны на рис. На изображении граничной
поверхности часто
орбиталей
показаны на рис. На изображении граничной
поверхности часто
показывают также знак волновой функции.
№61
Сколько электронов находится на каждом энергетическом уровне и подуровне у атомов элементов с порядковыми номерами 23 и 35? Составьте электронные формулы для атомов этих элементов.
Электронная формула атома элемента с порядковым номером 23 (V-ванадий):
![]()
![]()
Распределение электронов по энергетическим уровням:
![]()
Электронная формула элемента с порядковым номером 35 (бром):
![]()
Распределение электронов по энергетическим ячейкам:
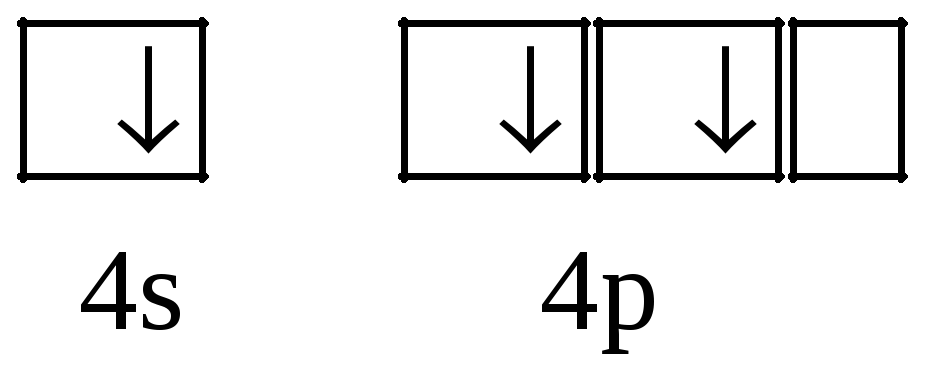
Распределение электронов по энергетическим уровням:
![]()
62
В соответствии с правилами Клечковского заполнение орбиталей идет в такой последовательности:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s …
Следовательно 17-элемент имеющий 17 электронов имеет электронную формулу:
1s22s22p63s23p5
Аналогично 29-элемент с учетом провала 4s-электрона имеет электронную формулу:
1s22s22p63s23p64s13d10
63
В соответствии с правилами Клечковского заполнение орбиталей идет в такой последовательности:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s …
Следовательно 21-элемент имеющий 21 электронов имеет электронную формулу:
1s22s22p63s23p64s23d1
cоответственно распределение электронов по оболочкам начиная от внешней 2, 9, 8, 2.
Аналогично 40-элемент имеет электронную формулу:
1s22s22p63s23p64s23d104p65s24d2
cоответственно распределение электронов по оболочкам начиная от внешней 2, 10, 18, 8, 2.
64
В соответствии с правилами Клечковского заполнение орбиталей идет в такой последовательности:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s …
Следовательно 15-элемент имеющий 15 электронов имеет электронную формулу:
1s22s22p63s23p3
Аналогично 24-элемент с учетом провала 4s-электрона имеет электронную формулу:
1s22s22p63s23p64s13d5
65
В соответствии с правилами Клечковского заполнение орбиталей идет в такой последовательности:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s …
Следовательно 22-элемент имеющий 22 электронов имеет электронную формулу:
1s22s22p63s23p64s23d2
Аналогично 54-элемент имеет электронную формулу:
1s22s22p63s23p64s23d104p65s24d105p6
Отсюда видно, что электроны занимают s-, p-, d- орбитали на соответствующих уровнях.
66
В соответствии с правилами Клечковского заполнение орбиталей идет в такой последовательности:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s …
Следовательно 39-элемент имеющий 39 электронов имеет электронную формулу:
1s22s22p63s23p64s23d104p65s24d1
Отсюда видно, что электроны занимают s-, p-, d- орбитали на соответствующих уровнях.
Элемент находится в 5 периоде, так как начал заполняться 5 энергетический уровень. Один электрон на 4d подуровне появляется позже, поэтому элемент находится в 3 группе (5s24d1 – всего 3 электрона).
67
В соответствии с правилами Клечковского заполнение орбиталей идет в такой последовательности:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s …
Следовательно 16-элемент имеющий 16 электронов имеет электронную формулу:
1s22s22p63s23p4
Аналогично 46-элемент с учетом провала двух 5s-электронов имеет электронную формулу:
1s22s22p63s23p64s23d104p65s04d10
68
В соответствии с правилами Клечковского заполнение орбиталей идет в такой последовательности:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s …
Следовательно 25-элемент имеющий 25 электронов имеет электронную формулу:
1s22s22p63s23p64s23d5
Аналогично 34-элемент имеет электронную формулу:
1s22s22p63s23p64s23d104p4
Отсюда видно, что электроны занимают s-, p-, d- орбитали на соответствующих уровнях.
Так как в 25-элементе идет заполнение d-подуровня – это d-элемент (марганец). 34-элемент относится к халькогенам, так как это p-элемент находящийся в 6 группе (6 электронов на внешнем уровне).
69
В соответствии с правилами Клечковского заполнение орбиталей идет в такой последовательности:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s …
Следовательно 41-элемент имеющий 41 электрон с учетом провала 5s-электрона имеет электронную формулу:
1s22s22p63s23p64s23d104p65s14d4
Элемент находится в 5 периоде, так как начал заполняться 5 энергетический уровень. Четыре электрона на 4d подуровне появляется позже, поэтому элемент находится в 5 группе (5s14d4 – всего 5 электронов).
70
В соответствии с правилами Клечковского заполнение орбиталей идет в такой последовательности:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s …
Следовательно 17-элемент хлор имеющий 17 электронов имеет электронную формулу:
1s22s22p63s23p5
У иона Cl+ на один электрон меньше:
1s22s22p63s23p4
У иона Cl- на один электрон больше:
1s22s22p63s23p6
№71
Какие атомы
или ионы в основном состоянии имеют
электронную конфигурацию
![]() ?
?
Решение:
Данную электронную конфигурацию имеет атом неона
![]() ,
ион фтора
,
ион фтора
![]() и ион
и ион
![]() .
.
72
В соответствии с правилами Клечковского заполнение орбиталей идет в такой последовательности:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s …
Следовательно 7-элемент азот имеющий 7 электронов имеет электронную формулу:
1s22s22p3
У иона N+ на один электрон меньше:
1s22s22p2
У иона N- на один электрон больше:
1s22s22p4
73
В соответствии с правилами Клечковского заполнение орбиталей идет в такой последовательности:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s …
Следовательно 43-элемент имеющий 43 электрона имеет электронную формулу:
1s22s22p63s23p64s23d104p65s24d5
Аналогично 55-элемент имеющий 55 электронов имеет электронную формулу:
1s22s22p63s23p64s23d104p65s24d105p66s1
43-элемент находится в 5 периоде, так как начал заполняться 5 энергетический уровень. Пять электронов на 4d подуровне появляется позже, поэтому элемент находится в 7 группе (5s24d5 – всего 7 электронов).
55-элемент находится в 6 периоде, так как начал заполняться 6 энергетический уровень. Элемент находится в 1 группе (6s1 – всего 1 электрон).
74
а) возбужденное состояние, так как один электрон на ходится на 3s- орбитали при незаполненной 2p.
Б) основное состояние; очевидно, благородный газ.
В) невозможное состояние, так как на 3s-орбитали может быть только два электрона.
Г) невозможное состояние, так как на трех р-орбиталях может быть только шесть электронов.
75
В соответствии с правилами Клечковского заполнение орбиталей идет в такой последовательности:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s …
Следовательно 8-элемент кислород имеющий 8 электронов имеет электронную формулу:
1s22s22p4
У иона О+ на один электрон меньше:
1s22s22p3
У иона О- на один электрон больше:
1s22s22p5
У иона О2- на два электрона больше:
1s22s22p6
76
Энергия ионизации – это та энергия, которую необходимо затратить, чтобы оторвать электрон и удалить его на бесконечно большое расстояние от ядра. Измеряется в электронвольтах (эВ).
Восстановительные свойства s-, p- элементов в группах с увеличением порядкового номера усиливаются, так как энергия ионизации соответственно уменьшается.
№ 45
Что такое сродство к электрону ? В каких единицах оно выражается ? Как изменяется окислительная активность неметаллов в периоде и в группе периодической системе с увеличением порядкового номера ? Ответ мотивируйте строением атома соответствующего элемента.
Ответ:
Сродство к электрону – энергия выделяемая или поглощаемая при присоединении электрона к нейтральному атому в газообразном состоянии, выражается в эВ ( электрон-вольт ) или кДж/моль. Положительное значение сродства к электрону указывает, что присоединение электрона к атому связано с выделением энергии.
Например:
O- + e- -> O2 – 7,3 эВ ( энергия поглощается )
Эндотермический процесс.
При переходе вдоль одного периода от элементов первой группы к элементам седьмой, радиусы атомов последовательно уменьшаются, а эффективный заряд ( Zэфф ) возрастает. В пределах одной группы сродство к электрону обычно имеет наивысшее значение для наиболее легкого элемента, выпадают из этой закономерности элементы: фтор , кислород.
Добавление еще одного электрона с образованием иона настолько повышает отталкивание между электронами, что сродство электрона оказывается меньше, чем у следующего элемента той же группы.
78
Электроотрицательность – это характеристика способности атомов элементов принимать или отдавать электроны. В соединении атом более электроотрицательный оттягивает на себя электронную плотность с менее ЭО атома.
ЭО в периоде увеличивается, так как увеличивается сродство к электрону. В группе ЭО уменьшается, так как радиус атома увеличивается, связи внешних электронов с ядром ослабевают и энергия ионизации уменьшается.
79
В оксиде ЭО2 элемент находится в степени окисления +4, если это его высшый оксид, то элемент принадлежит 4 группе. Значит эти элементы цирконий и олово. Газообразное соединение SnH4
Ортоциркониевая кислота H4ZrO4 (HO)2 Zr (OH)2
Метациркониевая кислота H2ZrO3 (HO)2 Zr=O
Ортооловянная кислота H4SnO4 (HO)2 Sn (OH)2
Метаоловянная кислота H2SnO3 (HO)2 Sn=O
80
так как основные (металлические) свойства в группе увеличиваются, то Ва(ОН)2 более сильное основание, чем Sr(OH)2.
Электроотрицательность кадмия выше, чем стронция, поэтому Sr(OH)2 более сильное основание, чем гидроксид кадмия.
В периоде усиливаются кислотные (неметаллические) свойства, а значит гидроксид кальция более сильное основание, чем гидроксид железа.
81
При увеличении степени окисления усиливаются кислотные свойства гидроксидов. Значит как основание CuOH сильнее чем Cu(OH)2; TlOH – чем Tl(OH)2; Fe(OH)2 – чем Fe(OH)3.
82
Na2O MgO Al2O3 SiO2 P2O5 SO3 Cl2O7
NaOH Mg(OH)2 Al(OH)3 Si(OH)4 и так далее.
Кислотные свойства в этом ряду увеличиваются, а основные ослабевают.
83
Высшие степени окисления определяются по номеру группы.
Метаванадиевая кислота HVO3 HO ZrO2
Рениевая кислота HReO4 HO Re O3
Оксид технеция (VII) Tc2O7 O3 Tc-O-Tc O3
Гидрид германия GeH4 H2GeH2
84
Высшие степени окисления определяются по номеру группы.
Молибденовая кислота H2MoO4 (HO)2 MoO2
метагафниевая кислота H2HfO3 (HO)2 Hf=O
Оксид ниобия (V) Nb2O5 O2 Tc-O-Tc O2
Гидрид полония H2Po H-Po-H
85
а) щелочной металл 4 периода – это калий.
Б) Гелий содержит только два электрона.
В) один неспаренный 2р-электрон есть у бора и фтора.
Г) это азот, так как по правилу Хунда три его р-электрона располагаются на отдельных орбиталях.
86
Высшие и низшие степени окисления определяются тем, к какой оболочке предшествующего или ближайшего следующего благородного газа стремится данный атом.
С4+ СО2 С4- СН4
As5+ HAsO3 As3- AsH3
S6+ SO3 S2- H2S
Cl7+ KClO4 Cl- KCl
№87
Почему марганец проявляет металлические свойства, а хлор неметаллические? Ответ мотивируйте строением атомов этих элементов. Напишите формулы оксидов и гидроксидов этих элементов.
Решение:
Хлор проявляет неметаллические свойства, поскольку является р-элементом. Электронная формула атома хлора:
![]()
Марганец
проявляет металлические свойства,
поскольку является
![]() -элементом.
Электронная формула марганца:
-элементом.
Электронная формула марганца:
![]()
88
Низшая степень окисления элементов соответствует количеству электронов, которое они принимают, чтобы достроить свою электронную оболочку до ближайшего благородного газа.
Гидрид кальция СаН2 nH = -1
Фторид кальция CaF2 nF = -1
Cульфид кальция CaS nS = -2
Нитрид кальция Ca3N2 nN = -3
89
Неметаллические свойства сильнее выражены у фосфора, так как в виду большего размера атома сурьмы энергия ионизации у неё меньше, а значит металлические свойства сильнее. Меньшая энергия ионизации определяет более выраженные восстановительные свойства водородного соединения сурьмы.
90
Высшая степень окисления элементов определяется номером группы периодической системы и возникает за счет распаривания всех возможно спаренных электронов внешнего уровня.
GeO2 nGe = +4
V2O5 nV = +5
Mn2O7 nMn = +7
XeO4 nXe = +8
91
16S 1s22s22p63s23p4
В соответствии с правилом Хунда:
1s
2s
2p
3s
3p
в атоме серы 2 неспаренных электрона. При возбуждении спаренные электроны внешнего уровня могут распариваться занимая 3d-орбитали, тогда неспаренных электронов может быть 4, и даже 6.
92
17Cl 1s22s22p63s23p5
В соответствии с правилом Хунда:
1s
2s
2p
3s
3p
в атоме хлора 1 неспаренный электрон. При последовательном возбуждении спаренные электроны третьего уровня могут распариваться занимая 3d-орбитали, тогда неспаренных электронов может быть 3, 5, и даже 7.
№93
Что следует
понимать под спинвалентностью атома
того или иного элемента в отличие от
его степени окисления? Чему равны
спинвалентность и степень окисления
азота в соединениях
![]() ?
?
Решение:
Спинвалентность – число связей, образуемых атомом данного элемента.
Степень окисления – условный заряд атома.
Степени окисления азота в соединениях:
![]()
Степени окисления азота в соединениях:
![]()
94
Четырехвалентность углерода объясняется распариванием 2s-электронов с переходом одного из них на свободную 2р-орбиталь. Так в возбужденном состоянии присутствуют 4 неспаренных электрона:
1s
2s
2p
HCN nc = +2
CF4 nc = +4
HCOOH nc = +2
CO2 nc = +4
Но валентность везде равна четырём.
95
15P 1s22s22p63s23p3
В соответствии с правилом Хунда:
1s
2s
2p
3s
3p
Фосфор может находится в степени окисления +5, так как 3s-электроны имеют возможность распарится на существующую незанятую 3d-орбиталь.
7N 1s22s22p3
В соответствии с правилом Хунда:
1s
2s
2p
Азот не может находится в степени окисления +5, так как 2s-электроны не имеют возможности распарится на 2d-орбиталь, поскольку такое состояние является запрещенным.
96
Электрический момент диполя – это характеристика, отражающая несимметричное распределение электронной плотности в молекуле, выражающаяся в Кл*м.
ОЭО (HF) = 4.0 – 2.1 = 1.9
ОЭО (HCl) = 3.0 – 2.1 = 0.9
ОЭО (ICl) = 3.0 – 2.5 = 0.5
ОЭО (HI) = 2.5 – 2.1 = 0.4
Все молекулы несимметричны и наибольший момент имеет молекула фтороводорода.
97
Ионной называют сильно поляризованную (при значительных различиях электроотрицательностей входящих в молекулу элементов) связь, когда электронная плотность практически целиком сдвинута к одной структурной единице. Ионная связь характеризуется ненаправленностью и ненасыщаемостью, а свойство поляризуемости теряет для неё всякий смысл.
Под эффективным зарядом атома следует понимать степень полярности связи в молекуле.
98
Внутри кристаллов металлов связи полностью делокализованы по всему объему решетки, в таких системах связь неполярна и носит невалентный, орбитальный характер – это так называемая металлическая связь.
Ионные решетки с чередующимися в узлах положительными и отрицательными ионами характерны для ионных соединений. К ним относятся почти все соли, многие окислы и некоторые другие вещества.
Структурными единицами атомной решетки являются нейтральные атомы, ковалентно связанные друг с другом. Решетки такого рода свойственны некоторым простым веществам, например алмазу.
Молекулярные решетки характеризуются тем, что в их узлах находятся молекулы. Такие кристаллические структуры образуют соединения неполярного или малополярного типа, таковыми являются многие органические вещества.
Узлы металлических решеток заняты положительными ионами, в промежутках между которыми находятся свободные, легкоподвижные электроны.
99
Водородная связь – это связь протона Н+ с электронной оболочкой других атомов, она может осуществляться, если связи в водородсодержащей молекуле сильно поляризованы.
Температура кипения фтороводорода аномально высокая, так как нужно затратить избыточную энергию на разрушение водородных связей. У его аналогов (HCl, HBr, HI) водородных связей нет из-за недостаточной поляризованности связей.
101
а) Сl- - I+ так как ОЭОСl = 3.0 ОЭОI = 2.5
в) С+ - N- так как ОЭОС = 2.5 ОЭОN = 3.0
д) O- - H+ так как ОЭОO = 3.5 ОЭОH = 2.1
102
а) связь ионная, так как ОЭО = 3,5 – 1,0 = 2,5
б) связь ковалентная полярная, так как ОЭО = 2,5 – 2,1 = 0,4
в) связь ковалентная неполярная, так как ОЭО = 2,8 – 2,8 = 0
г) связь ковалентная полярная, так как ОЭО = 3,0 – 2,5 = 0,5
№103
Валентность
(ковалентность) элемента равна общему
числу орбиталей его атомов, принимающих
участие в образовании химических связей.
Чему равна максимальная ковалентность
бора? Какие связи осуществляются в ионах
![]() и
и![]()
Максимальная
ковалентность бора равна 3. Она проявляется
в соединениях
![]() .
В гидриде бора и трихлориде связь
ковалентная, в анионных борат-комплексах
кроме ковалентной связи осуществляется
донорно-акцепторная связь, атом бора
предоставляет свободную орбиталь.
.
В гидриде бора и трихлориде связь
ковалентная, в анионных борат-комплексах
кроме ковалентной связи осуществляется
донорно-акцепторная связь, атом бора
предоставляет свободную орбиталь.
Электронное строение атома бора:
![]()
![]()
В возбужденном состоянии:
![]()
![]()
Образование анионных комплексов:
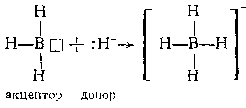
104
Сущность донорно-акцепторного механизма в том, что пара электронов одного атома донируется на пустую орбиталь другого атома (акцептора). Максимальная ковалентность азота равна четырем, так в ионе NH4+ протон Н+ имеющий свободную орбиталь связан с неподелённой парой электронов азота в молекуле аммиака.
105
а) CsF связь ионная, так как ОЭО = 4,0 – 0,7 = 3,3
б) F2 связь ковалентная неполярная, так как ОЭО = 4,0 – 4,0 = 0
в) BrCl связь ковалентная слабо полярная, так как ОЭО = 3,0 – 2,8 = 0,2
г) СаH2 cвязь ионная, так как ОЭО = 2,1 – ½ · 1,0 = 1,6
г) NCl3 cвязь ионная, так как ОЭО = 3.0 – 1/3 · 3.0 = 2.0
Ковалентная связь характеризуется направленностью, поляризуемостью и насыщаемостью.
Ионная связь характеризуется ненаправленностью и ненасыщаемостью, а свойство поляризуемости теряет для неё всякий смысл.
106
Молекула углекислого газа по-видимому линейна, так как центральный атом (углерод) находится в sp-гибридизации валентные углы при которой равны 180 0.
O = C = O
То есть в возбужденном состоянии конфигурация 1s22s12p3. Два р-электрона образуют каждый по одной -связи с разными атомами кислорода. Одна s- и одна р-орбиталь гибридизуются и два распаренных электрона образуют две сигма-связи также с разными атомами кислорода. Получается, что каждый атом кислорода связан одной - и одной -связью. Всего в молекуле две - и две -связи.
Молекула очевидно не обладает электрическим моментом диполя в виду своей высокой симметричности.
107
Локализованная химическая связь – это двухцентровая двухэлектронная связь. Нелокализованная – это связь двухэлектронная многоцентровая, то есть пара электронов принадлежит более чем двум атомам в молекуле.
В молекуле бензола шесть -связей являются локализованными, а три -связи делокализованы по всему шестичленному циклу. Три sp2-гибридизованных орбитали углерода участвуют в образовании локализованных связей, одна 2р-орбиталь участвует в образовании делокализованных связей.
108
N- 1s
2s
2p
двухвалентен
N+ 1s
2s
2p
четырехвалентен
O- 1s
2s
2p
одновалентен
Метод ВС предполагает наличие в молекуле N2O ионов N+ и N-. За счет sp-гибридизации ион N+ дает две -связи одну с ионом N-, а другую с атомом кислорода. Валентный угол в таком случае составит 1800 и, следовательно, молекула веселящего газа имеет линейную структуру.
O === N+ === N-
№109
Как метод ВС
объясняет строение молекулы
![]() ?
Почему угол между связями близок к
тетраэдрическому?
?
Почему угол между связями близок к
тетраэдрическому?
Решение:
Центральный
атом молекулы воды – кислород образует
химические связи за счет электронов
![]() -гибридных
орбиталей. У атома кислорода на четыре
-гибридных
орбиталей. У атома кислорода на четыре
![]() -гибридных
орбитали приходится 6 электронов. Две
гибридных орбитали образуют
-гибридных
орбитали приходится 6 электронов. Две
гибридных орбитали образуют
![]() -связи
с атомами водорода, на двух орбиталях
находятся неспаренные электронные пары
атома кислорода. Строение
-связи
с атомами водорода, на двух орбиталях
находятся неспаренные электронные пары
атома кислорода. Строение
![]() -гибридной
орбитали – тетраэдрическое, поэтому
угол между связями близок к тетраэдрическому,
-гибридной
орбитали – тетраэдрическое, поэтому
угол между связями близок к тетраэдрическому,
110
Направленность ковалентной связи объясняется определенной ориентацией электронных облаков (орбиталей) в пространстве.
У атома азота три неспаренных электрона которые образуют три связи с атомами водорода у которых также по одному электрону. Но у азота есть ещё 2s-неподеленная пара электронов, которая ориентирована в пространстве, а значит она влияет (расталкивает) соседние связи с водородом. Поэтому молекула аммиака имеет почти тетраэдрическое строение, где одну из вершин тетраэдра занимает неподеленная электронная пара азота.
111
В возбужденном состоянии атом бериллия:
1s
2s 2p
Происходит sp-гибридизация и электроны гибридизованных орбиталей образуют -связи под углом 1800.
Молекула воды напоминает тетраэдр в двух вершинах которого находятся атомы водорода, а в двух дугих две неподеленные электронные пары кислорода.
112
Бор в возбужденном состоянии имеет три неспаренных электрона, которые образуют три связи с атомами фтора:
1s
2s 2p
Происходит sp2-гибридизация и электроны гибридизованных орбиталей образуют -связи под углом 1200.
Углерод в возбужденном состоянии имеет четыре неспаренных электрона, которые образуют связи с атомами водорода:
1s
2s 2p
Происходит sp3-гибридизация и электроны гибридизованных орбиталей образуют -связи под углом 109,280.
113
Гибридизация – это смешиваение электронных облаков разного типа в результате чего образуются одинаковые гибридные орбитали.
sp линейное валентный угол 1800
sp2 треугольное валентный угол 1200
sp3 тетраэдрическое валентный угол 109,50
sp3d трехгранная бипирамида
sp3d2 октаэдрическое валентный угол 900
Атом А находится в центре на равном расстоянии от вершин соответствующих фигур, а вершины занимают атомы В.
114
Если электронные облака перекрываются по линии соединяющей центры взаимодействующих атомов, то такая связь называется -связью. Если перекрывание электронных облаков идет перпендикулярно этой линии, то такая связь называется -связью. Если d-электронные облака расположенные в параллельных плоскостях, перекрываются всеми четырьмя лепестками, то такая связь называется -связью.
Атом азота имеет три неспаренных электрона
1s
2s 2p
каждый из которых находит себе пару в другом таком же атоме азота. Возникает одна -связь и две -связи.
115
Углерод в возбужденном состоянии имеет четыре неспаренных электрона, которые образуют связи с атомами хлора:
1s
2s 2p
Происходит sp3-гибридизация и электроны гибридизованных орбиталей образуют четыре -связи под углом 109,280.
Сера в возбужденном состоянии имеет шесть неспаренных электронов:
1s
2s 2p
3s 3p 3d
Происходит sp3d2-гибридизация и электроны гибридизованных орбиталей образуют -связи с шестью атомами фтора, у каждого из которых по одному неспаренному электрону
1s
2s 2p
а симметричная шестивершинная фигура – это октаэдр.
115
Углерод в возбужденном состоянии имеет четыре неспаренных электрона, которые образуют связи с атомами хлора:
1s
2s 2p
Происходит sp3-гибридизация и электроны гибридизованных орбиталей образуют четыре -связи под углом 109,280.
Сера в возбужденном состоянии имеет шесть неспаренных электронов:
1s
2s 2p
3s 3p 3d
Происходит sp3d2-гибридизация и электроны гибридизованных орбиталей образуют -связи с шестью атомами фтора, у каждого из которых по одному неспаренному электрону
1s
2s 2p
а симметричная шестивершинная фигура – это октаэдр.
117
б) NCl5 , так как азот имеет только три неспраренных электрона и нет возможности для распаривания (2d –подуровня не существует)
1s
2s 2p
в) SF7 , так как сера в возбужденном состоянии имеет максимум только шесть неспраренных электронов
1s
2s 2p
2s 2p 3d
118
Фосфор в возбужденном состоянии имеет пять неспраренных электронов
1s
2s 2p
2s 2p 3d
Отсюда видно, что происходит sp3d-гибридизация. Очевидно, молекула пентафторида фосфора имеет вид трехгранной бипирамиды.
№119
Существование каких из приведенных ниже молекул согласно теории ВС невозможно
А)![]() б)
б)![]() в)
в)![]() г)
г)![]() д)
д)![]() Почему?
Почему?
Решение:
В теории ВС связь осуществляется за счет взаимодействия гибридных орбиталей центрального атома с орбиталями атомов других элементов.
С точки зрения
ВС связь в молекулах
![]() и
и
![]() невозможна, поскольку центральный атом
кислорода имеет электронную конфигурацию
невозможна, поскольку центральный атом
кислорода имеет электронную конфигурацию
![]() ,
d-орбитали на втором
энергетическом уровне нет, поэтому
валентные орбитали могут предоставлять
только2 электрона на образование связи,
образовывая sp-гибридные
орбитали. В приведенных формулах
центральный атом образовывает связи с
более, чем 2 атомами, следовательно,
такие молекулы невозможны.
,
d-орбитали на втором
энергетическом уровне нет, поэтому
валентные орбитали могут предоставлять
только2 электрона на образование связи,
образовывая sp-гибридные
орбитали. В приведенных формулах
центральный атом образовывает связи с
более, чем 2 атомами, следовательно,
такие молекулы невозможны.
120
Электронная конфигурация атома фосфора в [PCl4]+:
1s
2s 2p
2s 2p 3d
Отсюда видно, что происходит sp3-гибридизация. Очевидно, катион тетрахлорида фосфора имеет тетраэдрический вид.
Электронная конфигурация атома фосфора в [PCl6]-:
1s
2s 2p
2s 2p 3d
Отсюда видно, что происходит sp3d2-гибридизация. Очевидно, анион гексахлорида фосфора имеет октаэдрический вид.
121
Звездочкой обозначены разрыхляющие молекулярные орбитали.
| |
| 2рх* | | |
| 2ру* 2рz* |
| |
2px 2py 2pz | | 2pz 2py 2px
| |
| 2ру 2рz |
| |
| 2рх | | |
| |
| 2s* |
| |
2s | | 2s
| |
| 2s |
О2 [ KK (s)2 (s*)2 (px)2 (py)2 (pz)2 py* pz* ]
Парамагнетизм кислорода объясняется наличием двух неспаренных электронов на р*-молекулярных орбиталях.
122
Звездочкой обозначены разрыхляющие молекулярные орбитали.
| |
| 2рх* | | |
| 2ру* 2рz* |
| |
2px 2py 2pz | | 2pz 2py 2px
| |
| 2рх |
| |
| 2ру 2рz |
| |
| |
| 2s* |
| |
2s | | 2s
| |
| 2s |
N2 [ KK (s)2 (s*)2 (py)2 (pz)2 (px)2 ]
Большая энергия диссоциации объясняется отсутствием электронов на верхних разрыхляющих молекулярных орбиталях.
123
Звездочкой обозначены разрыхляющие молекулярные орбитали.
| |
| 2рх* | | |
| 2ру* 2рz* |
| |
2px 2py 2pz | | 2pz 2py 2px
| |
| 2ру 2рz |
| |
| 2рх | | |
| |
| 2s* |
| |
2s | | 2s
| |
| 2s |
F2 [ KK (s)2 (s*)2 (px)2 (py)2 (pz)2 (py*)2 (pz*)2 ]
124
Звездочкой обозначены разрыхляющие молекулярные орбитали.
Атомные орбитали N Молекулярные Атомные орбитали О
орбитали
| |
| 2рх* | | |
| 2ру* 2рz* |
| |
2pz 2py 2px | |
| |
| | 2px 2py 2pz | |
| 2рх |
| |
| 2ру 2рz |
| |
| |
| 2s* |
| |
2s | | 2s
| |
| 2s |
NО [ KK (s)2 (s*)2 (py)2 (pz)2 (px)2 py*]
Порядок связи равен (10 – 5) / 2 = 2.5
№125
Какая форма записи отражает строение гетероядерной молекулы СО в методе МО? Приведите энергетическую схему строения этой молекулы. Чему равен порядок связи в этой молекуле?
Решение:
Энергетическая схема строения СО
Атомная орбиталь С Молекулярная орбиталь СО Атомная орбиталь О
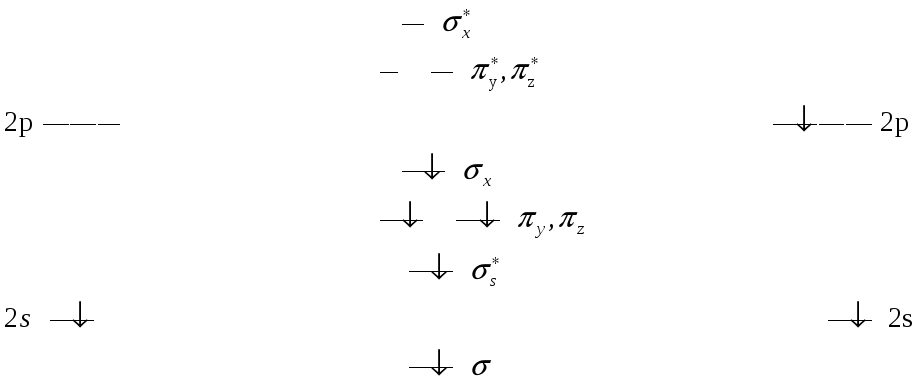
10 валентных электронов в молекуле СО располагаются следующим образом:
![]()
Порядок связи в молекуле СО = ½ (количество электронов на связывающих орбиталях – количество электронов на разрыхляющих орбиталях) = (8-2):2=3
126
Звездочкой обозначены разрыхляющие молекулярные орбитали. Для молекулы Не2:
| |
| 1s* |
| |
1s | | 1s
| |
| 1s |
и порядок связи равен (2 – 2) / 2 = 0, поэтому молекула не существует.
Очевидно у Не2+ будет удаляться один электрон с разрыхляющей орбитали
Не2+ [ (s)2 s* ], порядок связи тогда равен (2 – 1) / 2 = 0.5. Можно предполагать парамагнетизм этого иона из-за наличия одного неспаренного электрона на молекулярных орбиталях.
127
Звездочкой обозначены разрыхляющие молекулярные орбитали. Для молекулы f2:
| |
| 2рх* | | |
| 2ру* 2рz* |
| |
2px 2py 2pz | | 2pz 2py 2px
| |
| 2ру 2рz |
| |
| 2рх | | |
| |
| 2s* |
| |
2s | | 2s
| |
| 2s |
F2 [ KK (s)2 (s*)2 (px)2 (py)2 (pz)2 (py*)2 (pz*)2 ]
и порядок связи равен (10 – 8) / 2 = 1. Очевидно у F2+ будет удаляться один электрон с разрыхляющей орбитали
F2+ [ KK (s)2 (s*)2 (px)2 (py)2 (pz)2 (py*)2 pz* ]
порядок связи тогда равен (10 – 7) / 2 = 1.5.
Таким образом, более высокая энергия связи объясняется более высоким её порядком.
128
Звездочкой обозначены разрыхляющие молекулярные орбитали. Для молекулы о2:
| |
| 2рх* | | |
| 2ру* 2рz* |
| |
2px 2py 2pz | | 2pz 2py 2px
| |
| 2ру 2рz |
| |
| 2рх | | |
| |
| 2s* |
| |
2s | | 2s
| |
| 2s |
О2 [ KK (s)2 (s*)2 (px)2 (py)2 (pz)2 py* pz* ]и порядок связи равен (10 – 6) / 2 = 2. Очевидно у О2+ будет удаляться один электрон с разрыхляющей орбитали
О2+ [ KK (s)2 (s*)2 (px)2 (py)2 (pz)2 py* ]
порядок связи тогда равен (10 – 5) / 2 = 2.5.
Таким образом, более высокая энергия связи объясняется более высоким её порядком.
128
Звездочкой обозначены разрыхляющие молекулярные орбитали. Для молекулы о2:
| |
| 2рх* | | |
| 2ру* 2рz* |
| |
2px 2py 2pz | | 2pz 2py 2px
| |
| 2ру 2рz |
| |
| 2рх | | |
| |
| 2s* |
| |
2s | | 2s
| |
| 2s |
О2 [ KK (s)2 (s*)2 (px)2 (py)2 (pz)2 py* pz* ]и порядок связи равен (10 – 6) / 2 = 2. Очевидно у О2+ будет удаляться один электрон с разрыхляющей орбитали
О2+ [ KK (s)2 (s*)2 (px)2 (py)2 (pz)2 py* ]
порядок связи тогда равен (10 – 5) / 2 = 2.5.
Таким образом, более высокая энергия связи объясняется более высоким её порядком.
130
Звездочкой обозначены разрыхляющие молекулярные орбитали.
N2 [ KK (s)2 (s*)2 (py)2 (pz)2 (px)2 ]
n = (10 – 4) / 2 = 3
N2+ [ KK (s)2 (s*)2 (py)2 (pz)2 px ]
n = (9 – 4) / 2 = 2.5
Энергия связи в молекуле азота больше чем в соответствующем ионе из-за более высокого порядка связи.
О2 [ KK (s)2 (s*)2 (px)2 (py)2 (pz)2 py* pz* ]
n = (10 – 6) / 2 = 2
О2+ [ KK (s)2 (s*)2 (px)2 (py)2 (pz)2 py* ]
n = (10 – 5) / 2 = 2.5
Энергия связи в молекуле кислорода меньше чем в соответствующем ионе из-за более низкого порядка связи.
131
Звездочкой обозначены разрыхляющие молекулярные орбитали. Для молекулы О2:
| |
| 2рх* | | |
| 2ру* 2рz* |
| |
2px 2py 2pz | | 2pz 2py 2px
| |
| 2ру 2рz |
| |
| 2рх | | |
| |
| 2s* |
| |
2s | | 2s
| |
| 2s |
О2 [ KK (s)2 (s*)2 (px)2 (py)2 (pz)2 py* pz* ] и порядок связи равен (10 – 6) / 2 = 2. Очевидно у О2+ будет удаляться один электрон с разрыхляющей орбитали
О2+ [ KK (s)2 (s*)2 (px)2 (py)2 (pz)2 py* ]
порядок связи тогда равен (10 – 5) / 2 = 2.5.
132
Звездочкой обозначены разрыхляющие молекулярные орбитали.
Для иона Н2-:
Атомные орбитали H | Молекулярные | Атомные орбитали H-
| орбитали |
| |
| 1s* |
| |
1s | | 1s
| |
| 1s |
Видно что два электрона находятся на связывающей и один электрон на разрыхляющей молекулярной орбитали.
Отсюда порядок связи равен (2 – 1) / 2 = 0.5
133
Звездочкой обозначены разрыхляющие молекулярные орбитали.
О2 [ KK (s)2 (s*)2 (px)2 (py)2 (pz)2 py* pz* ]
n = (10 – 6) / 2 = 2 парамагнитна
О2+ [ KK (s)2 (s*)2 (px)2 (py)2 (pz)2 py* ]
n = (10 – 5) / 2 = 2.5 парамагнитна
О2- [ KK (s)2 (s*)2 (px)2 (py)2 (pz)2 (py*)2 pz* ]
n = (10 – 7) / 2 = 1.5 парамагнитна
О22- [ KK (s)2 (s*)2 (px)2 (py)2 (pz)2 (py*)2 (pz*)2 ]
n = (10 – 8) / 2 = 1. диамагнитна
№135
Какая формула
записи в методе МО отражает строение
молекулярных частиц
![]() и
и
![]() ?
Чему равен порядок (кратность) связи в
этих частицах? Какая частица имеет
большую энергию связи и какая является
парамагнитной?
?
Чему равен порядок (кратность) связи в
этих частицах? Какая частица имеет
большую энергию связи и какая является
парамагнитной?
Строение молекулы хлора с точки зрения МО
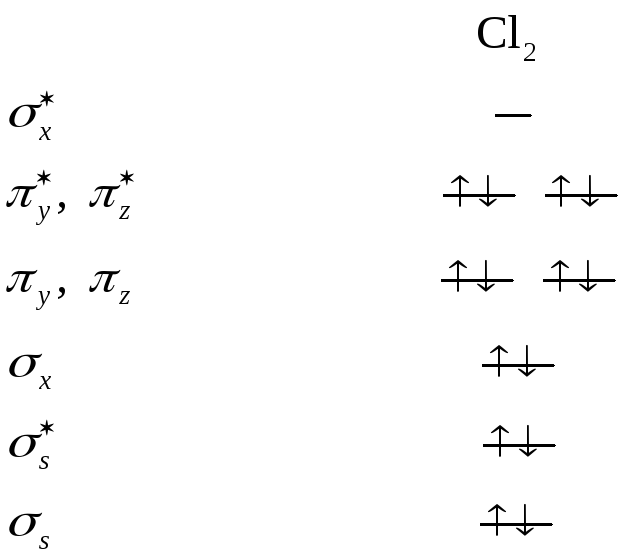
Электронную конфигурацию молекулы хлора можно записать следующим образом:
![]()
В молекуле хлора нет неспаренных электронов, поэтому молекула хлора не является парамагнитной.
Порядок связи=(число электронов на связывающих орбиталях – число электронов на разрыхляющих орбиталях): 2 = (8 – 6) : 2 = 1
Строение
![]() с точки зрения МО
с точки зрения МО

Электронную конфигурацию молекулы хлора можно записать следующим образом:
![]()
В частице
![]() один
неспаренный электрон, поэтому частица
является парамагнитной.
один
неспаренный электрон, поэтому частица
является парамагнитной.
Порядок связи=(число электронов на связывающих орбиталях – число электронов на разрыхляющих орбиталях): 2 = (8 – 5) : 2 = 1,5
Молекула
хлора имеет меньшую энергию диссоциации,
в частице
![]() энергия диссоциации выше за счет удаления
электрона с разрыхляющей орбитали.
энергия диссоциации выше за счет удаления
электрона с разрыхляющей орбитали.
№136
Исходя из
степени окисления марганца, серы и азота
в соединениях
![]() ,
,
![]()
![]() ,
определите, какое из них окислитель,
какое восстановитель и какое может
проявлять как окислительные так и
восстановительные свойства. Почему? На
основании электронных уравнений
расставьте коэффициенты в уравнении
реакции, идущей по схеме.
,
определите, какое из них окислитель,
какое восстановитель и какое может
проявлять как окислительные так и
восстановительные свойства. Почему? На
основании электронных уравнений
расставьте коэффициенты в уравнении
реакции, идущей по схеме.
![]()
Решение:
Степень
окисления марганца в перманганате
![]() максимальная, поэтому марганец может
проявлять только окислительные свойства.
максимальная, поэтому марганец может
проявлять только окислительные свойства.
Степень
окисления серы в сероводороде
![]() минимальная, поэтому сера может быть
только восстановителем.
минимальная, поэтому сера может быть
только восстановителем.
Степень
окисления азота в азотистой кислоте
![]() промежуточная, поэтому азот может
проявлять и окислительные и восстановительные
свойства.
промежуточная, поэтому азот может
проявлять и окислительные и восстановительные
свойства.
![]()
![]() (восстановление, окислитель)
(восстановление, окислитель)
![]() (окисление, восстановитель)
(окисление, восстановитель)
137
K2Cr2O7 может быть только окислителем, т. к. +6 это максимальная степень окисления хрома.
KI может быть только восстановителем, т. к. -1 это минимальная степень окисления йода.
H2SO3 может быть окислителем и восстановителем, т. к. +4 это промежуточная степень окисления серы (-2, 0, +4, +6).
H3AsO3 восстановитель (окисляется) As3+ - 2e = As5+ / 5
KMnO4 окислитель (восстанавливается) Mn7+ + 5e = Mn2+ / 2
2KMnO4 + 5H3AsO3 + 3H2SO4 = 5H3AsO4 + 2MnSO4 + K2SO4 + 3H2O
138
Азотистая кислота HNO2 может проявлять окислительные и восстановительные свойства, т. к. +3 это промежуточная степень окисления азота (от –3 до +5).
восстановление Mn7+ + 3e = Mn4+ / 2
окисление S4+ - 2e = S6+ / 3
2KMnO4 + 3Na2SO3 + H2O = 2MnO2 + 3Na2SO4 + 2KOH
139
Сернистая кислота H2SO3 может проявлять окислительные и восстановительные свойства, т. к. +4 это промежуточная степень окисления cеры (от –2 до +6).
восстановление Сl+ + 2e = Cl- / 3
окисление Cr3+ - 3e = Cr6+ / 2
2CrCl3 + 3NaClO + 10NaOH = 2Na2CrO4 + 9NaCl + 5H2O
140
Для реакций диспропорционирования характерно то, что окислителем и восстановителем одновременно является один и тот же элемент в данном соединении. Этот элемент должен находиться в промежуточной степени окисления.
восстановление N2- + e = N3- / 4
окисление 2N2- - 4e = N2 / 1
3N2H4 = 4NH3 + N2
восстановление O- + e = O2- / 2
окисление 2O- - 2e = O2 / 1
2H2O2 = 2H2O + O2
восстановление S4+ + 6e = S2- / 2 / 1
окисление S4+ - 2e = S6+ / 6 / 3
4K2SO3 = K2S + 3K2SO4
№141
Какие реакции называют реакциями внутримолекулярного окисления-восстановления? На основании электронных уравнений допишите уравнения реакций:
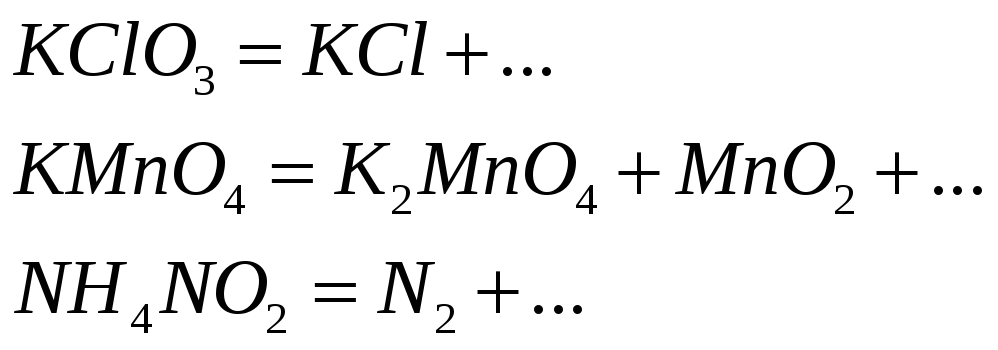
К реакциям внутримолекулярного окисления-восстановления относят такие реакции, в которых окислитель и восстановитель находятся в составе одной и той же молекулы:
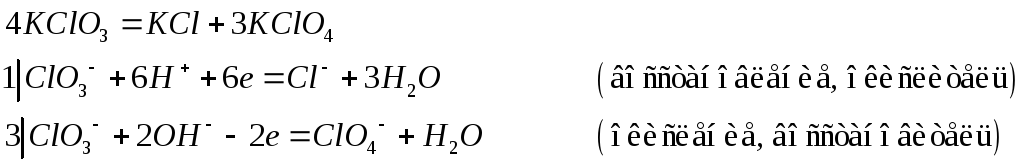
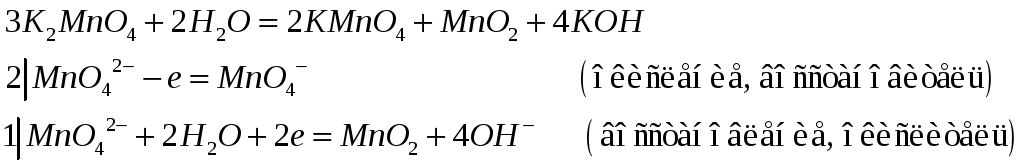

142
Самый сильный восстановитель – атом франция (наименьшая электроотрицательность). Самый энергичный окислитель – атом фтора (максимальная электроотрицательность).
восстановление N5+ + e = N4+ / 8
окисление As3- - 8e = As5+ / 1
AsH3 + 8HNO3 = H3AsO4 + 8NO2 + 4H2O
143
Для реакций диспропорционирования характерно то, что окислителем и восстановителем одновременно является один и тот же элемент в данном соединении. Этот элемент должен находиться в промежуточной степени окисления. А для атомов р-элементов нулевая степень окисления часто является промежуточной.
восстановление P0 + 3e = P3- / 3 / 1
окисление P0 - 3e = P3+ / 3 / 1
2P + KOH + 2H2O = KH2PO3 + PH3
восстановление I2 + 2e = 2I- / 10 / 5
окисление I2 - 10e = 2I5+ / 2 / 1
6I2 + 6Ba(OH)2 = Ba(IO3)2 + 5BaI2 + 6H2O
143
Для реакций диспропорционирования характерно то, что окислителем и восстановителем одновременно является один и тот же элемент в данном соединении. Этот элемент должен находиться в промежуточной степени окисления. А для атомов р-элементов нулевая степень окисления часто является промежуточной.
восстановление P0 + 3e = P3- / 3 / 1
окисление P0 - 3e = P3+ / 3 / 1
2P + KOH + 2H2O = KH2PO3 + PH3
восстановление I2 + 2e = 2I- / 10 / 5
окисление I2 - 10e = 2I5+ / 2 / 1
6I2 + 6Ba(OH)2 = Ba(IO3)2 + 5BaI2 + 6H2O
144
Разложение муравьиной кислоты не является окислительно-восстановительной реакцией, т.к. не происходит изменения степени окисления углерода +2.
CH3OH восстановитель (окисляется) C2- - 4e = C2+ / 5
KMnO4 окислитель (восстанавливается) Mn7+ + 5e = Mn2+ / 4
4KMnO4 + 5CH3OH + 6H2SO4 = 5HCOOH + 4MnSO4 + 2K2SO4 + 11H2O
145
