
Методичка_Громов
.pdf
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Московский физико-технический институт (государственный университет)
СУПРАМОЛЕКУЛЯРНАЯ ХИМИЯ СВЕТОЧУВСТВИТЕЛЬНЫХ
И СВЕТОИЗЛУЧАЮЩИХ СИСТЕМ
Рекомендовано Учебно-методическим советом Московского физико-технического института (государственного университета)
в качестве учебного пособия для студентов высших учебных заведений
по направлению “Прикладные математика и физика”
МОСКВА 2011

Авторы:
С.П. Громов, Е.Н. Ушаков, Н.А. Лобова, М.В. Фомина, С.Н. Дмитриева, А.И. Ведерников
УДК 547.535.661.3
Г87
Рецензенты:
Кафедра органической химии Российского университета дружбы
Доктор химических наук, профессор А.А. Ходонов
Т87 Супрамолекулярная химия светочувствительных и светоизлучающих систем /
С.П. Громов, А.И. Ведерников, Е.Н. Ушаков и др.: Учеб. пособие. – М.: МФТИ,
2011.– 88 с.
ISBN 5-7417-0194-9
Учебное пособие является частью лекционного курса Супрамолекулярная химия, читаемого авторами в Московском физико-техническом институте на кафедре физики супрамолекулярных систем и нанофотоники факультета молекулярной и биологической физики.
Подробно изложены различные теоретические концепции, объясняющие природу фотохромизма и люминесценции супрамолекулярных систем на основе органических соединений, основные экспериментальные методы их исследования. Рассмотрены отдельные классы фотохромных соединений и люминофоров, Проведен анализ тенденций в области поиска эффективных светочувствительных и светоизлучающих супрамолекулярных систем, представляющих наибольший интерес для практического использования.
Предназначено для студентов, специализирующихся в области физики супрамолекулярных систем и нанофотоники.
|
|
УДК 547.535.661.3 |
|
© Московский физико-технический институт |
|
|
(государственный университет), 2011 |
|
ISBN 5-7417-0194-9 |
© Коллектив авторов, 2011 |
|
2
ПРЕДИСЛОВИЕ
Синтезу и применению фотохромных соединений и органических люминофоров посвящено немало монографий и сборников, однако среди них нет учебного пособия посвященного супрамолекулярной химии светочувствительных и светоизлучающих систем, несмотря на очень большое число статей в данном направлении. Наше учебное пособие – первое на эту тему. Учебное пособие подготовлено группой авторов, сотрудников Центра фотохимии Российской академии наук и Института проблем химической физики Российской академии наук. Авторский коллектив – не случайное собрание специалистов по разным аспектам проблемы, а члены единого творческого коллектива, с 1988 г работавшего в рассматриваемом направлении. Кроме того все соавторы пособия читают лекции студентам Московского физико-технического института (государственного университета) и Московской академии тонкой химической технологии им. М. В. Ломоносова по избранным направлениям. В известной мере учебное пособие обобщает опыт накопленный коллективом в этой области.
Вводные главы 1-6 и главы 11, 12 по супрамолекулярной фотохимии кавитандов написаны снс, кхн Н. А. Лобовой. Главы 7, 8, посвященные принципам дизайна оптических молекулярных сенсоров и фотоуправляемых рецепторов на основе краун-эфиров, подготовлены внс, дхн Е. Н. Ушаковым и снс, кхн С. Н. Дмитриевой. Главы 9 и 10, связанные с металлокомплексными люминофорами и их использованием, написала снс, кхн М. В. Фомина. Главы 13 и 14 об использовании электронной спектроскопии, главы 15 и 16 спектроскопии ЯМР и рентгеноструктурного анализа в супрамолекулярной фотохимии подготовлены внс, дхн Е. Н. Ушаковым и внс, кхн А. И. Ведерниковым соответственно. Научными редакторами глав 1-6, 11 и 12 является внс, кхн А. И. Ведерников, глав 7 – 10 - внс, дхн Е. Н. Ушаков. Чл.-корр. РАН С. П. Громов написал главу 17 о молекулярном конструировании светочувствительных и светоизлучающих супрамолекулярных систем на основе непредельных и макроциклических соединений, осуществил общее редактирование, скомпоновал весь материал, подготовил Предисловие и Введение.
Учебное пособие предназначено для студентов специализирующихся в области физики супрамолекулярных систем и нанофотоники, а также для всех тех, кто интересуется супрамолекулярной химией.
Чл.-корр. РАН, проф. С. П. Громов
3
ОГЛАВЛЕНИЕ
Введение. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Глава 1. Пространственное строение органических соединений. . . . . . .
Глава 2. Пространственное строение соединений азота и координационных соединений. . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Глава 3. Основные классы фотохромных соединений. . . . . . . . . . . . . . . .
Глава 4. Органические люминофоры. . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Глава 5. Введение в супрамолекулярную химию. . . . . . . . . . . . . . . . . . . .
Глава 6. Молекулярное распознавание ионов металлов и молекул органических соединений. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Глава 7. Оптические молекулярные сенсоры на катионы металлов и аммония на основе краун-эфиров. . . . . . . . . . . . . . . . . . . . . . . . . .
Глава 8. Фотоуправляемые рецепторы на основе краун-эфиров. . . . . . .
Глава 9. Металлокомплексные люминофоры. . . . . . . . . . . . . . . . . . . . . . .
Глава 10. Фотохимия супрамолекулярных систем на основе металлокомплексных люминофоров. . . . . . . . . . . . . . . . . . . . . . .
Глава 11. Строение, физико-химические свойства кавитандов и комплексов на их основе. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Глава 12. Молекулярные устройства и машины на основе кавитандов.
Глава 13. Электронная спектроскопия в супрамолекулярной химии. . . .
Глава 14. Фотохимически активные супрамолекулярные системы. . . . .
Глава 15. Спектроскопия ЯМР супрамолекулярных систем. . . . . . . . . . .
Глава 16. Рентгеноструктурный анализ супрамолекулярных архитектур. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Глава 17. Светочувствительные и светоизлучающие
супрамолекулярные системы на основе непредельных и макроциклических соединений. . . . . . . . . . . . . . . . . . . . . . . . . . . .
Заключение. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
4
Г Л А В А 1. ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ОРГАНИЧЕСКИХ
СОЕДИНЕНИЙ
Органическая химия – это наука, изучающая органические соединения. В середине XIX века Кекуле определил органические соединения как соединения углерода с другими элементами. Определение это нестрогое, так как некоторые углеродсодержащие соединения традиционно относят к неорганическим (например, оксиды углерода, карбиды, угольная кислота и ее соли). Тем не менее, число известных органических соединений в десятки раз превышает число неорганических, и ежегодно увеличивается примерно на 300 тысяч, к настоящему времени составляя более 10 миллионов. Такое многообразие обусловлено способностью атомов углерода соединяться друг с другом с образованием цепей, циклов и других каркасов с практически неограниченным числом атомов углерода. Углерод образует соединения со многими элементами. Особенно распространены его соединения с так называемыми элементами-органогенами, главными из которых являются кислород, азот, галогены, сера, фосфор.
Истоки органической химии уходят в глубокую древность. Спиртовое и уксуснокислое брожение, растительные красители известны с давних времен. XVI век – период ятрохимии, когда исследования были направлены в основном на выделение лекарств. Систематическое изучение органических соединений началось во второй половине XVIII века. И тогда же появляются первые теоретические представления органической химии – теория радикалов, теория типов, понятия валентности и химической связи. Решающий вклад в создание теории строения органических соединений (1861 г.) принадлежит великому русскому химику А.М. Бутлерову. Главное положение этой теории звучит так: свойства соединений зависят не только от природы и числа входящих в них атомов, но и от химического строения молекул, под которым понимается определенная последовательность связей между атомами.
В основу современной классификации органических соединений положены два важнейших признака:
-строение углеродного скелета;
-наличие в молекуле функциональных групп.
По строению углеродного скелета органические соединения делятся на группы:
-ациклические (алифатические) – соединения, в которых цепь атомов углерода может быть неразветвленной или разветвленной;
-карбоциклические соединения, в которых цепь из атомов углерода замкнута в цикл;
5

-гетероциклические соединения, имеющие в составе циклического скелета, кроме
атомов углерода, один или несколько гетероатомов – как правило, атомы азота, кислорода и серы.
Функциональные группы – это атомы или группы атомов, определяющие химические свойства соединения и принадлежность его к определенному классу.
Для органических веществ помимо структурной изомерии (изомерии строения) возможна пространственная изомерия или стереоизомерия. Стереоизомеры – это соединения с одинаковым строением, т.е. с одним и тем же порядком соединения атомов, но отличающиеся расположением тех же атомов в пространстве. Для изображения пространственного строения молекул на плоскости применяют различные стереохимические и проекционные формулы. Существует несколько типов молекулярных моделей:
CH3COOH |
|
|
модели Дрейдинга |
|
|
CH3COOH |
|
||||
Шаростержневые модели |
|
|
полусферические модели |
||||||||
|
|
|
|
|
|
|
|
|
|
||
За плоскостью |
В плоскости |
|
|
H |
|
H |
3 |
|
3 |
H |
|
|
|
|
|
|
|
2 |
H |
||||
|
|
|
OH |
1 |
2 |
|
CH3 |
H3C |
1 |
||
|
|
|
|
|
|
|
|||||
|
|
|
H |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
H |
|
Br |
||
|
|
H |
H |
Br |
|
H |
|
|
H |
||
|
|
|
|
|
|
|
|
|
|||
|
|
H |
|
|
|
|
|
|
|
||
|
|
|
|
3 |
2 |
1 |
|
|
|
|
|
Перед плоскостью |
Метанол |
|
|
|
|
|
|||||
|
CH3CH2CH2Br |
|
|
|
|||||||
стереохимические формулы |
|
1-бромопропан |
|
|
|
||||||
|
проекционные формулы Ньюмена |
|
|||||||||
|
|
|
|
|
|||||||
|
|
|
COOH |
COOH |
|
COOH |
|
|
|
||
|
H |
|
|
|
|
|
|
||||
|
|
|
H |
|
|
|
|
|
|
|
|
|
HO |
|
|
H |
|
|
|
OH |
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
|
|
H |
|
|
|
OH |
|
|
|
|
|
COOH |
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
COOH |
|
COOH |
|
|
|
||
|
|
|
|
|
|
|
|
|
|||
|
проекционные формулы Фишера |
|
|
|
|
|
|
|
|||
Рисунок 1 – Изображениие пространственного строения молекул. |
|
|
|
|
|
|
|
||||
6

К настоящему времени разработано множество компьютерных программ, позволяющих строить стереохимические формулы и рассматривать их в пространстве.
Все окружающие нас предметы с точки зрения наличия или отсутствия у них элементов симметрии можно разделить на хиральные и ахиральные.
 C
C
б
а
Рисунок 2 – Ахиральные (а) и хиральные (б) объекты.
Хиральностью (от греч. сheir – рука) называют свойство объекта быть несовместимым со своим зеркальным изображением. Хиральные тела характеризуются тем, что у них отсутствуют плоскости и центры симметрии. В то же время они могут иметь оси симметрии.
Плоскость симметрии σ делит тело на две части так, что обе они являются зеркальным изображением друг друга. Центр симметрии i – точка, на равном расстоянии от которой на одной прямой находятся две равноценные точки данного тела. Ось симметрии n-ного порядка Сn – это ось, проходящая через тело, при повороте вокруг которой на угол 360°/n возникает фигура, идентичная исходной, т.е. все точки тела станут занимать положения, аналогичные тем, которые они занимали до поворота. В обычной жизни хиральными объектами являются кисти рук, перчатки, ступни, болты с правой и левой резьбой.
Симметрийные отношения проявляются и на молекулярном уровне. Молекулы (органические и неорганические), как геометрические тела, могут быть хиральными и ахиральными.
7
метан
бутанол-2
Рисунок 3 – Симметрия молекул.
Например, молекула метана имеет шесть плоскостей симметрии, проходящих через каждую пару связей С–Н, а молекула этанола – всего одну, проходящую через связи С–С–О. Если в молекуле этанола заместить один из атомов на этильный радикал, получится хиральная молекула бутанола-2, у которой нет плоскостей и центров симметрии.
Причиной хиральности молекулы является наличие в ней асимметрического атома углерода. Одно соединение может существовать в виде молекул двух типов, отличающихся расположением четырех атомных групп у асимметрического атома углерода. Такие молекулы не совместимы в пространстве и похожи друг на друга как предмет и его зеркальное изображение. Эти стереоизомеры называют энантиомерами. Энантиомеры имеют одну и ту же температуру плавления, давление пара, плотность, показатель преломления, кислотность, ИК-спектр, спектр ЯМР и одинаковую реакционную способность по отношению к обычным химическим реагентам. С позиций представлений симметрии все стереоизомеры разделяют на энантиомеры и диастереомеры. Стереоизомеры, молекулы которых не относятся друг к другу как предмет и несовместимое с ним зеркальное изображение, называются диастереомерами. Диастереомеры отличаются температурами плавления и кипения, имеют разную плотность, показатели преломления, растворимость, дипольные моменты. Оптическая активность диастереомеров отличается по знаку и величине угла. Из диастереомеров могут образовываться разные по стороению вещества. Понятия диастереомерии и энантиомерии являются взаимоисключающими, следовательно, других типов стереоизомеров, имеющих разные симметрийные характеристики, существовать не может в принципе.
Оптическая активность является важным свойством, и проявляется при прохождении через растворы хиральных веществ плоскополяризованного света (то есть света, пропущенного через призму Николя, изготовленную из кристалла исландского шпата).
8

Плоскополяризованный свет можно представить как осциллирующий вектор, возникающий в результате сложения двух противоположнозакрученных (циркуляционно поляризованных) составляющих.
Возникновение оптической активности у хиральных соединений связано с тем, что скорость распространения левого и правого циркуляционно поляризованных компонентов в хиральной среде неодинакова. Измерение оптической активности производят в поляриметре. Угол отклонения плоскости поляризации называется углом вращения, он может быть измерен с точностью до 0.001°. Поскольку угол вращения зависит от толщины слоя оптически активного вещества и его концентрации в растворе, угол вращения пересчитывают на удельное вращение [α]=α/lc. Удельное вращение представляет собой константу вещества. Для тех веществ, у которых не установлена конфигурация центров хиральности, удельное вращение является единственной характеристикой стереоизомеров.
С позиций их относительной устойчивости стереоизомеры разделяют на
конфигурационные и конформационные. Конфигурационные стереоизомеры характеризуются тем, что могут существовать в виде индивидуальных форм, т.е. обладают определенной конфигурационной устойчивостью. Каждый из них может быть выделен в виде самостоятельно существующего вещества, имеющего набор определенных физических и химических свойств, отличных от свойств другого стереоизомера. Конформационные стереоизомеры, или просто конформации, чаще всего возникают в результате вращения отдельных фрагментов молекул вокруг простых связей. Конформации могут существовать только все вместе в виде единого множества геометрических форм молекулы с различным взаимным расположением в пространстве отдельных атомов и атомных групп.
Исторически более ранняя система обозначения конфигурации центров хиральности – D,L-система – была предложена потому, что технические возможности того времени не позволяли установить абсолютную конфигурацию (истинное взаимное расположение атомов в молекуле). Было найдено сравнительно простое и остроумное решение – лево- и правовращающему глицериновому альдегиду формулы были приписаны произвольно, а затем конфигурацию других хиральных молекул сравнивали с конфигурацией одного из энантиомеров глицеринового альдегида.
|
CH=O |
|
CH=O |
||
HO |
|
H |
H |
|
OH |
|
|
||||
|
CH2OH |
|
CH2OH |
||
L(–)-глицериновый альдегид |
D(+)-глицериновый альдегид |
||||
Рисунок 4 – D,L-система обозначения конфигурации.
9

Поскольку D,L-система имеет ограниченное применение (например, существуют вещества, которые бессмысленно сравнивать с глицериновым альдегидом), чтобы установить конфигурации центров хиральности, сейчас используется система, предложенная Каном, Ингольдом и Прелогом в 1951 г. – R,S-система (от лат. Rectus – правый, Sinuster – левый). В ее основе лежит принцип старшинства заместителей, окружающих центр хиральности, или правило последовательности.
H C |
H |
H5C2 |
H |
5 2 |
|
|
HO |
H3C |
|
OH |
||
CH3 |
||
(S)-бутанол-2 |
||
(R)-бутанол-2 |
||
|
||
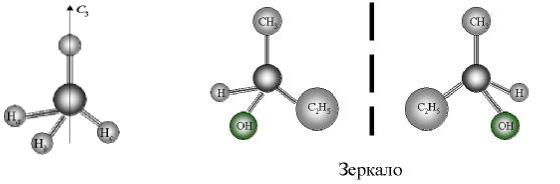
Рисунок 5 – R,S-система обозначения конфигурации. |
|
Сначала устанавливают порядок старшинства лигандов, потом молекулу располагают так, чтобы младший заместитель был удален от глаза наблюдателя, и смотрят в какую сторону снижается старшинство трех оставшихся заместителей.
Смесь равных количеств двух энантиомеров называют рацематом. Рацематы не обладают оптической активностью. Рацемическая смесь, как любая смесь двух веществ, имеет температуру плавления, растворимость и ряд других физических свойств (обусловленных строением кристаллической решетки), отличных от свойств каждого из ее компонентов. Индивидуальные энантиомерные формы могут подвергаться рацемизации, причем чем ниже конфигурационная устойчивость энантиомеров, тем быстрее и более мягких условиях протекает рацемизация.
Помимо различных заместителей у атома углерода, можно выделить еще некоторые причины возникновения хиральности:
1) Существуют соединения, молекулы которых не имеют аисмметрических атомов углерода или каких-либо других центров хиральности, но обладают осью хиральности.
10
