
Kristally
.pdfФедеральное агентство по образованию Государственное образовательное учреждение высшего профессионального образования «Казанский государственный технологический университет»
КРИСТАЛЛЫ. КРИСТАЛЛОГИДРАТЫ
Методические указания
к лабораторным работам
2006
Составители: доцент Н.Ш.Мифтахова доцент Т.П.Петрова доцент И.Ф. Рахматуллина
Кристаллы. Кристаллогидраты: Методические указания к лабораторным работам /Казан.гос.технол.ун-т; Сост.: Н.Ш.Мифтахова, Т.Н.Петрова, И.Ф. Рахматуллина. Казань, 2006. 24 с.
В настоящей работе приводятся некоторые сведения о кристаллах и описание лабораторных работ по экспериментальному изучению кристаллических веществ.
Методические указания предназначены для школьников старших классов школ с углубленным изучением химии, а также студентов 1 и 2 курсов вузов химико-технологического профиля.
Печатается по решению кафедры неорганической химии.
Под редакцией проф. Н.С.Ахметова
Рецензенты: доц. Г.Г. Гильманшин доц. В. А. Плешков
2
КРИСТАЛЛЫ. КРИСТАЛЛОГИДРАТЫ
Большинство неорганических соединений (около 90%) в обычных условиях являются кристаллическими веществами. Они встречаются в глубинах земли, горных вершинах, песчаных пустынях, на дне озер, морей, океанов. Их выращивают в научных химических лабораториях.
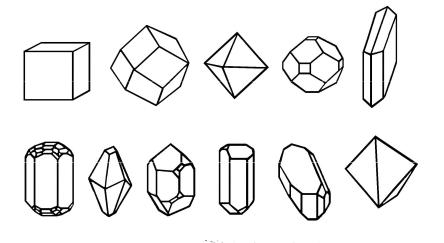
Отличительным внешним признаком кристалла является его форма. На рис.1 показаны кристаллы различных веществ.
а |
б |
в |
г |
д |
е |
ж |
з |
и |
к |
л |
|
Рис.1. Кристаллы веществ: |
а – хлорид |
натрия NaС1, |
б – |
гранат |
||
Ме3(II)Me2(III)[SiO4]з,* в – |
алмаз C, г |
– квасцы М(I)М(III)(SO4)2 |
||||
·12Н2O**, д – |
гипс CaSO4·2Н2O, е - берилл Be3Al2(SiO3)6, |
ж – |
кальцит |
|||
CaCO3, з - кварц SiO2, |
и – |
горькая соль MgSO4·7Н2O, к – |
медный |
|||
купорос CuSO4 · 5H2O***, л – |
трехводный сульфат меди (II) CuSO4 · |
|||||
3H2O. |
|
|
|
|
|
|
_______________________ |
|
|
|
|
||
*Гранаты Ме3(II)Ме2(III)[SiO4]3, где Ме(II) - Са2+, Fe2+, |
Мg2+, Мn2+, |
|||||
Ме(Ш) - AI3+, Fе2+, Cr3+ |
|
|
|
|
|
|
**Квасцы Мe(I)Me(III) (SO4)2· 12H2O, где Ме(I) – К+ и др., Ме(III) – Al3+ , Fе3+, Cr3+
***Купоросы Me(II)SO4 · nH2O, где Ме(II) – Сo2+, Fe2+, Мg2+, Мn2+, Cu2+, Ni2+, Zn2+ и т.д.
3
Кристаллы правильной формы (монокристаллы) встречаются в природе весьма редко. Обычно встречаются поликристаллы - сростки мелких кристаллов неправильной формы. Объясняется это тем, что при росте кристалла его теснят со всех сторон другие такие же кристаллы. Для выращивания монокристаллов требуются особые условия.
Внешняя форма кристаллов определяется их внутренним строением. Структурными единицами кристаллов являются атомы, ионы или молекулы. О расположении этих структурных единиц относительно друг друга в кристалле можно узнать, сделав его рентгеновский снимок.
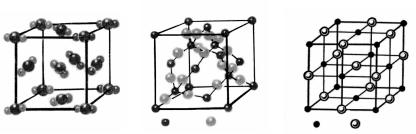
Внутреннюю структуру кристалла можно представить в виде кристаллической решетки, в узлах которой располагаются атомы, молекулы или ионы (рис. 2).
|
О |
|
Si |
|
Na |
|
Cl |
a |
|
|
|
|
|
|
|
б |
|
|
в |
||||
Рис.2. Кристаллические решетки соединений: а - сухой лед СO2, б - кварц SiO2, в - хлорид натрия NaCI.
Свойства кристаллов, естественно, зависят от природы образующих их частиц. В молекулярном кристалле молекулы связаны друг с другом слабыми силами межмолекулярного взаимодействия. Связи между молекулами легко разрываются при относительно низкой температуре. Поэтому вещества с молекулярным типом кристалла имеют относительно низкие температуры плавления, они летучи. Примерами веществ с молекулярным типом кристалла являются сухой лед - углекислый газ СО2 в твердом состоянии (рис.2), йод J2, нафталин С10Н8.
В атомных кристаллах связи между атомами прочные, они разрушаются лишь при сильном нагревании. Примерами соединений с
4
атомно-кристаллической решеткой являются кварц SiO2 (рис.2), корунд Al2O3. Эти вещества тугоплавки, в газовое состояние они переходят лишь при очень высокой температуре, например, кварц - при температуре 2590° С.
Для разрушения структуры ионного кристалла также требуется затратить большую энергию. Поэтому вещества с ионной кристаллической решеткой характеризуются высокой температурой плавления. Ионную кристаллическую решетку имеют соли (рис.2), щелочи (гидроксиды щелочных и щелочноземельных металлов).
Для практических целей используют как естественные кристаллы (минералы, горные породы, поделочные и драгоценные камни), так и выращенные искусственно. Кристаллы выращивают из растворов или расплавов веществ, а также из газовой среды. Из растворов легче всего вырастить кристаллы хорошо растворимых в воде веществ, например, квасцов, медного купороса, сахара, дигидрофосфата калия и др.
Гигантскими «фабриками» получения кристаллических веществ являются химические заводы, где вырабатывают соду, химические удобрения и многие другие соли. На металлургических заводах получает металлы.
При кристаллизации некоторых веществ (особенно солей) из водных растворов вода входит в состав кристаллов. Такие кристаллы называют кристаллогидратами (гидратами), а воду, входящую в их состав, - кристаллизационной. Количество кристаллизационной воды в кристаллогидрате указывают в его формуле. Например, запись
·2H2O означает, что один моль этого кристаллогидрата содержит один моль сульфата кальция и два моля воды.
Известны кристаллогидраты, содержащие большое количество воды, например, Na2SO4 ·10H2O (глауберова соль), MgSO4 · 7H2O (горькая соль) CuSO4 · 5H2O (медный купорос). Примером кристаллогидрата с малым содержанием воды является CaSO4 · 0,5H2О (алебастр) . В зависимости от условий кристаллизации (температуры, присутствия примесей) образуются кристаллогидраты разного состава. Так, для сульфата меди (II) известны три кристаллогидрата: CuSО4 ·H2О, CuSО4 · 3H2О, CuSО4 · 5H2О.
Частичное или полное обезвоживание кристаллогидратов приводит к изменению их структуры и окраски. Так, лазурно-синие
5
кристаллы медного купороса*, выветриваясь на воздухе, переходят в трехводный кристаллогидрат бледно-синего цвета. А при нагревании происходит полная дегидратация и образуется сульфат меди (II) белого цвета:
<1000C |
1500C |
CuSO4 · H2O |
2580C |
CuSO4 ·5H2O |
CuSO4 · 3H2O |
CuSO4 |
|
лазурно-синий |
бледно-синий |
голубой |
белый |
Прозрачные кристаллы Na2SO4 |
· 10H2O обезвоживаются при |
||
обычных условиях и рассыпаются в порошок. |
|
||
С некоторыми данными о кристаллогидратах и безводных солях Вы можете познакомиться из табл.1.
____________________________
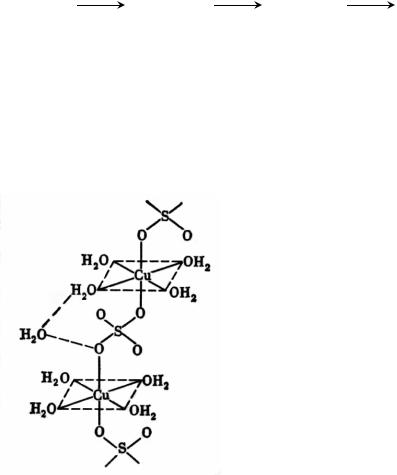
* В кристаллах CuSO4 · 5H2O каждый ион меди (II) окружен четырьмя молекулами воды и двумя атомами кислорода разных сульфат-ионов (рис.3). Пятая молекула воды не связана с ионом меди (II). Она является мостиком, объединяющим две молекулы воды из окружения ка- тионов меди (II) и два атома
кислорода сульфат-ионов.
Иное расположение частиц в кристаллах CuSO4 · 3H2O. Вокруг иона меди (II) располагаются три молекулы воды и три атома кислорода трех сульфат-ионов [3].
Рис.3. Кристаллическая структура CuSO4 · 5H2O
6
Таблица 1. Окраска кристаллогидратов, безводных солей и темпера- тура (оС) дегидратации кристаллогидратов, плавления или разложения безводных солей
Формула |
Окраска |
Окраска |
Температура |
Температура |
кристалло- |
кристалло- |
безводной |
дегидратации |
разложения, |
гидрата |
гидрата |
соли |
кристалло- |
плавления |
|
|
|
гидрата |
безводной |
|
|
|
|
соли |
1 |
2 |
3 |
4 |
5 |
FeSO4 · |
Бледно- |
Белый |
300 |
680 (разл.) |
7Н2O |
зеленый |
|
|
|
FeCI2 · |
Синевато- |
Бесцветный |
|
677 (пл.) |
4H2O |
зеленый |
|
|
|
FeCI3 · |
Темно- |
Перламут- |
|
303,9 (пл.) |
6H2O |
желтый |
ровый |
|
|
СоSO4· |
Красный |
Красный |
420 |
>600 |
7Н2O |
|
|
|
(разл.) |
СоС12 · |
Розовый |
Бледно- |
140 |
724 (пл.) |
6Н2O |
|
синий |
|
|
МgSO4 · |
Бесцветный |
Бесцветный |
237 |
1127 |
7Н2O |
|
|
|
(разл.) |
MnSO4· |
Розовый |
Бесцветный |
280 |
850 (разл.) |
7H2O |
|
|
|
|
МnСl2 · |
Светло- |
Розовый |
198 |
650 (пл.) |
4Н2O |
розовый |
|
|
|
Cu(NO3)2 · |
Синий |
Бесцветный |
258 |
|
7H20 |
|
|
|
|
СuSO4 · |
Лазурно- |
Белый |
110 |
653 (разл.) |
5Н2O |
синий |
|
|
|
CuCI2 · |
Темно- |
Темно- |
32,4 |
500 (разл.) |
2H2O |
зеленый |
коричневый |
|
|
Na2SO4 · |
Бесцветный |
Бесцветный |
100 |
884 (пл.) |
10H2O |
|
|
|
|
Na3РO4 · |
Бесцветный |
Бесцветный |
|
1340 (пл.) |
12Н2O |
|
|
|
|
7
Продолжение таблицы 1
1 |
2 |
3 |
4 |
5 |
NiSO4· |
Сине- |
Желтый |
280 |
840 (разл.) |
6H2O |
зеленый |
|
|
|
NiSO4· |
Изумрудно- |
Желтый |
|
840 (разл.) |
7H2O |
зеленый |
|
|
|
NiСl2· |
Травянисто- |
Золотисто- |
|
1009 (пл.) |
6H2O |
зеленый |
желтый |
|
|
CrСl3· |
Серо- |
Красно- |
|
1152 (пл.) |
6H2O |
голубой; |
фиолетовый |
|
|
|
светло- |
|
|
|
|
зеленый; |
|
|
|
|
изумрудно- |
|
|
|
|
зеленый |
|
|
|
Cr2( SO4)3 |
Фиолетовый |
Красно- |
>100 |
|
·18H2O |
|
фиолетовый |
|
|
ZnSO4· |
Бесцветный |
Бесцветный |
280 |
740 (разл.) |
7H2O |
|
|
|
|
Дегидратация кристаллогидрата – процесс эндотермический. Образование кристаллогидрата при гидратации вещества – процесс экзотермический. Количество теплоты, выделяющейся при присоединении кристаллизационной воды к одному молю безводного вещества, называют теплотой (энтальпией) гидратации.
Растворение соли можно представить в виде двух стадий: присоединение солью кристаллизационной воды с образованием кристаллогидрата; разрушение образованного кристаллогидрата большим количеством воды вследствие его растворения. Тогда, согласно закону Гесса теплоту (энтальпию) растворения безводной
соли ( Hораст. соли) можно выразить в виде алгебраической суммы теплоты (энтальпии) гидратации соли ( Hогидрат.) и теплоты (энтальпии) растворения образовавшегося кристаллогидрата
( Hораст. крист.).
8
Приведем термохимические уравнения растворения I моль карбоната натрия по стадиям:
1 Гидратация безводной соли Na2СO3:
Nа2СO3(к) + 10Н2O(ж) = Nа2СO3 ·10Н2O(к); Hогидрат. |
|
|||
2. Растворение кристаллогидрата Na2CO3 ·10Н2O: |
|
|||
Nа2СO3 ·10Н2O(к)+nН2O(ж) = 2Na+(р)+ CO32− (р)+(n +10)Н2O(р); |
Hораст. крист. |
|||
3. Растворение безводной соли Nа2СO3: |
|
|||
Nа2СO3(к) + (n + 10)Н2O(ж) = 2Na+(р) + CO32− (р) + (n +10)Н2O(р); |
Hораст. соли |
|||
или Nа2СO3(к) = 2Na+(р) + CO32− |
(р), Hораст. соли |
|
||
Тогда |
Hораст. соли = |
Hогидрат. + |
Hораст. крист. |
|
Отсюда |
Hогидрат. = |
Hораст. соли. - |
Hораст. крист. |
|
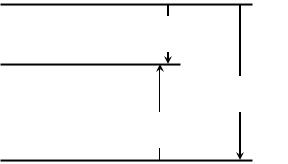
Приведенные рассуждения удобно представить в виде энтальпийной диаграммы, на которой откладывают экспериментальные значения энтальпий растворения безводной соли и ее кристаллогидрата. На рис. 4 приведена энтальпийная диаграмма растворения карбоната натрия.
Энтальпия
Na2CO3 (к)
-24,6 кДж
2Na+(p) + CO32−(p)
-91,2 кДж
+66,6 кДж
Na2CO3 ×10Н2О (к)
Рис.4. Энтальпийная диаграмма растворения карбоната натрия
9
Экспериментально установлено, что растворение карбоната натрия – экзотермический процесс, eго энтальпия растворения
Hораст. соли. = -24,6 кДж.
Растворение же десятиводного карбоната натрия –
эндотермический процесс, его энтальпия Hораст. крист. = 66,6 кДж [4]. По энтальпийной диаграмме (рис.4) можно вычислить энтальпию гидратации безводной соли:
Hогидрат. = Hораст. соли. - Hораст. крист.
Hогидрат. = -24,6кДж – 66,6 кДж = - 91,2кДж
Энтальпию гидратации вещества можно вычислить, используя
стандартные энтальпии образования H° обр. продукта |
реакции и |
|||
исходных веществ. |
|
|
|
|
Для рассматриваемого примера значения H° обр. |
приведены |
|||
под формулами веществ: |
|
|
|
|
Nа2СO3(к) + 10H2О(ж) = Na2СO3 ·10Н2O(к); Hогидрат. |
||||
H° обр. ,кДж/моль |
-1131,0 |
-285,83 |
-4083,5 |
|
Согласно закону Гесса |
|
|
|
|
Hогидрат. = [1моль · |
H° обр.( Na2СO3 · 10Н2O(к)) ] – |
|
||
– [1 моль · H° обр.( Na2СO3 (к)) + 10моль · ( |
H° обр.(Н2O(ж))]. |
|||
Hогидрат..= 1моль · (-4083кДж/моль) – [1 моль · (-1131кДж/моль) + |
||||
+ 10моль · (-285,83кДж/моль) |
= - 94,2кДж |
|
|
|
Лабораторная работа № I
Наблюдение кристаллов под микроскопом
В этой работе Вам предстоит: I) ознакомиться с внешней формой кристаллов некоторых веществ; 2) провести наблюдение под микроскопом образования по обменной реакции кристаллов: а) гипса CaSO4 · H2O; б) сульфата свинца PbSO4.
10
