
2013.Термодинамика / Свелин153-163_4а-10.10.2012
.doc

Рассмотрим
теперь диаграмму
состояния, показанную на рис. 59, при
температуре![]() .
Положение здесь до некоторой степени
более сложное, поскольку
.
Положение здесь до некоторой степени
более сложное, поскольку![]() выше
точки плавления компонента В,
и
поэтому стандартным состоянием компонента
В
ста
то не твердое, а жидкое. Между твердым
и жидким растворами невозможно провести
непрерывную кривую свободной энергии
поэтому потребуются две
выше
точки плавления компонента В,
и
поэтому стандартным состоянием компонента
В
ста
то не твердое, а жидкое. Между твердым
и жидким растворами невозможно провести
непрерывную кривую свободной энергии
поэтому потребуются две

другая— для жидкого раствора, что схематически представлено на рис. 61.
Д![]() ля
чистого компонента В
сплошная
кривая пересекает ось свободной энергии
в точке, равной отрицательному значению
свободной энергии плавления компонента
В.
Эта
точка представляет свободную энергию
образования твердого В
из
жидкого В.
ля
чистого компонента В
сплошная
кривая пересекает ось свободной энергии
в точке, равной отрицательному значению
свободной энергии плавления компонента
В.
Эта
точка представляет свободную энергию
образования твердого В
из
жидкого В.
![]() для
жидкого В
равна
нулю, поскольку это— стандартное
состояние. Подобным образом для чистого
компонента А
кривая
жидкого раствора пересекает ось свободной
энергии в точке, превышающей нуль,
поскольку для
твердого
А
равна
нулю при
для
жидкого В
равна
нулю, поскольку это— стандартное
состояние. Подобным образом для чистого
компонента А
кривая
жидкого раствора пересекает ось свободной
энергии в точке, превышающей нуль,
поскольку для
твердого
А
равна
нулю при![]() .
.
С![]() ледовательно,
когда
ледовательно,
когда
![]() (см.
рис. 61), твердый раствор устойчив, а когда
(см.
рис. 61), твердый раствор устойчив, а когда
![]() ,
будут существовать две фазы: твердая
фаза
,
будут существовать две фазы: твердая
фаза
![]() -состава
-состава
![]() и
жидкая фаза состава Тогда же
и
жидкая фаза состава Тогда же![]() ,
устойчив жидкий раствор.
,
устойчив жидкий раствор.
При
любой температуре можно легко рассчитать
значение
![]() и
и![]() ).
Для компонента В
в
точке плавления
).
Для компонента В
в
точке плавления
![]()
При
температуре, отличающейся от![]()
![]()
П![]() ренебрегая
небольшой температурной зависимостью
и
ренебрегая
небольшой температурной зависимостью
и![]() при
замещении
при
замещении![]() ,
находим
,
находим
![]() (10.4)
(10.4)
Для
компонента В
при![]() нас
интересует реакция
нас
интересует реакция![]() :
:
![]()
При
температуре выше точки плавления
компонента А
устойчивы
оба жидких компонента А
и В. Зависимость![]() от
от![]() для
жидкого и твердого растворов представлена
на рис. 62.
для
жидкого и твердого растворов представлена
на рис. 62.
Критическую
температуру![]() ,
связанную с пределом несмешиваемости,
показанным на диаграмме состояния рис.
59, определяют по величине теплоты
смешения. В качестве примера рассмотрим
предел несмешиваемости регулярного
раствора из-за легкости расчета систем
этого типа. Для такой системы
,
связанную с пределом несмешиваемости,
показанным на диаграмме состояния рис.
59, определяют по величине теплоты
смешения. В качестве примера рассмотрим
предел несмешиваемости регулярного
раствора из-за легкости расчета систем
этого типа. Для такой системы
![]()
 (10.5)
(10.5)
Рассчитаем
максимальную критическую температуру![]() ,
при которой
произойдет образование двухфазной
области, и состав раствора
,
при которой
произойдет образование двухфазной
области, и состав раствора![]() при
этой температуре. Эти точки показаны
на рис.
59. Выше температуры
при
этой температуре. Эти точки показаны
на рис.
59. Выше температуры![]() кривая
зависимости
кривая
зависимости![]() от
от![]() везде
будет вогнута вниз. Как уже говорилось,
ниже этой температуры будет два минимума
и две точки перегиба, где
везде
будет вогнута вниз. Как уже говорилось,
ниже этой температуры будет два минимума
и две точки перегиба, где
![]()
С
повышением температуры до![]() минимумы
будут сближаться по составу, а в результате
этого сблизятся и точки перегиба. При
минимумы
будут сближаться по составу, а в результате
этого сблизятся и точки перегиба. При![]() как
минимумы, так и точки изгиба совпадут.
как
минимумы, так и точки изгиба совпадут.
Таким
образом,
![]() —температура,
при которой как
—температура,
при которой как![]() Так
и
Так
и![]() равны
нулю при критическом составе
равны
нулю при критическом составе![]() .
Учитывая это, из уравнения (10.2), находим
.
Учитывая это, из уравнения (10.2), находим

Решая
для![]() „
находим
„
находим
![]() (10.6)
(10.6)
Из
уравнения (10.6) следует: чтобы![]() была
положительной,
была
положительной,![]() должно быть положительным; более того,
должно быть положительным; более того,![]() должна
быть такой величиной, чтобы
должна
быть такой величиной, чтобы![]() была
максимальной температурой разложения,
связанной с пределом несмешиваемости.
Значение
была
максимальной температурой разложения,
связанной с пределом несмешиваемости.
Значение
![]() ,
которое делает
,
которое делает![]() максимальной
в уравнении (10.6), составляет
максимальной
в уравнении (10.6), составляет![]() .
Таким образом,
.
Таким образом,
![]() (10.7)
(10.7)
В
соответствии с квазихимической теорией,
положительное значение![]() означает взаимное отталкивание атомов
разных компонентов. Таким образом, из
уравнения (10.7) следует, что чем сильнее
это взаимное отталкивание, тем выше
температура начала распада раствора.
Обобщая, можно сказать, что фактически
все системы с положительным
означает взаимное отталкивание атомов
разных компонентов. Таким образом, из
уравнения (10.7) следует, что чем сильнее
это взаимное отталкивание, тем выше
температура начала распада раствора.
Обобщая, можно сказать, что фактически
все системы с положительным![]() должны
иметь предел несмешиваемости.
Экспериментально это не подтверждается.
Причина этого несоответствия с теорией
заключается в следующем. Если
должны
иметь предел несмешиваемости.
Экспериментально это не подтверждается.
Причина этого несоответствия с теорией
заключается в следующем. Если![]() не
будет достаточно велика,
не
будет достаточно велика,
![]() будет
настолько
низка, что скорость процесса разложения
в твердом состоянии будет бесконечно
большой; таким образом, как правило,
будет образовываться твердый раствор,
который фактически является метастабильным.
Вследствие малых скоростей диффузии
при низких температурах большая часть
диаграмм состояния, вероятно, неточна
в области низких температур.
будет
настолько
низка, что скорость процесса разложения
в твердом состоянии будет бесконечно
большой; таким образом, как правило,
будет образовываться твердый раствор,
который фактически является метастабильным.
Вследствие малых скоростей диффузии
при низких температурах большая часть
диаграмм состояния, вероятно, неточна
в области низких температур.
3. Зависимость свободная энергия — состав для случая, когда А и В имеют разные кристаллические структуры лекции
Типичная
диаграмма![]() —состав
показана рис. 63. На этой
—состав
показана рис. 63. На этой
диаграмме
кривые зависимости
![]() —состав
приведены для двух растворов с ограниченной
растворимостью. Кроме того, приведена
кривая для гипотетической промежуточной
фазы. Установим, существует ли
—состав
приведены для двух растворов с ограниченной
растворимостью. Кроме того, приведена
кривая для гипотетической промежуточной
фазы. Установим, существует ли![]() -фаза
как устойчивая при этой температуре?
Можно отметить, что
-фаза
как устойчивая при этой температуре?
Можно отметить, что![]() для
для![]() -фазы
состава с
является
отрицательной, поэтому несомненно, что
-фазы
состава с
является
отрицательной, поэтому несомненно, что
![]() -фаза
будет устойчивей чистых А
и В. Следует
установить также, будет ли устойчивее
какое-либо другое сочетание фаз? Из
рассмотрения диаграммы ясно, что когда
-фаза
будет устойчивей чистых А
и В. Следует
установить также, будет ли устойчивее
какое-либо другое сочетание фаз? Из
рассмотрения диаграммы ясно, что когда![]()
![]() ,
при сосуществовании
,
при сосуществовании![]() -
и
-
и![]() фаз значение
фаз значение
![]() наиболее
отрицательно. Чтобы в этой области
присутствовала
наиболее
отрицательно. Чтобы в этой области
присутствовала
![]() -фаза,
кривая
-фаза,
кривая
![]() для
промежуточной фазы должна быть ниже
пунктирной линии, характеризую
для
промежуточной фазы должна быть ниже
пунктирной линии, характеризую щей
равновесный состав
щей
равновесный состав![]() -фазы,
на
-фазы,
на
ходящейся
в равновесии с равновесным составом![]() фазы.
Такое положение показано на рис. 64.
Исследуя диаграмму, видим, что когда
фазы.
Такое положение показано на рис. 64.
Исследуя диаграмму, видим, что когда

Следует
отметить, что хотя пределы состава
сосуществования![]() -фазы
могут быть небольшими, в области состава
может
-фазы
могут быть небольшими, в области состава
может

произойти
очень сильное изменение значения
разности![]() а следовательно, и активности
а следовательно, и активности![]() .
Как показано на рис. о*, значение
.
Как показано на рис. о*, значение
![]() в
в![]() -фазе
при составе, когда
-фазе
при составе, когда![]() и
и![]() фазы
находятся в равновесии, в значительной
степени отличается от значения когда
фазы
находятся в равновесии, в значительной
степени отличается от значения когда![]() фаза
находится в равновесии с
фаза
находится в равновесии с![]() -фазой.
Фактически, в узкой области состава
может произойти изменение порядка
величины
-фазой.
Фактически, в узкой области состава
может произойти изменение порядка
величины![]()
На
рис. 65 показана диаграмма для![]() и
и
![]() в
зависимости от состава, полученная из
рис. 64. Диаграмма состояния, соответствующая
рис. 64, показана на рис. 66.
в
зависимости от состава, полученная из
рис. 64. Диаграмма состояния, соответствующая
рис. 64, показана на рис. 66.
Из
рис. 67 следует, что чем отрицательнее
величина свободной энергии образования
промежуточной фазы, тем более ограниченными
будут пределы растворимости растворов![]() и
и![]() .
Иными словами, промежуточная фаза
образуется за счет уменьшения области
твердых растворов по концам диаграммы
состояния.
.
Иными словами, промежуточная фаза
образуется за счет уменьшения области
твердых растворов по концам диаграммы
состояния.
Часто
необходимо знать активность растворенного
вещества в граничном твердом растворе
для систем, которые имеют одну или
несколько промежуточных фаз. Если
известна кривая зависимости![]() от
от![]() для
промежуточной фазы, как показано на
рис. 64, то, исходя из формы кривой, на
основании наклонов
(см. рис. 64) можно получить значения
величин
для
промежуточной фазы, как показано на
рис. 64, то, исходя из формы кривой, на
основании наклонов
(см. рис. 64) можно получить значения
величин![]() соответствующие
максимальной растворимости
соответствующие
максимальной растворимости![]() фазы
в
фазы
в![]() фа-
фа-
зе.
Таким образом, можно легко рассчитать
активность компонента р в насыщенном
![]() растворе.
Если
растворе.
Если
![]() раствор
является разбавленным, компонент В
следует
закону Генри и, следовательно, активность
можно рассчитать для любого состава.
Как правило, однако, кривая зависимости
раствор
является разбавленным, компонент В
следует
закону Генри и, следовательно, активность
можно рассчитать для любого состава.
Как правило, однако, кривая зависимости![]() (соответствующая
(соответствующая
![]() )
от Хв
не
получена для промежуточной фазы, но для
не-
)
от Хв
не
получена для промежуточной фазы, но для
не-

которых
фаз имеется более или менее усредненное
значение
![]() ,
соответствующее некоторому составу в
интервале от b
до
с. Если известно это значение, можно
достаточно точно оценить активность
,
соответствующее некоторому составу в
интервале от b
до
с. Если известно это значение, можно
достаточно точно оценить активность![]() в
в
![]() фазе
методом, описанным ниже.
фазе
методом, описанным ниже.
П усть
усть![]() и
и
![]() фазы
будут растворами с ограниченной областью
растворимости; растворенное вещество
будет следовать закону Генри, а
растворитель — закону Рауля. Поскольку
предполагается, что известна для
промежуточной фазы,
фазы
будут растворами с ограниченной областью
растворимости; растворенное вещество
будет следовать закону Генри, а
растворитель — закону Рауля. Поскольку
предполагается, что известна для
промежуточной фазы,![]() находящейся
на диаграмме состояния рядом с
находящейся
на диаграмме состояния рядом с![]() фазой,
логичнее будет
рассматривать
сначала это взаимодействие, гак как
промежуточная фаза находится в равновесии
с насыщенной
фазой,
логичнее будет
рассматривать
сначала это взаимодействие, гак как
промежуточная фаза находится в равновесии
с насыщенной![]() Фазой.
Фазой.
Так
как нам необходимо знать значение
![]() в
насыщ
в
насыщ![]() енной
енной
![]() фазе,
чтобы получить
фазе,
чтобы получить![]() ,
а следовательно,
,
а следовательно,![]() в
в![]() -фазе,
предположим, что
-фазе,
предположим, что![]() для
промежуточной фазы состава b
является
такой же величиной, что и среднее
значение, которое было получено измерением
для насыщенного
для
промежуточной фазы состава b
является
такой же величиной, что и среднее
значение, которое было получено измерением
для насыщенного
![]() -раствора
и выражается
-раствора
и выражается
![]() .
(10.8)
.
(10.8)
 Поэтому
наклон кривой
Поэтому
наклон кривой![]() в
зависимости от
в
зависимости от![]() для
для![]() фазы
фазы
состава а, находящегося в равновесии с промежуточной фазой, будет выражаться уравнением
![]() (10.9)
(10.9)
Было показано, что
 (10.10)
(10.10)
При замещении находим, что
![]() .
(10.11)
.
(10.11)
Для
раствора с ограниченной растворимостью
![]()
![]() ,
и, следовательно, этой величиной можно
пренебречь. Таким образом, поскольку
значение величины
,
и, следовательно, этой величиной можно
пренебречь. Таким образом, поскольку
значение величины
![]() в
промежуточной фазе для состава b
такое
же, что и для
в
промежуточной фазе для состава b
такое
же, что и для![]() в насыщенной
в насыщенной![]() фазе,
находим, используя выражения (10.11),
(10.10) и (9.9),
фазе,
находим, используя выражения (10.11),
(10.10) и (9.9),
![]() >
>
или
 .
(10.12)
.
(10.12)
Таким
образом, если известен состав насыщенной
а-фазы и промежуточной фазы, а
также![]() образования
этой фазы,
образования
этой фазы,
можно
рассчитать коэффициент активности![]() в
в![]() -фазе.
Очень часто, однако, не удается получить
свободную энергию образования
промежуточных фаз, но можно рассчитать
теплоту образования. Энтропия
образования
-фазе.
Очень часто, однако, не удается получить
свободную энергию образования
промежуточных фаз, но можно рассчитать
теплоту образования. Энтропия
образования![]() состоит
из колебательной энтропии и энтропии
смешения. Как правило, величина энтропии
смешения близка к нулю, поскольку
промежуточные фазы обычно сильно
упорядочены, а следовательно,
разупорядоченность при смешении
невелика. Влияние энтропийного члена
на величину
состоит
из колебательной энтропии и энтропии
смешения. Как правило, величина энтропии
смешения близка к нулю, поскольку
промежуточные фазы обычно сильно
упорядочены, а следовательно,
разупорядоченность при смешении
невелика. Влияние энтропийного члена
на величину![]() иногда
бывает значительным, хотя, как правило,
обычно невелико, даже при умножении на
Т.
Таким
образом, можно сказать, что
иногда
бывает значительным, хотя, как правило,
обычно невелико, даже при умножении на
Т.
Таким
образом, можно сказать, что
![]() .
Поэтому для приближенных расчетов в
уравнении (10.12), особенно для очень
устойчивых промежуточных фаз,
.
Поэтому для приближенных расчетов в
уравнении (10.12), особенно для очень
устойчивых промежуточных фаз,![]() можно
заменить
можно
заменить![]()
Предположим
теперь, что![]() фаза
существует в метастабильной кристаллической
структуре. Свободная энергия образования
этой структуры будет более положительна,
чем соответствующее значение для
устойчивой структуры. Это, конечно,
справедливо, поскольку, если бы
фаза
существует в метастабильной кристаллической
структуре. Свободная энергия образования
этой структуры будет более положительна,
чем соответствующее значение для
устойчивой структуры. Это, конечно,
справедливо, поскольку, если бы![]() была
более отрицательной, структура была бы
более устойчивой. В результате общая
линия для
была
более отрицательной, структура была бы
более устойчивой. В результате общая
линия для![]() и
и![]() фаз
станет более горизонтальной и увеличится
состав
фаз
станет более горизонтальной и увеличится
состав
![]() означая как уже обсуждалось ранее (стр.
144), что растворимость метастабильной
фазы всегда выше растворимости устойчивой
фазы.
означая как уже обсуждалось ранее (стр.
144), что растворимость метастабильной
фазы всегда выше растворимости устойчивой
фазы.
4. Линии солидуса и ликвидуса для идеального раствора
П редположим,
что компоненты А
и В образуют
идеальные растворы как в жидком, так и
в твердом состоянии. Можно ожидать, что
для такой системы линии солидуса и
ликвидуса сольются. Ниже будет показано,
что это на самом деле не так. Предположим
также, что кривые свободной энергии
жидких и твердых растворов находятся
ниже точки плавления Т
компонента
А, но выше точки плавления компонента
В.
Таким
образом, в данном случае стандартными
состояниями являются чистый твердый
компонент А
и
чистый жидкий компонент В.
редположим,
что компоненты А
и В образуют
идеальные растворы как в жидком, так и
в твердом состоянии. Можно ожидать, что
для такой системы линии солидуса и
ликвидуса сольются. Ниже будет показано,
что это на самом деле не так. Предположим
также, что кривые свободной энергии
жидких и твердых растворов находятся
ниже точки плавления Т
компонента
А, но выше точки плавления компонента
В.
Таким
образом, в данном случае стандартными
состояниями являются чистый твердый
компонент А
и
чистый жидкий компонент В.
Кривые
зависимости![]() от
от![]() для
двух фаз показаны на рис. 67. Теперь можно
аналитически вывести кривые для раствора
каждого типа. Поскольку жидкий раствор
идеальный, реакция может быть записана
так:
для
двух фаз показаны на рис. 67. Теперь можно
аналитически вывести кривые для раствора
каждого типа. Поскольку жидкий раствор
идеальный, реакция может быть записана
так:
![]() (10.13)
(10.13)
Свободная энергия смешения равна
![]() (10.14)
(10.14)
Поскольку в данном случае стандартным состоянием является твердый компонент A, необходимо рассмотреть следующую реакцию, чтобы получить уравнение для кривой, представленной на рис. 67.
![]() .
(10.15) Суммируя
уравнения (10.13) и (10.15), получаем
.
(10.15) Суммируя
уравнения (10.13) и (10.15), получаем
![]() (10.16)
(10.16)
![]() (10.17)
(10.17)
Аналогичным способом для твердого раствора получаем
 (10.18)
(10.18)
В
предыдущем разделе было показано, что
если пренебречь небольшими поправками
по теплоемкости в![]() и
и![]() ,
то
,
то
![]()
При
равновесии химический потенциал
компонента В
одинаков
как в жидком, так и в твердом растворе,
значит, и наклоны одинаковы, или![]()
После дифференцирования и преобразований находим при данной температуре:
 (10.19)
(10.19)
В ышеприведенное
уравнение содержит два неизвестных,
так что следует прибегнуть к некоторым
предположениям, чтобы его
решить. По мере приближения к
ышеприведенное
уравнение содержит два неизвестных,
так что следует прибегнуть к некоторым
предположениям, чтобы его
решить. По мере приближения к![]() ,
величины
,
величины
![]() и
и![]() ,
а следовательно,
,
а следовательно,![]() ,
т. е. второй член выражения в левой части
уравнения (10.19)
стремится к нулю. И поскольку
,
т. е. второй член выражения в левой части
уравнения (10.19)
стремится к нулю. И поскольку![]() ,
получаем отношение
,
получаем отношение
![]() (10.20)
(10.20)
Произведя те же самые преобразования для другого конца диаграммы, имеем
![]() (10.21)
(10.21)
Решая уравнения (10.20) и (10.21) как функцию T, получаем диаграмму состояния, показанную на рис. 68. Тормонд [27] этим методом рассчитал кривые ликвидуса и солидуса для бинарной системы германий — кремний. Он обнаружил очень точное соответствие расчетных данных с экспериментальными кривыми. В результате на основании данных, представленных на диаграмме состояния, можно сделать вывод, что германий и кремний образуют почти идеальные растворы. Эта диаграмма представлена на рис. 69.
5 .
Сравнение
диаграмм состояния различного типа
.
Сравнение
диаграмм состояния различного типа
На первый взгляд нет большего сходства между, Например, диаграммой состояния, для которой оба элемента смешиваются во всех соотношениях (см. рис. 68), и диаграммой состояния, имеющей эвтектику. Однако термодинамически эти диаграммы отличаются только качественно и не обязательно должны иметь принципиальные различия в природе компонентов.
Только что была рассмотрена диаграмма состояния для компонентов, образующих идеальный раствор в жидком и твердом состояниях.
Рассмотрим
теперь общий случай, для которого![]() отрицательная.
Далее предположим, что
отрицательная.
Далее предположим, что![]() более
отрицательна для твердого раствора,
чем для жидкого. При температуре
более
отрицательна для твердого раствора,
чем для жидкого. При температуре![]() которая
значительно ниже температуры плавления
компонентов А
и
В,
кривые
зависимости свободной энергии от состава
схематически имели бы вид, показанный
на рис. 70, а.
Выше
точки плавления обоих компонентов при
температуре
которая
значительно ниже температуры плавления
компонентов А
и
В,
кривые
зависимости свободной энергии от состава
схематически имели бы вид, показанный
на рис. 70, а.
Выше
точки плавления обоих компонентов при
температуре![]() кривые
имели бы вид, показанный на рис. 70, б.
Кривая для твердого раствора достигает
более низкого значения в сравнении
кривые
имели бы вид, показанный на рис. 70, б.
Кривая для твердого раствора достигает
более низкого значения в сравнении
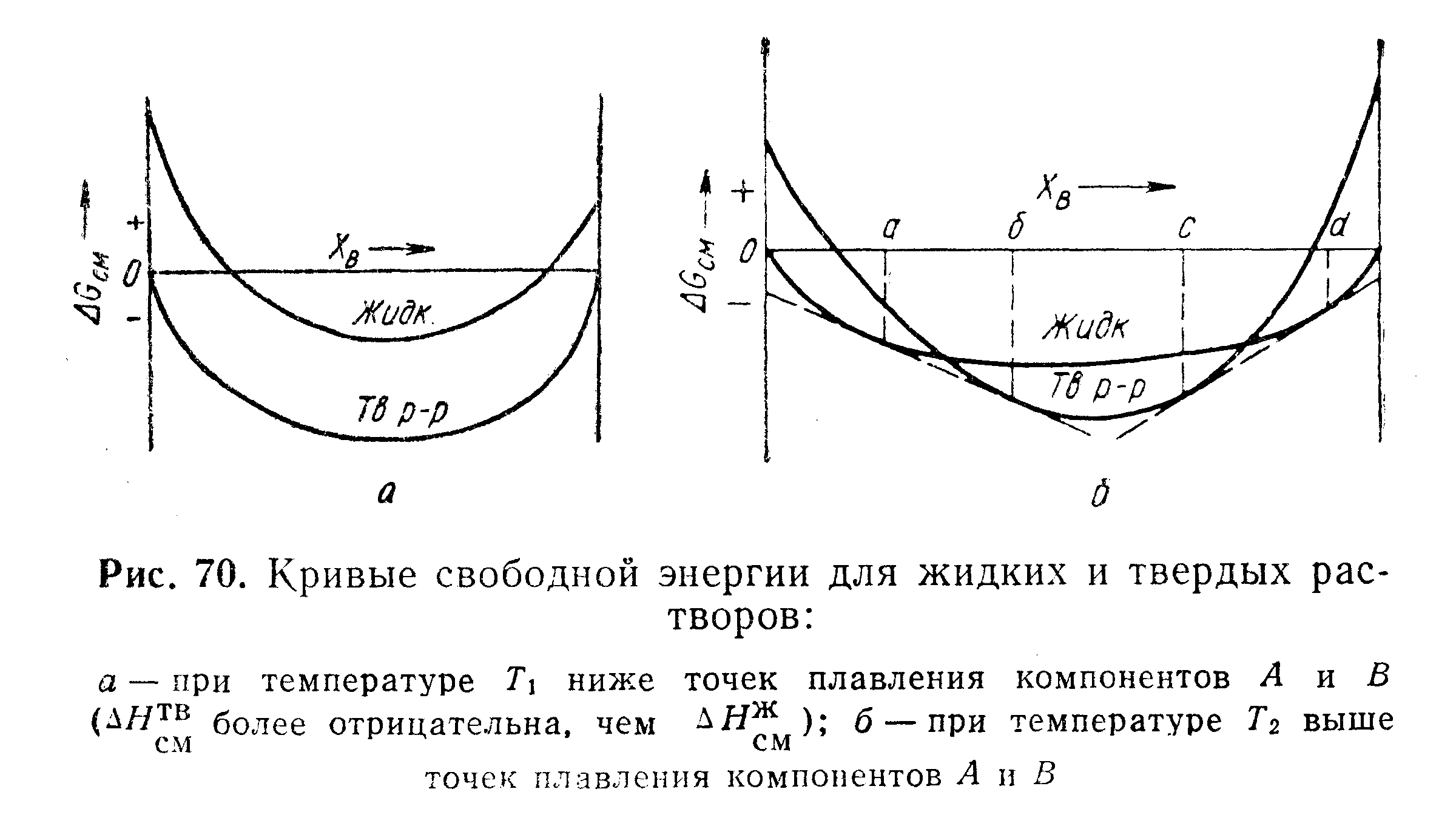
с
кривой для жидкого раствора, поскольку
в данном случае![]() более отрицательна, чем
более отрицательна, чем![]()
Самая низкая свободная энергия системы достигается в следующих случаях:
1)
![]() жидкий
раствор устойчив;
жидкий
раствор устойчив;
2 )
)![]() ,
жидкий и твердый растворы сосуществуют;
,
жидкий и твердый растворы сосуществуют;
