
4. Растворимость метастабильной фазы
Рассмотрим
случай, когда насыщенная![]() -фаза
соприкасается с насыщенной
-фаза
соприкасается с насыщенной![]() -фазой.
Предположим, что
-фазой.
Предположим, что![]() -фаза
не имеет своей равновесной структуры,
а находится в метастабильной форме. В
частности, твердая
-фаза
не имеет своей равновесной структуры,
а находится в метастабильной форме. В
частности, твердая![]() -фаза
перегрета до температуры выше
эвтектической. В таком случае возникает
вопрос, каков же состав
-фаза
перегрета до температуры выше
эвтектической. В таком случае возникает
вопрос, каков же состав
![]() -фазы,
находящейся в равновесии с этой
метастабильной
-фазы,
находящейся в равновесии с этой
метастабильной![]() -фазой
при температуре выше эвтектической.
Например, относительная парциальная
энтальпия компонента А
в
-фазой
при температуре выше эвтектической.
Например, относительная парциальная
энтальпия компонента А
в![]() -фазе,
-фазе,![]() одинакова
для температуры выше и ниже эвтектической,
a
одинакова
для температуры выше и ниже эвтектической,
a![]() j
сохраняет свое значение при температуре
выше эвтектической.
j
сохраняет свое значение при температуре
выше эвтектической.
Таким образом, величина
![]()
остается
без изменений при температуре выше
эвтектической. Это означает, что линии
ограниченной растворимости при
температуре выше эвтектической
являются продолжением
этих линий при температуре
ниже эвтектической (рис. 55). При
температуре![]()
![]() -фаза
состава b
находится
в метастабильном равновесии с
-фаза
состава b
находится
в метастабильном равновесии с![]() фазой
состава а.
При
температуре
фазой
состава а.
При
температуре![]() фаза
а состава с
находится
в метастабильном равновесии с
жидкостью состава е,
а
жидкость состава d
находиться
в метастабильном равновесии с
фаза
а состава с
находится
в метастабильном равновесии с
жидкостью состава е,
а
жидкость состава d
находиться
в метастабильном равновесии с![]() -фазой
состава
-фазой
состава![]() ,
Из рис. 55 следует, что растворимость
метастабильной фазы (например,
перегретой
,
Из рис. 55 следует, что растворимость
метастабильной фазы (например,
перегретой![]() -фазы
в
-фазы
в
![]() -фазе при
-фазе при![]() ),
выше, чем равновесной фазы при этой
температуре (эвтектическая жидкость),
поскольку химический потенциал В,
например, в перегретой
),
выше, чем равновесной фазы при этой
температуре (эвтектическая жидкость),
поскольку химический потенциал В,
например, в перегретой![]() фазе
выше химического потенциала В
в
стабильной фазе эвтектической жидкости.
Если бы это было не так,
фазе
выше химического потенциала В
в
стабильной фазе эвтектической жидкости.
Если бы это было не так,![]() -фаза
не была бы устойчивой при
-фаза
не была бы устойчивой при![]() Следовательно,
в соответствии с уравнениями (9.8—9.10)
Следовательно,
в соответствии с уравнениями (9.8—9.10)
![]() (насыщ)
в перегретой фазе будет больше, чем в
устойчивой фазе.
(насыщ)
в перегретой фазе будет больше, чем в
устойчивой фазе.
В
качестве еще одного примера предположим,
что![]() -фаза
при температуре
-фаза
при температуре![]() присутствует
в виде метастабильной кристаллической
структуры. Поскольку устойчивая структура
имеет самую низкую свободную энергию,
а отдельные компоненты — самые низкие
химические потенциалы, значение
опять-таки
будет
больше для метастабильной структуры.
присутствует
в виде метастабильной кристаллической
структуры. Поскольку устойчивая структура
имеет самую низкую свободную энергию,
а отдельные компоненты — самые низкие
химические потенциалы, значение
опять-таки
будет
больше для метастабильной структуры.![]()
Из
этого короткого обсуждения ясно, что
природа фазы не является определяющей
при растворимости в ней другого элемента.
Законы растворимости следует выражать,
исходя из природы растворенной фазы.
Однако можно сделать обобщение, сказав,
что растворимость метастабильной фазы
всегда выше, чем стабильной (устойчивой)
ф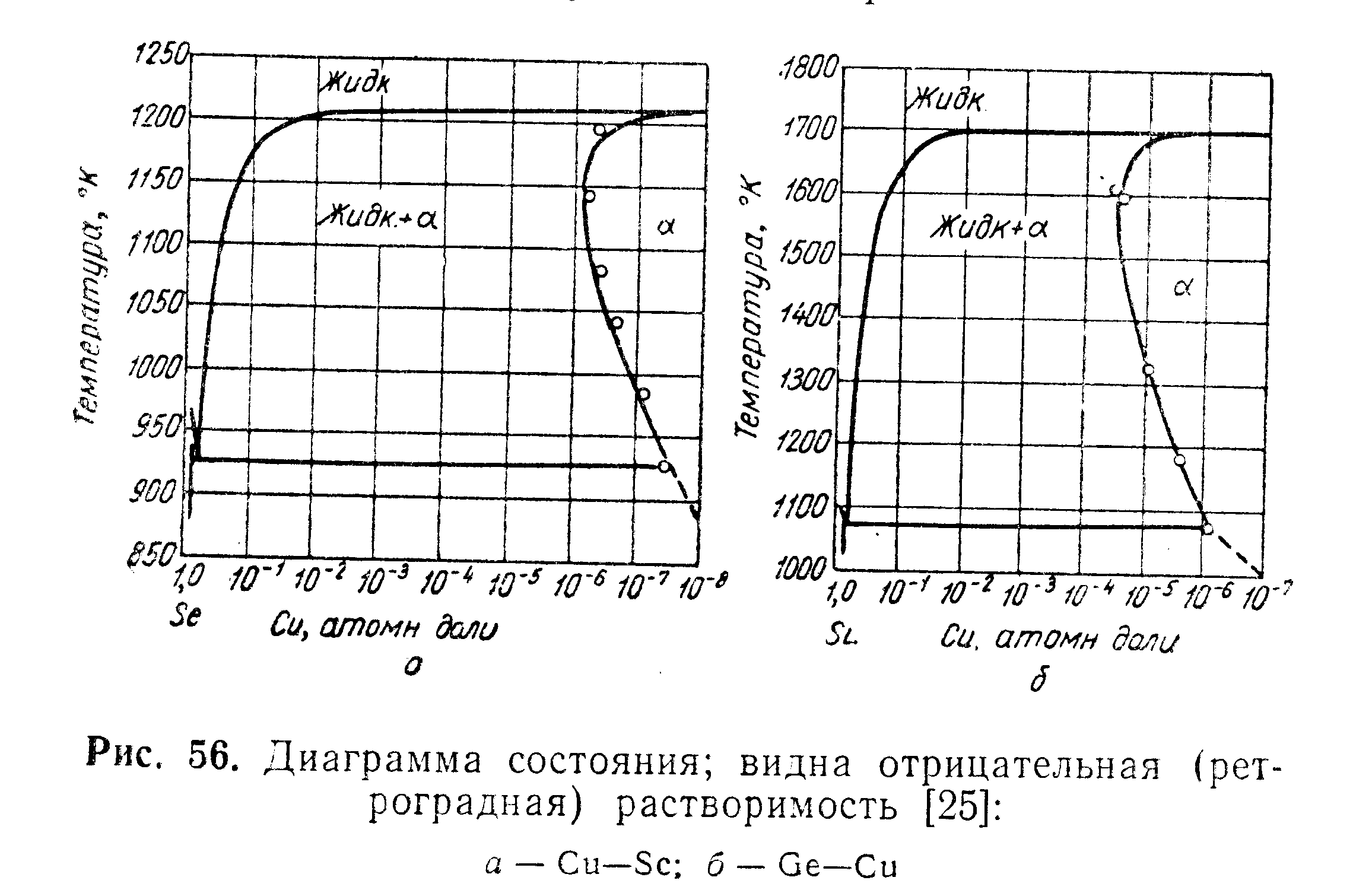 азы.
азы.
5. Отрицательная растворимость
На рис. 56 соответственно для систем германий—медь и кремний—медь показано важное явление, которое недавно привлекло внимание при рассмотрении диаграмм состояния германия и кремния со многими веществами. Максимальная растворимость одного вещества в другом обычно имеет место при эвтектической температуре (см. рис. 49), однако в системе с отрицательной (ретроградной) растворимостью максимальной растворимости соответствует значительно более высокая температура. Как показано на рис. 56, этот эффект может быть очень резко выражен. Например, при 1125° К растворимость меди в германии примерно в 15 раз больше, чем при эвтектической температуре.
Для
упрощения трактовки термодинамических
причин этого эффекта, известного как
отрицательная
растворимость,
предположим, что![]() -фаза
ведет себя как регулярный раствор, а
жидкая фаза, находящаяся в равновесии
с
-фаза
ведет себя как регулярный раствор, а
жидкая фаза, находящаяся в равновесии
с![]() фазой
выше эвтектической температуры, ведет
себя как идеальный раствор [25, 26].
Разность химических потенциалов чистого
вещества В
и
растворенного вещества В
в
насыщенной
фазой
выше эвтектической температуры, ведет
себя как идеальный раствор [25, 26].
Разность химических потенциалов чистого
вещества В
и
растворенного вещества В
в
насыщенной![]() -фазе
(
-фазе
(![]() -фаза
считается разбавленным раствором)
выражается соотношением
-фаза
считается разбавленным раствором)
выражается соотношением
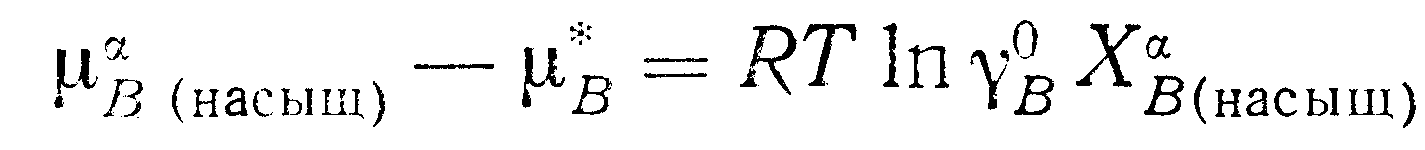 (9.26)
(9.26)
но
![]() (9,27)
Приравнивая
(9.26)
и (9.27),
находим
(9,27)
Приравнивая
(9.26)
и (9.27),
находим
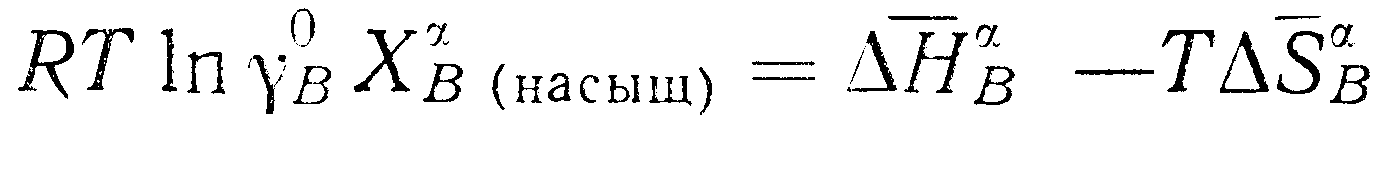 (9.28)
(9.28)
Поскольку раствор считают регулярным, то
![]() (9.29)
(9.29)
а
также![]() —
постоянная величина.
—
постоянная величина.
Подставляя уравнение (9.29) в (9.28), находим
![]() (9.30)
(9.30)
Теперь
рассмотрим химический потенциал В
в
жидкой фазе. Для жидкости, находящейся
в равновесии с
![]() -фазой,
следует принять во внимание, что
растворенное вещество часто устойчиво
в твердом состоянии при ретроградных
температурах. Это очевидно, так как при
образовании идеального раствора тепло
не выделяется. Для данной жидкой фазы
это означает, что если чистая жидкость
А
перемешана
с чистой жидкостью В, тепло не выделяется.
Это, безусловно, указывает на то, что
атомы не имеют сродства друг к другу.
Предположим теперь, что один из
компонентов устойчив в виде твердого
вещества при температуре растворения.
Получить жидкий раствор, не переводя
этот компонент в жидкое состояние,
конечно, невозможно. Для этого необходима
теплота плавления. Теперь жидкости
могут
перемешаться
идеально. Если же оба компонента в
твердом "состоянии, то для получения
жидкого раствора и тот и другой нужно
превратить
в чистые жидкости, и затем может произойти
перемешивание. Обращаясь к случаю,
когда В
в
обычном состоянии — твердое вещество,
допустим, что получить раствор можно
следующими обратимыми стадиями:
-фазой,
следует принять во внимание, что
растворенное вещество часто устойчиво
в твердом состоянии при ретроградных
температурах. Это очевидно, так как при
образовании идеального раствора тепло
не выделяется. Для данной жидкой фазы
это означает, что если чистая жидкость
А
перемешана
с чистой жидкостью В, тепло не выделяется.
Это, безусловно, указывает на то, что
атомы не имеют сродства друг к другу.
Предположим теперь, что один из
компонентов устойчив в виде твердого
вещества при температуре растворения.
Получить жидкий раствор, не переводя
этот компонент в жидкое состояние,
конечно, невозможно. Для этого необходима
теплота плавления. Теперь жидкости
могут
перемешаться
идеально. Если же оба компонента в
твердом "состоянии, то для получения
жидкого раствора и тот и другой нужно
превратить
в чистые жидкости, и затем может произойти
перемешивание. Обращаясь к случаю,
когда В
в
обычном состоянии — твердое вещество,
допустим, что получить раствор можно
следующими обратимыми стадиями:
1. Растворенное
вещество(твердое, ретроградная
T)=растворенное
вещество (твердое,![]() )
)
![]()
-
Растворенное вещество (твердое,
 )=
растворенное вещество (жидкое,
)=
растворенное вещество (жидкое, )
)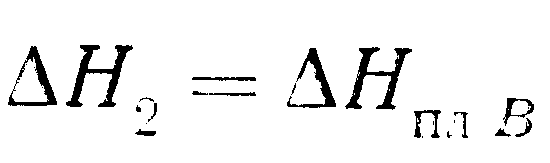
-
Растворенное вещество (жидкое,
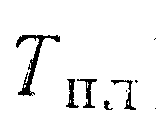 )
=растворенное вещество (жидкое А,
ретроградная Т)
)
=растворенное вещество (жидкое А,
ретроградная Т)
![]()
4. Растворенное
вещество (жидкое, ретроградная Т)
= растворенное
вещество (жидкое![]() ,
ретроградная Т)
,
ретроградная Т)
![]()
5. Растворенное
вещество (твердое, ретроградная Т)
=
рас
творенное вещество (![]() ретроградная Т)
ретроградная Т)
![]()
Изменения
энтальпии для реакций 1 и 3 будут
незначительно отличаться друг от друга
и частично сократятся. Для нашей цели
ими можно пренебречь. Поскольку жидкий
раствор считается идеальным,![]() Таким
образом,
Таким
образом,![]() для
всего процесса
для
всего процесса
(реакция 5) равно изменению энтальпии реакции 2, а именно
![]() Подобным
образом можно не принимать во внимание
изменения энтропии реакций 1 и 3, поскольку
они малы;
Подобным
образом можно не принимать во внимание
изменения энтропии реакций 1 и 3, поскольку
они малы;![]() для
реакции 2 будет
для
реакции 2 будет![]() для
реакции 4 будет
для
реакции 4 будет![]() .
Таким образом,
.
Таким образом,![]() для
суммарной реакции выражается
для
суммарной реакции выражается
![]()
В таком случае разность химических потенциалов между растворенным веществом в жидком растворе и чистым твердым веществом будет
![]() .
(9.31)
.
(9.31)
При
равновесии![]() ,
поэтому, уравнивая
,
поэтому, уравнивая
![]() из
(9.31) с
из
(9.31) с![]()
из (9.26) и делая замену совместно уравнением (9.30). находим
![]() (9.32)
(9.32)
Отношение![]() известно
как коэффициент распределения, и его
часто обозначают символом
известно
как коэффициент распределения, и его
часто обозначают символом![]() .
Поскольку и
.
Поскольку и![]() и
и![]() изменяются
в зависимости от температуры, а нас
интересует уравнение для
изменяются
в зависимости от температуры, а нас
интересует уравнение для![]() как
функция температуры, а не для
как
функция температуры, а не для![]() ,
необходимо исключить из уравнения
последнюю величину. Это можно сделать,
рассматривая термодинамические свойства
компонента А
в
,
необходимо исключить из уравнения
последнюю величину. Это можно сделать,
рассматривая термодинамические свойства
компонента А
в
![]() -фазе
и в жидкой фазе, поскольку, как правило,
-фазе
и в жидкой фазе, поскольку, как правило,
![]() и
химический потенциал компонента А
почти
идентичен
потенциалу для чистого компонента.
Таким образом,
и
химический потенциал компонента А
почти
идентичен
потенциалу для чистого компонента.
Таким образом,![]()
Поскольку ![]()
Далее, здесь считается, что жидкий раствор ведет себя идеально, так что для реакции
А (чистая жидкость, Т) =А (в жидком растворе, Т)
![]() (9.33)
(9.33)
Однако стандартным состоянием компонента А является не чистая жидкость, а чистое твердое вещество, так как стандартная температура ниже точки плавления компонента А. Значит, необходимо рассмотреть реакцию
компонент А (тв, Т) = компонент А (ж, Т):
![]() (9.34)
(9.34)
Подставляя
выражение (9.34) в (9.33), находим
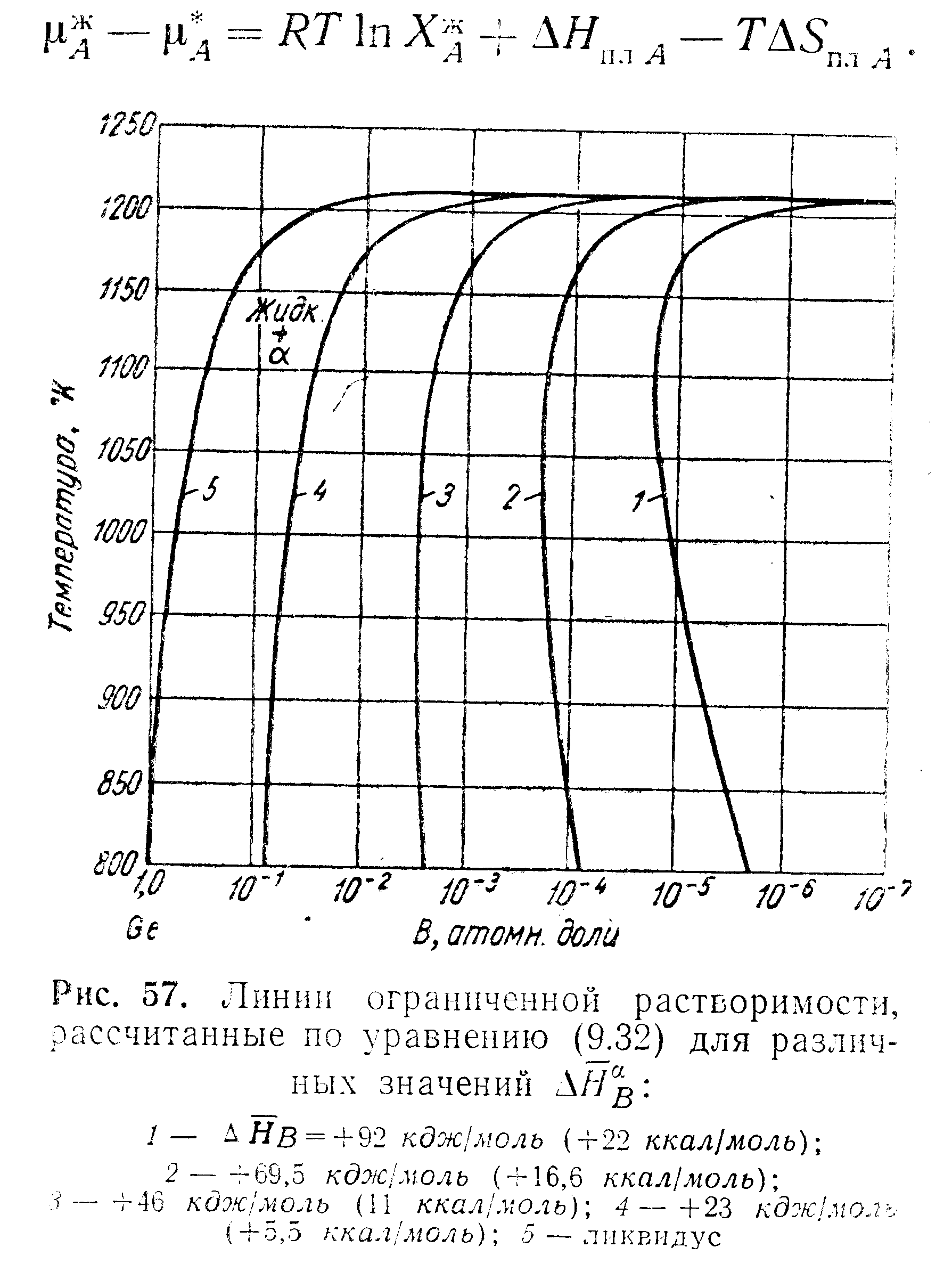
При
равновесии
![]() .
:
.
:
и поэтому
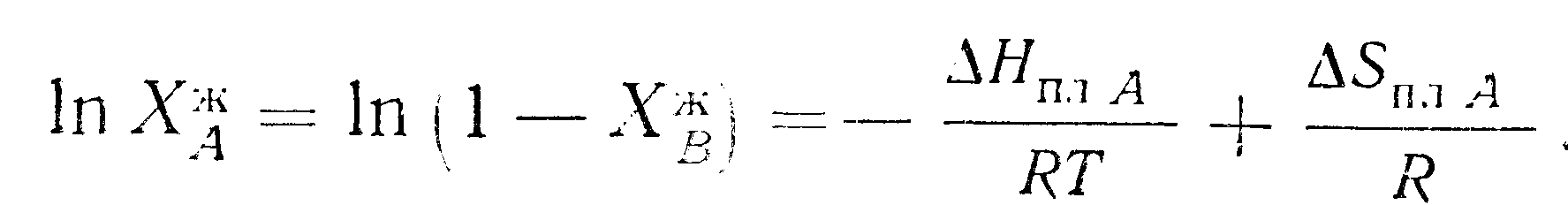 (9.35)
(9.35)
Из
уравнения (9.35) можно исключить![]() ,
поскольку в точке плавления
,
поскольку в точке плавления
и![]()
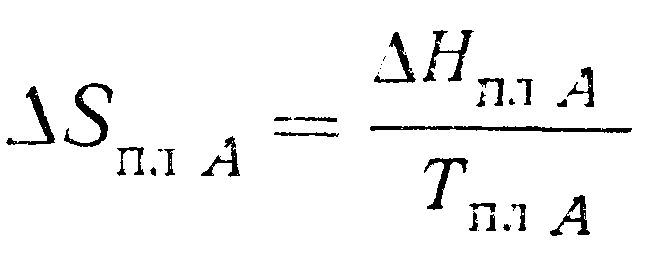 (9.36)
(9.36)
Так
как![]() и
и![]() мало
зависят от температуры, уравнение (9.36)
можно ввести в (9.35) и
мало
зависят от температуры, уравнение (9.36)
можно ввести в (9.35) и
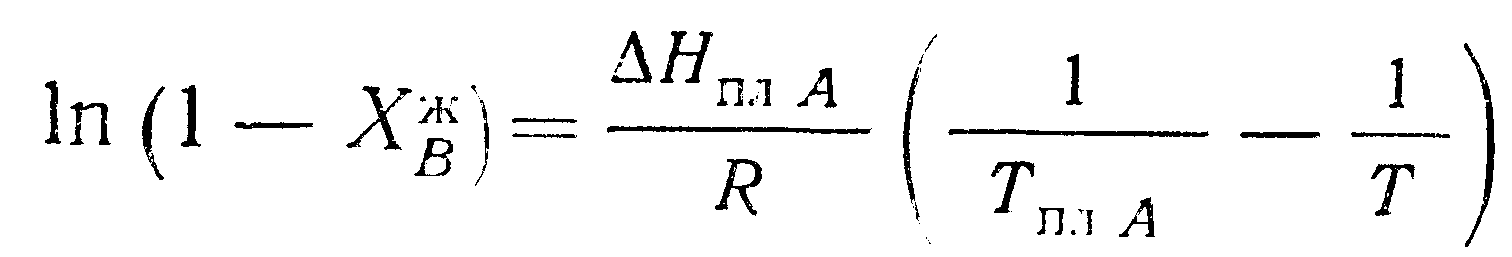 (9.37)
(9.37)
Уравнение
(9.37) является уравнением линии ликвидуса
для равновесия с
![]() фазой.
Если значение
фазой.
Если значение
![]() из
уравнения (9.37) ввести в уравнение (9.32),
получаем
из
уравнения (9.37) ввести в уравнение (9.32),
получаем![]() как
функцию температуры, когда известны
термодинамические величины
как
функцию температуры, когда известны
термодинамические величины![]() и
и![]()
Для
упрощения расчетов предположим, что![]() и
и![]() в
в
соответственно
равны 33500 дж/г-атом
(8000
кал/г-атом)
и
12,6 дж/(г-атом-град)
[3
кал/{г-атом-град)].
Таким
образом, используя уравнение (9.32), можно
нанести на график![]() в
зависимости от T
для различных значений
в
зависимости от T
для различных значений![]()
На
рис. 57 показано несколько линий
ограниченной растворимости, полученных
таким способом для германия как
растворителя. Кривая 5 —линия
ликвидуса, рассчитанная из уравнения
(9.37). Кривые солидуса, обозначенные 1—4,
были
рассчитаны из уравнения (9.32); значения
![]() равны
соответственно 92100
равны
соответственно 92100
(22000), 69500 (16600), 46000 (11000) и 23000 дж/г-атом (5500 кал/г-атом).
Как
показывает опыт, тенденция к отрицательной
(ретроградной) растворимости
непосредственно связана с относительной
парциальной энтальпией растворенного
вещества в твердом растворителе.
Например, кривая 4,
для
которой
![]() имеет
относительно низкое значение, не
обнаруживает тенденции к ретроградной
растворимости, но с увеличением
значения
имеет
относительно низкое значение, не
обнаруживает тенденции к ретроградной
растворимости, но с увеличением
значения![]() тенденция
к ретроградной растворимости растет.
тенденция
к ретроградной растворимости растет.
Если
растворенное вещество имеет низкую
точку плавления,
![]() не
появится в уравнении (9.32), и, таким
образом, ретроградная растворимость
будет иметь место при значительно более
низких значениях .
не
появится в уравнении (9.32), и, таким
образом, ретроградная растворимость
будет иметь место при значительно более
низких значениях .![]() .
Причиной того, что ретроградная
растворимость не наблюдается у большинства
металлических систем, является то, что
i
.
Причиной того, что ретроградная
растворимость не наблюдается у большинства
металлических систем, является то, что
i![]() имеет
слишком низкое значение.
имеет
слишком низкое значение.
Фактически
значения![]() необходимые для появления этого
явления,
весьма большие.
необходимые для появления этого
явления,
весьма большие.
Из
ранних обсуждений следует: высокое
значение![]() связано с низкой растворимостью В
в
связано с низкой растворимостью В
в![]() -фазе.
В результате это явление ретроградной
растворимости, как правило, наблюдается
только в системах с низкой растворимостью.
Большинство систем, в которых растворителями
служат германий и кремнии, являются
системами такого типа.
-фазе.
В результате это явление ретроградной
растворимости, как правило, наблюдается
только в системах с низкой растворимостью.
Большинство систем, в которых растворителями
служат германий и кремнии, являются
системами такого типа.
Для
приведенного выше примера было необходимо
сделать предположение, что жидкий и
твердый растворы ведут себя соответственно
идеально и регулярно. Эти ограничения
не делают недействительным общий вывод
о том, что ретроградная растворимость
непосредственно связана с большим
значением величины![]()
СВОБОДНАЯ ЭНЕРГИЯ БИНАРНЫХ СИСТЕМ
