
2013.Термодинамика / Свелин200-224-4в-17.10.2012
.docПоскольку как изменение длины, так и изменение параметров кристаллической решетки характеризует средние размеры ячейки в данный момент времени, то
![]() (13.7)
(13.7)
Однако
величины![]() и
и![]() не
равны. Предположим, что кристалл имеет
не
равны. Предположим, что кристалл имеет
![]() узлов,
содержит
узлов,
содержит
![]() вакансий
и объем каждого его атома равен
вакансий
и объем каждого его атома равен![]() .
Вокруг вакансии имеет место определенное
количество релаксаций, поэтому объем
вакансии равен лишь какой-то определенной
доле
.
Вокруг вакансии имеет место определенное
количество релаксаций, поэтому объем
вакансии равен лишь какой-то определенной
доле![]() объема
атома. Отсюда среднее изменение параметра
кристаллической решетки будет
объема
атома. Отсюда среднее изменение параметра
кристаллической решетки будет
![]() ,
или
,
или
![]() (13.8)
(13.8)
Однако
изменение длины, обусловленное вакансией,
не равно
![]() ,
так как атом, первоначально бывший на
месте вакансии, переместился к поверхности,
и поэтому изменение объема кристалла
за счет одной вакансии равно
,
так как атом, первоначально бывший на
месте вакансии, переместился к поверхности,
и поэтому изменение объема кристалла
за счет одной вакансии равно![]() ,
. Отсюда
,
. Отсюда
![]() (13.9)
(13.9)
Подставив уравнения (13.7), (13.8) и (13.9) в уравнения (13.5) и (13.6), получим
![]() (13.10)
(13.10)
следовательно,
относительные величины
![]() и
и![]() не
равны, а их разницу следует просто
отнести к мольной доле вакансий. На рис.
107 показана зависимость
не
равны, а их разницу следует просто
отнести к мольной доле вакансий. На рис.
107 показана зависимость![]() и
и
![]() для
алюминия от температуры; как видно на
этом рисунке, различие между величинами
действительно существует. Используя
упомянутое
выше
допущение,
можно по уравнению (13.10) определить
абсолютные величины концентрации
вакансий. Например, при температуре
плавления Xv
для
алюминия равно
для
алюминия от температуры; как видно на
этом рисунке, различие между величинами
действительно существует. Используя
упомянутое
выше
допущение,
можно по уравнению (13.10) определить
абсолютные величины концентрации
вакансий. Например, при температуре
плавления Xv
для
алюминия равно![]() ,
а для серебра —
,
а для серебра —![]() .
Теперь, когда абсолютное значение
.
Теперь, когда абсолютное значение![]() найдено,
можно по уравнению (13.1) рассчитать
найдено,
можно по уравнению (13.1) рассчитать
![]() .
Для алюминия и серебра
.
Для алюминия и серебра
![]() соответственно составляет около 16,8 и
12,6 дж/(моль
•
град)
[4,0
и 3,0 кал/(моль
• град)]. Напомним,
что
соответственно составляет около 16,8 и
12,6 дж/(моль
•
град)
[4,0
и 3,0 кал/(моль
• град)]. Напомним,
что
![]() — это энтропия колебания соседних с
вакансией атомов, которые имеют
большую амплитуду колебаний, чем атомы,
— это энтропия колебания соседних с
вакансией атомов, которые имеют
большую амплитуду колебаний, чем атомы,

находящиеся
в нормальных узлах. Экспериментально
полученные величины
![]() оказались
положительными — в полном соответствии
с теоретическими предсказаниями.
оказались
положительными — в полном соответствии
с теоретическими предсказаниями.
Поскольку
вакансии влияют также и на электросопротивление
кристалла, то, зная .![]() ,
можно вычислить удельное сопротивление
на единицу вакансий. Для алюминия
удельное сопротивление составляет 3
мком-см/%
вакансий
[58].
,
можно вычислить удельное сопротивление
на единицу вакансий. Для алюминия
удельное сопротивление составляет 3
мком-см/%
вакансий
[58].
Комплексы дефектов в металлах
Вакансии, подобно атомам примесей, обладают определенной энергией деформации. В соответствии с классической теорией упругости можно сделать вывод, что если два или более центра деформации расположены так, что они могут объединиться, то общая энергия деформации понижается. В результате можно предположить, что определенная часть вакансий будет объединяться в двойные вакансии по реакции
![]() »
где
»
где
![]() —
единичная вакансия;
—
единичная вакансия;
![]() —
двойная вакансия.
—
двойная вакансия.
Эта реакция схематически показана на рис. 108. В соответствии с принятыми воззрениями относительно энергии деформации при объединении центров деформации можно ожидать, что энтальпия образования двойной вакансии будет отрицательной величиной.
В
состоянии равновесия изменение свободной
энергии реакции
![]() равно
нулю:
равно
нулю:
![]()
Отсюда
![]() (13.11)
(13.11)
Химический
потенциал вакансии
равен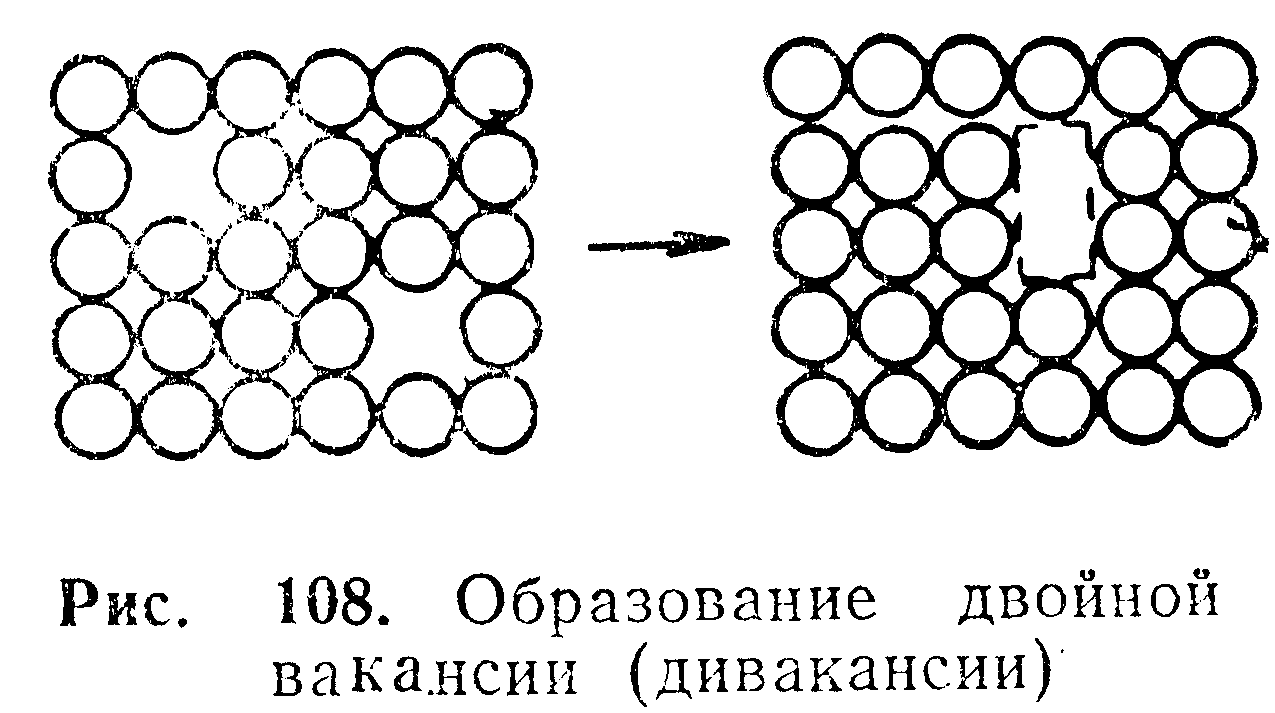
![]() >
>
где
![]() —химический
потенциал вакансии при стандартных
условиях. По аналогии химический
потенциал двойной вакансии равен
—химический
потенциал вакансии при стандартных
условиях. По аналогии химический
потенциал двойной вакансии равен
![]()
г![]()
![]() де
—энтальпия, энтропия и
химический потенциал двойной вакансии
соответственно. Сделав подстановки в
уравнение (13.11).
находим
де
—энтальпия, энтропия и
химический потенциал двойной вакансии
соответственно. Сделав подстановки в
уравнение (13.11).
находим
![]() -.
(13.12)
-.
(13.12)
Стандартным состоянием вакансии и двойной вакансии является дефект на поверхности; на поверхности мольная доля вакансий и двойных вакансий равна единице. Таким образом, имеем
![]()
Сделав подстановки в уравнение (13.12), получаем
![]() (13.13)
(13.13)
Член
уравнения ,![]() соответствует
энтальпии реакции
соответствует
энтальпии реакции
![]()
и, следовательно, представляет собой энтальпию соединения вакансий. Как и энергия деформации, эта величина должна быть отрицательной.
К этой реакции можно подойти, исходя из закона действующих масс. Так как двойные вакансии находятся в равновесии с одинарными, то должна существовать константа равновесия и, следовательно,
![]()
Константа равновесия выражается
![]()
Поскольку предполагается, что концентрации двойных и одинарных вакансий невелики, то
![]()
и
![]()
где![]() и
и![]() —
коэффициенты активности по закону
Генри. Следовательно,
—
коэффициенты активности по закону
Генри. Следовательно,
![]()
и так как
![]()
то
![]()
Следовательно,
![]() (13.14)
(13.14)
Уравнение
(13.14) идентично уравнению (13.13) при![]() =
=![]() ,
что представляет собой энтальпию
соединения для двойной вакансии.
,
что представляет собой энтальпию
соединения для двойной вакансии.
Приведенный
вывод уравнения (13.13) недостаточно
полный, так как имеется еще один вклад
в энтропию за счет возможной ориентации
асимметричной двойной вакансии в
решетке. Дальнейшее рассмотрение
показывает, что![]() в
уравнении (13.12) следует умножить на
в
уравнении (13.12) следует умножить на![]() ,
т. е. константа А
в
уравнении (13.14) равна
,
т. е. константа А
в
уравнении (13.14) равна![]()
В
последующих разделах, в которых
рассматриваются вопросы равновесия
между дефектами, мы будем использовать
закон действующих масс исключительно
из-за его простоты. До настоящего времени
нет никаких убедительных доказательств
того, что двойные вакансии и комплексы
высшего порядка в решетках металлов
оказывают большое влияние. Теоретические
расчеты энтальпии соединения показывают,
что реакция соединения этих дефектов
экзотермична,
![]() реакции
составляет
около —8,37 кдж/г-атом
(—2,0
ккал/г-атом).
Подставив
эту величину в уравнение (13.14), получим,
что при низких температурах
двойные вакансии оказывают большее
влияние, чем при высоких.
реакции
составляет
около —8,37 кдж/г-атом
(—2,0
ккал/г-атом).
Подставив
эту величину в уравнение (13.14), получим,
что при низких температурах
двойные вакансии оказывают большее
влияние, чем при высоких.
Рассмотрим теперь комплексы между атомами примесей и вакансиями.27октября. Так как атомы примесей и вакансии деформируют структуру растворителя, то когда эти дефекты перегруппировываются и становятся ближайшими соседями, энергия деформации уменьшается. Так образуется комплекс вакансия — примесь. К энергии деформации может добавляться небольшое кулоновское взаимодействие, возникающее в результате добавления отрицательной энергии к энтальпии соединения вакансии. В конечном счете в структуре решетки получается два типа вакансий: свободные вакансии, концентрация которых дается уравнением (13.1). и вакансии, связанные с примесями. Эти дефекты можно называть внутренними и внешними дефектами соответственно. Первые дефекты называются внутренними потому, что их концентрация зависит только от температуры, в то время как концентрация внешних дефектов зависит не только от температуры, но и от типа концентрации примесей, присутствующих в кристаллической решетке.
Чтобы получить количественную информацию об этих комплексах, рассмотрим следующую реакцию между растворенными атомами примеси В и вакансией кристаллической решетки:
![]()
Константа равновесия равна
![]()
Предположим,
что![]() ,
тогда и –
,
тогда и –![]()
Следовательно, эти составляющие подчиняются закону Генри, и поэтому коэффициенты активности при данной температуре постоянны. Для данного кристалла активность ав постоянна, так как состав атома не изменяется. Тогда мы получаем
![]() ,
(13.15)
,
(13.15)
Где
![]() –
постоянная величина, включающая
–
постоянная величина, включающая
![]() и
и![]()
Из
реакции следует, что![]() представляет
собой разность энтальпии ассоциированной
и диссоциированной пар т. е. равна
энтальпии содержания дефектной пары.
Как уже упоминалось, из-за отрицательного
знака энергии деформации эта величина
является отрицательной. Поскольку ,
представляет
собой разность энтальпии ассоциированной
и диссоциированной пар т. е. равна
энтальпии содержания дефектной пары.
Как уже упоминалось, из-за отрицательного
знака энергии деформации эта величина
является отрицательной. Поскольку ,![]() отрицательна,
то, согласно уравнению (13.15), отношение
отрицательна,
то, согласно уравнению (13.15), отношение
![]() уменьшается
с повышением температуры. Следовательно,
спаривание преобладает при низких
температурах. Кроме того, из уравнения
константы равновесия следует, что число
пар примесь–вакансия пропорционально
активности В.
Так,
если вещество В
присутствует
в небольших количествах, т. е.
уменьшается
с повышением температуры. Следовательно,
спаривание преобладает при низких
температурах. Кроме того, из уравнения
константы равновесия следует, что число
пар примесь–вакансия пропорционально
активности В.
Так,
если вещество В
присутствует
в небольших количествах, т. е.![]() ,
то при
увеличении концентрации
примеси вдвое
,
то при
увеличении концентрации
примеси вдвое
![]() тоже
удваивается Общая концентрация вакансий
равна сумме концентраций внешних и
внутренних вакансий
тоже
удваивается Общая концентрация вакансий
равна сумме концентраций внешних и
внутренних вакансий
![]()
Таким образом, общее содержание вакансий зависит от концентрации и типа примеси В. Это особенно важно для диффузии атомов. Для большинства кристаллов диффузия атомов происходит по механизму диффузии вакансий. Для примеси энергия связи между вакансией и примесью указывает, что атом примеси имеет значительно большую склонность к ассоциации с вакансиями, чем это следует из теории вероятности. Это способствует увеличению подвижности атомов примеси.
Рассмотрим теперь образование скопления посторонних атомов, отличных от примеси, как показано на рис. 113. Энтальпия соединения этих примесей обычно отрицательна, как и в ранее обсуждавшихся случаях. Однако, кроме того, может иметь место сильное химическое взаимодействие, если один тип примеси электроположителен (например, алюминий), а другой электроотрицателен (например, кислород). Если образуются скопления, то растворимость составляющих, таких как кислород будет заметно превышать растворимость их в чистом кристалле так как при этом имеется и внутренний, и внешний кислород связанный с примесями. Общее содержание кислорода равно сумме количества внутреннего кислорода и количества кислорода связанного со скоплениями. Образование скоплений проходит по реакции
![]() >
>
где![]() и
и
![]() —
число атомов А
и В, участвующих
в реакции.
—
число атомов А
и В, участвующих
в реакции.
Так
как![]() отрицательно,
скопления играют большую роль при низких
температурах, а не при высоких, как это
наблюдалось в ранее рассмотренных
случаях.
отрицательно,
скопления играют большую роль при низких
температурах, а не при высоких, как это
наблюдалось в ранее рассмотренных
случаях.
Интересным примером, иллюстрирующим это явление может служить исследованная Даркеном [61] растворимость азота
в железе, содержащем небольшие количества алюминия. Пробы железа, содержащие различные количества растворенного алюминия, выдерживались до состояния равновесия в атмосфере из аммиака и водорода. Степень растворения азота в кристалле регулировалась следующей реакцией:
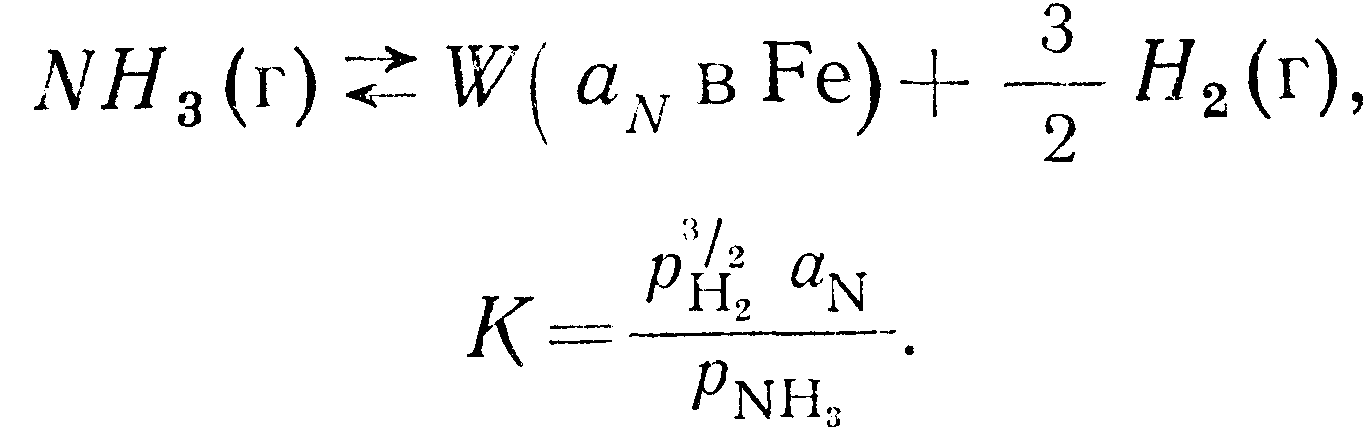

Ясно,
что концентрация растворенного азота
зависит от парциального давления
газообразного
![]() .
Растворимость азота в чистом железе
при 600° С низкая (порядка 0,01% в атмосфере,
состоящей из 1%
.
Растворимость азота в чистом железе
при 600° С низкая (порядка 0,01% в атмосфере,
состоящей из 1%![]() и 99%
и 99%
![]() )•
Более того, реакция между алюминием и
азотом очень экзотермична,
поэтому можно ожидать,
что азот будет диффундировать в кристалл
и стремиться образовывать кристаллы
A1N.
)•
Более того, реакция между алюминием и
азотом очень экзотермична,
поэтому можно ожидать,
что азот будет диффундировать в кристалл
и стремиться образовывать кристаллы
A1N.
Таким
образом, если химические анализы
выполнялись после насыщения в атмосфере,
содержащей 1
%![]() ,
можно ожидать, что общее количество
азота равно растворенному азоту (0,01%)
плюс количество азота, содержащегося
в частичках A1N.
Так как реакция
,
можно ожидать, что общее количество
азота равно растворенному азоту (0,01%)
плюс количество азота, содержащегося
в частичках A1N.
Так как реакция
![]()
экзотермична, практически все количество алюминия в растворе будет окислено, а так как в A1N концентрация азота равна концентрации алюминия, то общее содержание азота будет равно сумме количеств растворенного азота (0,01%) и алюминия.
Кривые,
приведенные на рис. 109, показывают, что
это соотношение не соблюдается. Количество
избыточного азота, введенного в кристалл,
соответствует для нашей атмосферы
формуле
![]() .
Если давление аммиака увеличивается
до 6%, то избыточное количество азота,
вводимого в кристалл, соответствует
формуле
.
Если давление аммиака увеличивается
до 6%, то избыточное количество азота,
вводимого в кристалл, соответствует
формуле![]()
Это
можно объяснить следующим образом. При
600° С константа диффузии алюминия очень
мала, тогда как константа диффузии
азота, растворенного в междоузлиях,
очень велика. Следовательно, азот может
быстро диффундировать в кристалл. Когда атом азота подходит близко к атому
алюминия, они соединяются друг с другом
вследствие большой вероятности
химического взаимодействия. Осаждение
A1N
могло бы иметь место, если бы атомы
алюминия были настолько подвижны, что
могли бы образовывать дискретные частицы
A1N.
Поскольку это не так, то образуются
комплексы азота и алюминия, в которых
каждый атом алюминия окружен в среднем
1,7 атомов азота (в атмосфере, содержащей
6% аммиака). Энергетическая оценка реакции
показывает, что комплексообразование
происходит в большей степени при более
низких температурах.
Когда атом азота подходит близко к атому
алюминия, они соединяются друг с другом
вследствие большой вероятности
химического взаимодействия. Осаждение
A1N
могло бы иметь место, если бы атомы
алюминия были настолько подвижны, что
могли бы образовывать дискретные частицы
A1N.
Поскольку это не так, то образуются
комплексы азота и алюминия, в которых
каждый атом алюминия окружен в среднем
1,7 атомов азота (в атмосфере, содержащей
6% аммиака). Энергетическая оценка реакции
показывает, что комплексообразование
происходит в большей степени при более
низких температурах.
Рассмотрим теперь взаимодействие между примесями и дислокациями. Пусть концентрация растворенной в кристалле примеси равна Хв и примесь распределяется в кристалле двумя путями: произвольно и сконцентрирована вокруг дислокаций. Тогда реакция будет иметь следующий вид:
![]()
В
состоянии равновесия![]()
![]()
или
![]() О
О
Так
как стандартное состояние В
одно
и то же (чистое В)
по
обеим сторонам уравнения реакции, то
![]()
Разность
колебательных энтропии атомов,
растворенных в кристалле и сконцентрированных
вокруг дислокаций, вероятно, мала,
поэтому можно принять![]() .
. Тогда
.
. Тогда
![]() (13.16)
(13.16)
где
![]() —
мольная доля растворенных атомов на
границах дислокаций;
—
мольная доля растворенных атомов на
границах дислокаций;
![]() — мольная
доля в основной массе кристалла;
— мольная
доля в основной массе кристалла;
![]() — разность
парциальной молярной энтальпии
вокруг
дислокаций;
— разность
парциальной молярной энтальпии
вокруг
дислокаций;
![]() — то
же, в кристалле.
Две последние величины
равны энтальпии связывания атома с
дислокацией.
— то
же, в кристалле.
Две последние величины
равны энтальпии связывания атома с
дислокацией.![]() –
более отрицательна, чем
–
более отрицательна, чем![]() ,
потому что энергия деформации понижается,
когда растворенные атомы попадают на
дислокации.
,
потому что энергия деформации понижается,
когда растворенные атомы попадают на
дислокации.
Уравнение
(13.16) справедливо только при высоких
температурах, так как при низких
температурах![]() а поэтому и .
а поэтому и .![]() .
При достаточно низких температурах
отношение .
.
При достаточно низких температурах
отношение .![]() может
иметь такое значение, при котором
может
иметь такое значение, при котором![]()
будет больше единицы. В этом случае вблизи дислокаций примеси скорее будут не в растворенном, а в конденсированном состоянии и образуется практически чистая фаза растворенного вещества на дислокации.
При
повышенных температурах![]() (
(![]() —расстояние
от линии дислокации), так как с
увеличением
—расстояние
от линии дислокации), так как с
увеличением![]() деформационное
взаимодействие уменьшается. Поэтому
деформационное
взаимодействие уменьшается. Поэтому![]() также
зависит от
также
зависит от![]() ,
т. е.
,
т. е.
![]() .
При большом r
концентрация
растворенного вещества приближается
к
.
При большом r
концентрация
растворенного вещества приближается
к![]()
Конденсация
растворенного вещества выявляется
следующим образом: на кривой сила —
деформация имеется крутой предел
текучести. Котрелл [62] предположил, что
предел текучести появляется потому,
что трудно оторвать дислокацию от линии
конденсации атомов примесей. Для
железоуглеродистых сплавов предел
текучести исчезает при температуре
около 700° К. Поэтому предполагается,
что выше этой температуры конденсация
не происходит. При конденсации![]() ,
следовательно, энтальпию
,
следовательно, энтальпию
связывания
в местах дислокаций можно оценить
экспериментально по уравнению (13.16),
так как 700°К — самая низкая температура,
для которой
![]() .
Подставив эти величиныв уравнение
(13.16), находим, что i
.
Подставив эти величиныв уравнение
(13.16), находим, что i![]() равно
приблизительно —0,8- 10~19
дж
(—0,5
эв).
равно
приблизительно —0,8- 10~19
дж
(—0,5
эв).
Общее
число растворенных атомов![]() в
совершенной части кристалла равно
в
совершенной части кристалла равно
![]() –числу
узлов кристаллической решетки
–числу
узлов кристаллической решетки
в
совершенной части кристалла плюс![]() —
число узлов кристаллической решетки
вокруг дислокаций. Число узлов
кристаллической решетки вокруг дислокаций
во много раз меньше, чем в совершенной
части кристалла. Поэтому если
—
число узлов кристаллической решетки
вокруг дислокаций. Число узлов
кристаллической решетки вокруг дислокаций
во много раз меньше, чем в совершенной
части кристалла. Поэтому если![]() в
совершенной части кристалла достаточно
велико, то общая концентрация растворенного
вещества равна среднему его содержанию
в кристалле. Исключение составляет
случай, когда
в
совершенной части кристалла достаточно
велико, то общая концентрация растворенного
вещества равна среднему его содержанию
в кристалле. Исключение составляет
случай, когда![]() в
совершенной части кристалла очень мало.
При этом концентрация растворенного
вещества в месте дислокаций может
составлять значительную часть по
отношению к общему количеству растворенного
в кристалле вещества.
в
совершенной части кристалла очень мало.
При этом концентрация растворенного
вещества в месте дислокаций может
составлять значительную часть по
отношению к общему количеству растворенного
в кристалле вещества.
19.10.2012
Таким образом, растворимость вещества в кристалле зависит от содержания в нем дислокаций. Содержание дислокаций заметно изменяется под действием пластической деформации, поэтому можно ожидать, что растворимость данного вещества будет больше в материале, подвергавшемся холодной обработке, чем в отожженном. Даркен [61 j исследовал растворимость азота в чистом железе в зависимости от деформации. Он обнаружил, что растворимость азота увеличивается вдвое в кристаллах железа, подвергавшихся холодной обработке.
Основной вклад в энергию связывания примесей с дислокациями, как уже было упомянуто выше, образуется за счет уменьшения энергии деформации. Кроме того, может иметь место небольшое кулоновское взаимодействие из-за перегруппировки электронов вокруг дислокаций, и вследствие этого дислокации могут, по-видимому, иметь эффективную валентность. Энергии взаимодействий между различными типами дефектов в различных материалах приведены в табл. 19, где даны, конечно, приближенные величины.

В гл. 11 рассматривалась абсорбция растворенного вещества по границам раздела зерен с позиций классической термодинамики. Теперь рассмотрим взаимодействие примесей и дислокаций с точки зрения статистики. Действительно, некоторые теории, рассмотренные выше для других взаимодействий, применимы к данному случаю.
Взаимодействие примесей и дислокаций может играть очень важную роль. Например, мелкозернистый материал имеет значительную поверхность, поэтому при низких температурах по границам зерен могут конденсироваться заметные количества растворенного вещества. В результате этого, если растворимость в кристалле очень низкая, количество растворенного вещества на границах раздела может намного превысить количество вещества в основной массе кристалла. Это может привести к тому, что растворимость вещества в кристалле оценивается неправильно, за исключением тех случаев, когда используются кристаллы больших размеров.
Например, рассмотрим пробу, состоящую из зерен, имеющих средний размер 0,1 мм. Площадь взаимодействия на 1 см3 пробы составляет около 200 см2. Можно считать, что примерный

размер
атома равен 3• 108
см
и,
таким образом, площадь поперечного
сечения атома составляет около 10™15
см2.
При
полном насыщении
число растворенных атомов по границам
раздела кристалла будет![]()
или около 2-1017 в случае, если растворенное вещество концентрируется только по границам раздела. Так как число узлов кристаллической решетки в кристалле составляет около 5- 1022/с.м3, то химический анализ должен показать, что атомная доля растворенных атомов на границах раздела кристалла составляет 2- 1017/5 • 1022, или 4- 10-6. Если растворимость в основной массе кристалла мала, например, равна только 1017]см3, или 2-106 атомных долей, то химический анализ должен определить большее количество растворенного вещества по границам раздела, чем в основной массе кристалла.
