|
|
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Башкирский государственный аграрный университет» |
Методические указания |
|
С2.Б.11 Ветеринарная микробиология и микология |
|
|
Кафедра инфекционных болезней, зоогигиены и ветсанэкспертизы
|
С2.Б.11 ветеринарная микробиология и микология методические указания
к лабораторным работам
Направление подготовки
111801 Ветеринария
Профиль подготовки
специализация Ветеринарная фармация
Квалификация выпускника
специалист
Уфа 2013
УДК637.12.04/.07:378.147
ББК 36.95+74.58
А 65
Рекомендовано к изданию методической комиссией факультета биотехнологий и ветеринарной медицины (протокол № 2 от « 04 » сентября 2013 г.)
Составитель: профессор, д-р биол. наук А. В. Андреева
доцент, канд. биол. наук З. З. Ильясова
Рецензент: заведующий кафедрой морфологии,патологии,фармации
и незаразных болезней, д-р ветеринар.наук Гимранов В.В.
|
Ответственный за выпуск: |
зав. кафедрой инфекционных болезней, зоогигиены и ветсанэкспертизы, д-р биол. наук, профессор Андреева А.В. |
г. Уфа, БГАУ, кафедра инфекционных болезней,
зоогигиены и ветсанэкспертизы
Лабораторная работа № 1 Техника безопасности при работе в микробиологической лаборатории.
Устройство светового микроскопа. Морфология микроорганизмов.
Цель занятия. Усвоить правила работы в бактериологической лаборатории. Ознакомиться с техникой безопасности и личной профилактикой. Освоить работу с микроскопом и особенностями иммерсионной системы. Изучить основные формы бактерий.
Материалы и оборудование. Микроскопы, окрашенные микроскопические препараты с различными формами микроорганизмов, штативы, пробирки, микробиологические петли, пастеровские пипетки, красители, капельницы с растворами красителей, вставленные в гнезда штативов-колодок, песочные часы, чашки сливные, мостики, микроскопы, вода дистиллированная в колбах для смыва красителей с мазков, банки с дезинфицирующими растворами для отработанных предметных и покровных стекол, салфетки для снятия масла с иммерсионного (х 90) объектива, иммерсионное масло (кедровое или его заменители). Таблицы: схемы устройства биологических микроскопов в разрезе и прохождения лучей в них, схемы устройства и принципы действия электронных микроскопов (просвечивающих, растровых). Формы микроорганизмов.
Микробиологическая лаборатория. Основная задача бактериологических лабораторий - диагностика болезней сельскохозяйственных животных (включая птиц), пушных зверей, рыб, пчел, а также проведение экспертизы молока, мяса и других пищевых продуктов и кормов.
Лабораторию размещают в отдельном здании, вдали от проезжих дорог. В ней предусматривают приемное отделение, бактериологический, вирусологический, биохимический, серологический и патологоанатомический отделы; выделяют специальные помещения для термостатов, стерилизации посуды и питательных сред, для мытья посуды. Для выполнения работы в асептических условиях оборудуют специальные изолированные помещения – боксы. Лабораторных животных размещают в виварии. Кроме того, имеются комнаты для специалистов, обслуживающего персонала, кабинет заведующего, помещения для библиотеки, склада, весовой, раздевалки и др.
В моечной должны быть столы, раковины, электрические или газовые плиты, сушильный, вытяжной и другие шкафы. Вытяжной шкаф необходим для удаления паров воды и некоторых реактивов, используемых при мойке стекол и посуды. Пол и стены желательно облицевать плиткой.
В стерилизационной комнате могут быть 1 или 2 паровых стерилизатора и стол. При наличии 2 паровых стерилизаторов занятия в нескольких подгруппах можно проводить без длительного перерыва.
Стерилизационная комната должна хорошо вентилироваться. Пар из стерилизатора до подъема давления выводят через резиновую трубку во внешнюю среду или направляют в ведро с водой. Дверь (без стекла) и окна должны открываться наружу.
Средоварочная комната служит для приготовления питательных сред. Стены ее должны быть облицованы плиткой, или покрашены масляной краской, пол выстлан плиткой или покрыт линолеумом. В средоварочной необходимы газовая или электрическая плита, электроплитки, ящики с отсеками для сред в пробирках, столы, шкафы для хранения компонентов сред, мясной воды и некоторых сред в колбах, холодильник.
В термостатной могут находиться термостаты разных форм и размеров. Для выращивания плесневых грибов температура в термостате обычно составляет 20-35С, для большинства сапрофитов – 25-300С, для возбудителей инфекционных болезней – 35-370С, термофилов – 40-45С и т. д.
Препараторская – место работы обслуживающего персонала и подготовки оснащения к лабораторно-практическим занятиям.
Бокс-комната используется для посевов и пересевов культур микроорганизмов и проведения научно-исследовательской работы в стерильных условиях. Бокс должен быть застеклен, и иметь предбоксник (тамбур) с раздвижной дверью. Стекла нужно хорошо промазать, чтобы не проникал воздух, а вместе с ним и микроорганизмы, стены облицевать плиткой, или окрасить белой масляной краской, пол покрыть линолеумом. Уборку в боксе производят влажным способом с применением дезинфицирующих средств (2-3 % раствором натрия гидрокарбоната – питьевой соды, 3-5% раствором фенола и т. д.). Воздух стерилизуют бактерицидными лампами (БУВ-15, БУВ-30 и др.), которые излучают ультрафиолетовые лучи длиной 254 нм. В зависимости от степени загрязненности воздуха стерилизацию осуществляют от 30 мин до нескольких часов. Находиться в комнате с включенной бактерицидной лампой нежелательно, так как ультрафиолетовые лучи вызывают острое воспаление роговицы глаз. Для предупреждения поражения необходимо пользоваться защитными очками.
В виварии содержат белых мышей, белых крыс, морских свинок, кроликов и других лабораторных животных. Их чаще используют в научно-исследовательской работе, реже на занятиях, поэтому при отсутствии определенных условий виварий не создают.
Реактивы и некоторые биологические препараты хранят в подвальном помещении или темном сухом стенном шкафу с невысокой температурой в течение года.
Правила работы, техника безопасности и личная профилактика в ветеринарно-бактериологических лабораториях.
-
В помещение входить только в халате и белой шапочке (косынке).
-
В лабораторию нельзя вносить посторонние вещи, продукты.
-
В помещении лаборатории категорически запрещается есть.
-
Перед началом работы обязательно проверяют наличие и исправность приборов, посуды, горелок и др. О замеченных недостатках, неисправностях сообщают преподавателю или лаборанту.
-
Нельзя зажигать одну горелку от другой.
-
Не касаться металлическими и другими предметами проводов и контактных частей электросети. Не включать без ведома преподавателя или лаборанта любую электроаппаратуру.
-
Материал, используемый для учебных занятий, должен рассматриваться как особо опасный.
-
При распаковке материала, присланного для исследования, необходимо соблюдать осторожность - банки с материалом снаружи обтирают ватой, смоченной дезинфицирующим раствором и ставят только на подносы или кюветы.
-
При исследовании поступившего материала и работе с бактериологическими культурами придерживаются общепринятых в микробиологической практике правил исключающих возможность инфицирования работника.
-
Вскрытие трупов лабораторных животных производят в специальной одежде, на соответственно оборудованном столе с помощью необходимых инструментов, используя для этих целей кювету, залитую воском (или парафином). Инструменты после вскрытия помещают в стакан с дезраствором или обжигают на пламени горелки, на стол класть запрещается.
-
При работе с жидким инфицированным материалом используют резиновые баллоны, соединенные с пипеткой.
-
Жидкости, содержащие патогенных микробов, переливают над сосудом с дезраствором.
-
Если патологический материал попал случайно на стол, его немедленно удаляют тампоном, смоченным дезинфицирующим раствором. При попадании зараженного материала на кожу, конъюнктиву, слизистую ротовой полости принимают экстренные меры к обеззараживанию.
-
По окончании работы патологический материал, использованные культуры микроорганизмов, инструменты и поверхность стола обеззараживают. В конце занятия бактериальные культуры и другой материал студенты сдают преподавателю, а рабочее место приводят в порядок.
-
Перед уходом из лаборатории необходимо снять халат, вымыть руки и обработать их спиртом.
Устройство светового микроскопа и работа с ним. Микроскоп – это оптический прибор для получения увеличенных изображений объектов, невидимых невооруженным глазом. Студенческие лаборатории обычно оснащены биологическими микроскопами «Биолам Р-1», МБР-1 (рисунок 1), МБР-3 и др. В микроскопе различают механическую и оптическую части.
Механическая часть включает штатив, предметный столик, тубус и систему винтов для передвижения. Штатив обычно цельнометаллический или пластмассовый с подковообразной или прямоугольной ножкой (микроскопы серии «Биолам»), что обеспечивает устойчивость микроскопа. С его основанием соединена коробка с размещенным в ней механизмом микрометрической фокусировки. К верхней ее части прикреплен предметный столик; по форме он может быть круглый (в старых системах прямоугольный). На его поверхности для фиксации предметных стекол имеются клеммы-зажимы, вставленные в специальные отверстия. По сторонам предметного столика расположены центровочные винты, при помощи которых он перемещается в разных направлениях. К другой стороне коробки при помощи зубчатки (кремальеры) прикреплен дугообразный или прямоугольный тубусодержатель. В верхней его части расположено револьверное устройство, состоящее из двух пластин и соединенное с тубусом. Нижняя пластина вращается и имеет гнезда для ввинчивания объективов, верхняя закреплена неподвижно.
Тубус (труба) может быть наклонным и прямым. В его верхнюю часть вставляется окуляр. Передвижение тубусодержателя и смонтированных на нем систем осуществляется при помощи винтов. Для грубой наводки служит макрометрический винт, для более точной – микрометрический, полный оборот которого поднимает или отпускает тубусодержатель на 0,1мм.
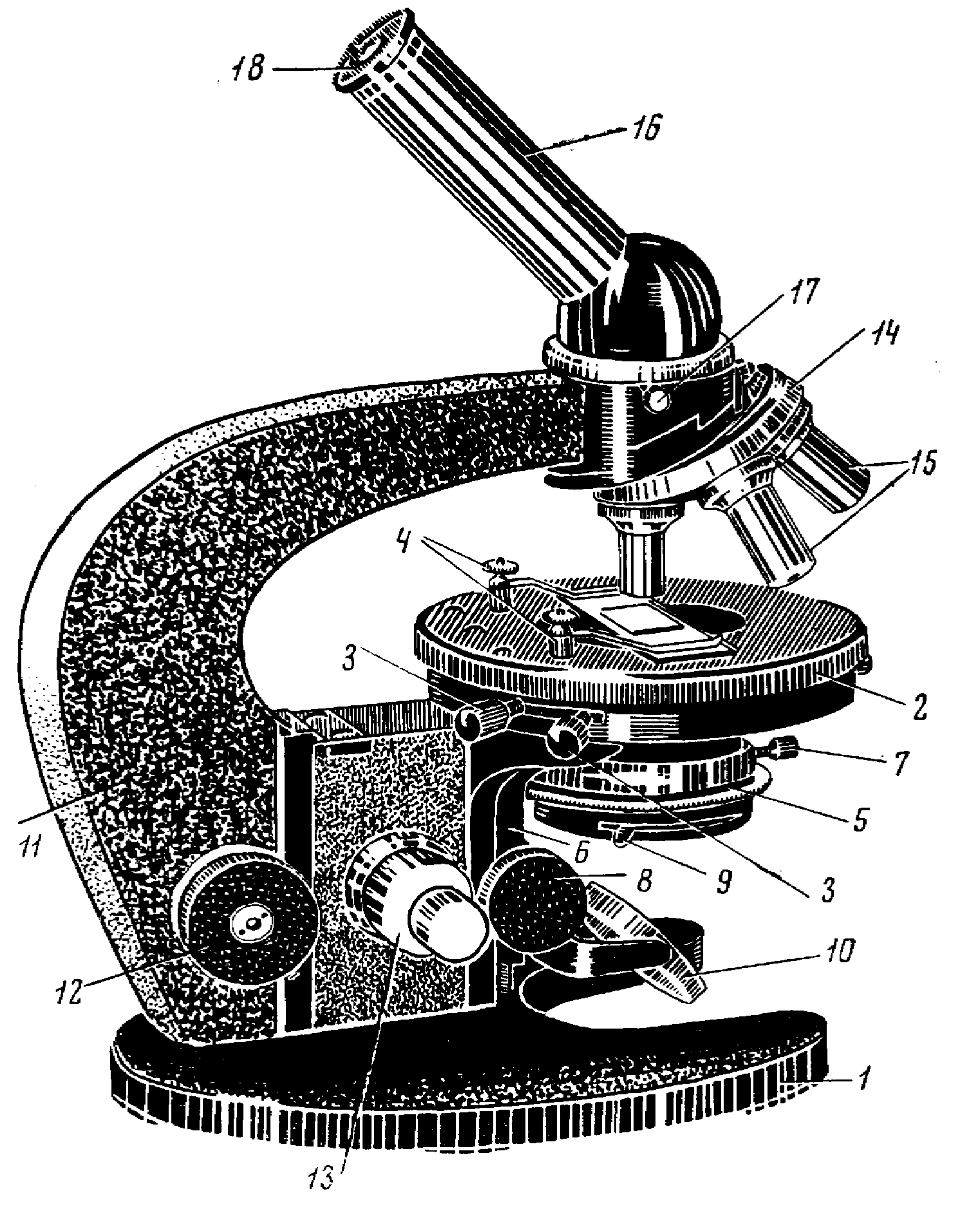
Рисунок 1 Микроскоп МБР-1
1‑подошва или башмак; 2‑предметный столик; 3‑винты для перемещения предметного столика; 4‑клеммы; 5‑конденсор; 6‑кронштейн конденсора; 7‑винт, укрепляющий конденсор; 8‑винт конденсора; 9‑рукоятка ирисовой диафрагмы конденсора; 10‑зеркало; 11‑тубусодержатель; 12 макрометрический винт; 13‑ микрометрический винт; 14‑револьвер; 15‑объектив; 16‑ тубус; 17‑винт для крепления тубуса; 18‑окуляр.
На барабане микрометрического винта нанесено 50 делений, каждое из которых соответствует перемещению системы на 2мкм. Механизм макрометрической фокусировки состоит из системы зубчатых колес и рычага. Во избежание поломок обращаться с ним нужно осторожно. Не рекомендуется вращать его до упора. При вращении рукояток макро- и микрометрического винтов по часовой стрелке тубус микроскопа опускается, против часовой стрелки – поднимается. Вращением рукояток грубой наводки навстречу друг другу находим изображаемый объект.
Оптическая часть включает объективы, окуляры и осветительный аппарат. Объективы – самая важная и наиболее ценная часть микроскопа. Они представляют систему линз, закрепленных в металлической оправе, число которых доходит до 10. Передняя (фронтальная) линза – самая малая, она производит основное увеличение, остальные (коррекционные) исправляют недостатки оптического изображения. Объективы делят на ахроматы и апохроматы. Первые имеют дефект – хроматическую аберрацию (происходит разложение света на составные части спектра). Они просты по устройству и дешевы, поэтому нашли наибольшее распространение. Апохроматы лишены такого недостатка. Они состоят из большого количества линз, изготовленных из стекла разного химического состава.
Все объективы делят на сухие и иммерсионные (погруженные в масло или воду). У сухих между фронтальной линзой и рассматриваемым препаратом находится воздух, у иммерсионных пространство между линзой и препаратом заполнено маслом (кедровым, касторовым, гвоздичным и др.) или водой. Стекло, на котором изготовлен препарат, стекло объективов и масло (кедровое) имеют почти одинаковый показатель преломления света (1,25 и 1,515). Лучи, проходя из одной среды в другую, почти не преломляются, свет не рассеивается, изучаемые объекты хорошо видны и не искажаются. Показатель преломления света, близкий к стеклу, имеет и другие вещества: касторовое масло (1,48-1,49), гвоздичное масло (1,53), смесь касторового и гвоздичного масел (1,515). Воздух и стекло имеют различные данные преломления света (1,0 и 1,52), в результате чего, лучи света при переходе из одной среды в другую преломляются, рассеиваются, происходит частичное искажение объектов. Однако поскольку сухие системы дают сравнительно небольшое увеличение, сильных искажений не наблюдается.
Для иммерсионных объективов характерно короткое фокусное расстояние и большое увеличение. Расстояние между фронтальной линзой и препаратом невелико, поэтому пользоваться этой системой во избежание повреждения линзы и препарата нужно осторожно. Иммерсионные объективы (х 90) рабочих (студенческих) микроскопов имеют пружинную оправу, что исключает повреждение фронтальной линзы и препарата при их соприкосновении. Сухие системы имеют следующие обозначения: 8, 20, 40.
Окуляры вставлены в верхнюю часть тубуса. Они состоят из двух плосковыпуклых линз, обращенных выпуклыми сторонами к объективу и заключены в металлическую оправу. Между линзами имеется постоянная металлическая диафрагма. Линза, обращенная к глазу, называется глазной, к объективу – собирательной. Короткие окуляры дают более сильное увеличение, длинные – слабое. Окуляры в зависимости от этого обозначаются: 7, 10, 15, 20. Цифры на объективах и окулярах показывают увеличение этих систем. Общее увеличение микроскопа равно произведению увеличения объектива на увеличение окуляра. Так, при увеличении объектива 8 и окуляра 7 увеличение микроскопа равно 56, объектива 90 и окуляра 20 – 1800.
Разрешающая способность микроскопа – это величина, обратная тому наименьшему расстоянию, на котором могут быть видны раздельно два соседних элемента структуры. Это одна из важных характеристик микроскопов, в том числе электронных. Самая высокая разрешающая способность у просвечивающих микроскопов. Они превосходят по этому параметру световые микроскопы в несколько тысяч раз. Высокое разрешение у электронных микроскопов достигается очень малой длиной волны электронов. Чем короче длина волны источника излучения, тем выше разрешающая способность микроскопа. Она составляет 1350 (9015).
Осветительный аппарат находится под предметным столиком и представлен конденсором Аббе, диафрагмой и зеркалом. Конденсор Аббе состоит из двух линз, заключенных в металлическую оправу и предназначенных для собирания лучей света, идущих от зеркала. Ирисовая диафрагма находится под конденсором и служит для регулирования освещения препарата путем сужения или расширения ее при помощи рычага. Окрашенные препараты, частично задерживающие свет, рассматривают при открытой диафрагме. Неокрашенные препараты (висячую или придавленную капли) рассматривают с полуоткрытой диафрагмой в слабом пучке света. В таком поле зрения увеличивается контрастность неокрашенных форм микробов, что облегчает их нахождение. Микроскопы серии «Биолам» имеют дополнительную откидную линзу в оправе, которая используется при работе с объективами малого увеличения, зеркало – плоскую и вогнутую поверхности и служит для отражения лучей света. Плоским зеркалом пользуются при хорошем естественном освещении и при микрофотосъемках, вогнутым – при искусственном и слабом естественном.
Микроскоп МБИ-1 имеет два тубуса: наклонный и вертикальный. Первый позволяет рассматривать объекты на горизонтальной поверхности предметного столика. Макро- и микрометрический винты расположены в нижней части штатива. При их вращении руки лежат на столе и длительная работа не вызывает усталости. Бинокулярные микроскопы МБР-3, «Биолам» и другие имеют два наклонных тубуса, что позволяет рассматривать препарат обоими глазами.
Микроскопы, используемые при работе студентов, дают плоское увеличение. В настоящее время применяются объемные микроскопы, которые позволяют рассматривать исследуемый объект в трех измерениях. Такой эффект достигается путем смены фокусного расстояния 50 раз в минуту, создавая оптическое впечатление объемности.
В проекционных микроскопах большое значение имеет освещенность препаратов. Чем она выше, тем лучше видимость. К ним относится лазерный микроскоп с мощным усилителем света, который в отличие от других подобных источников не разрушает биологические объекты и позволяет проецировать изображение на экран.
Работа с иммерсионной системой. Объективы малого увеличения (3,5, 8, 9) применяют главным образом для предварительного осмотра препарата, объективы среднего увеличения (20, 40) – для изучения крупных клеток микроорганизмов (например, грибов); эти объективы называются сухими, поскольку при микроскопии между фронтальной линзой и препаратом находиться воздух. При этом благодаря различию показателей преломления воздуха (n=1) и стекла (n=1,52) часть лучей, освещающих препарат, рассеивается и не попадает в объектив.
|
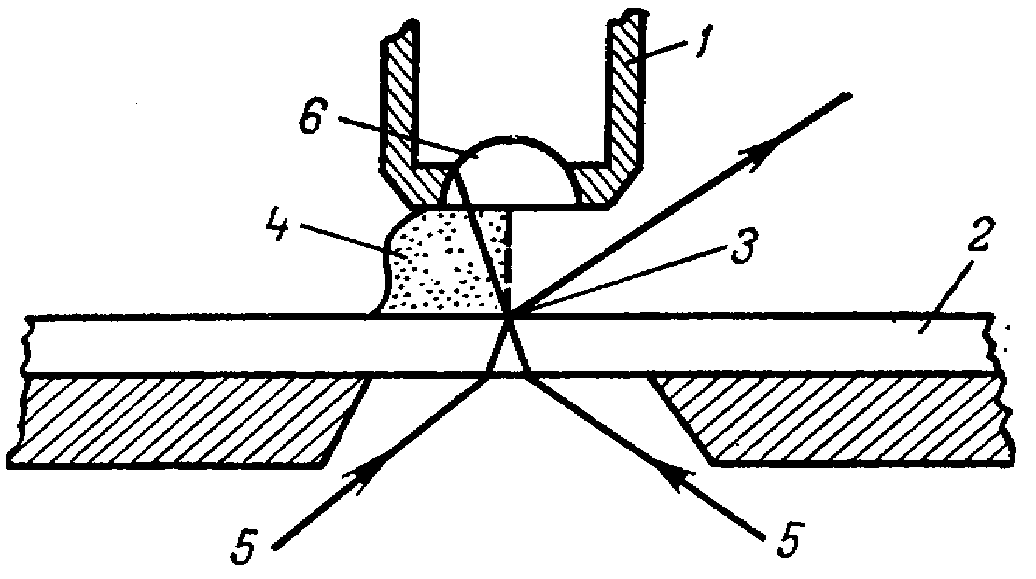
Объективы больших увеличений (85, 90) носят название иммерсионных. При работе с ними необходима максимальная освещенность препарата; устранение рассеивания, неизбежного при работе с сухими объективами, в данном случае достигается путем использования иммерсионных жидкостей, у которых показатель преломления близок к показателю преломления стекла (рисунок 2). |
Рисунок 2 Схема лучей в иммерсионной системе 1 ‑ объектив микроскопа; 2 ‑ предметное стекло; 3 ‑ объект исследования; 4 ‑ иммерсионное масло; 5 ‑ лучи света; 6 ‑ фронтальная линза объектива. |
Вначале под малым увеличением микроскопа наводят свет и определяют на препарате участок микроскопирования. Затем на выбранное место наносят каплю кедрового масла и осторожно (под контролем глаз с боку) погружают в нее фронтальную линзу иммерсионного объектива (90).
По окончании работы объектив поднимают, убирают препарат, а с фронтальной линзы кусочком фильтровальной бумаги убирают остатки масла. Иммерсионные объективы имеют короткое фокусное расстояние (до 2,3 мм) поэтому наводить на резкость следует путем поднимания объектива, а не опускания его, так как при небольшом рабочем расстоянии можно раздавить препарат и повредить фронтальную линзу. После грубой наводки, которую проводят с помощью макрометрического винта, руки переводят на микрометрический винт и осуществляют более точную фокусировку.
Морфология микроорганизмов. По форме бактерий подразделяют на три основные группы: шаровидные (кокки), цилиндрические (палочки) и извитые (рисунок 3).
Кокки. Шарообразные факультативно – анаэробные, редко подвижные, не образующие спор микробы. Кокки относятся к грамположительным микроорганизмам. В зависимости от расположения клеток после деления подразделяются на:
Микрококки – единично или беспорядочно расположенные кокки, в диаметре не превышают 0,5 мкм. Они являются сапрофитами, обитателями воды, воздуха.
Диплококки – кокки, располагающиеся попарно, делятся в одной плоскости, как результат деления одной особи. Они неподвижны, не образуют спор.
Стрептококки – (гр. streptos – плетенный, цепь) деление их происходит в одной плоскости и образующиеся клетки не разъединяются, располагаясь цепочками различной длины. Грамположительные кокки, не образующие спор. Подразделяются на патогенные – возбудители многих инфекционных болезней; фекальные (энтерококки) – обитатели кишечника; молочнокислые – встречаются на различных растениях, в молоке, используются для получения молочнокислых продуктов.
Стафилококки – (гр. staphile – виноградная гроздь) делятся в различных плоскостях без особой закономерности, образуя беспорядочное скопление клеток, иногда напоминающее грозди винограда. Грамположительные факультативные анаэробы не образующие спор являются возбудителями (чаще всего St. aureus) различных
|
гнойно-воспалительных процессов (абсцессов, флегмон, фурункулов, карбункулов, остеомиелитов, гнойных плевритов, ангин, сепсиса, маститов и др.), пищевых токсикоинфекций и т.д. Тетракокки – сочетание шаровидных микробов по четыре, деление у которых происходит в двух взаимно перпендикулярных плоскостях. Сарцины (гр. sarcio – соединяю) – кокки, соединенные в виде пакетов в результате деления клеток в трех взаимно перпендикулярных плоскостях. Среди них болезнетворных видов не обнаружено. |
Рисунок 3 Основные формы бактерий: а – микрококки; б, в – диплококки; г – стрептококки; д ‑ стафилококки; е – тетракокки; ж – сарцины; з, и, к ‑ бактерии; л – вибрионы; м – спириллы |
Палочковидные бактерии. Самая многочисленная и разнообразная группа. Палочковидные микроорганизмы подразделяются на бактерии, бациллы и клостридии. Величина палочковидных форм колеблется от нескольких долей микрометра до 10-15 мкм и более. В связи с этим различают короткие, длинные, тонкие и толстые палочки. Концы у них иногда закруглены, резко обрублены. Некоторые палочковидные бактерии имеют разветвленную (микобактерии) или овоидную форму, характерную для пастерелл. Палочковидные формы могут располагаться одиночно или беспорядочно, группироваться попарно (диплобактерии, стрептобациллы). Среди этой многочисленной группы микроорганизмов встречаются как сапрофитные, так и патогенные виды.
Бактерии – имеют цилиндрическую форму и не образуют спор. Различают палочки, образующие споры. Среди спорообразующих существуют собственно бациллы и клостридии.
Бациллы – спорообразующие палочки по типу дыхания аэробы, т.е. для своего развития нуждаются в свободном молекулярном кислороде воздуха. Грамположительные микробы, образующие при неблагоприятных условиях (вне организма) споры. Диаметр споры меньше ширины клетки. Большинство из них сапрофиты, некоторые служат возбудителями болезней, напр. Bac. antracis.
Клостридии – спорообразующие палочки, по типу дыхания анаэробы (не использующие кислород воздуха), диаметр их споры превышает ширину микробной клетки. Поэтому в процессе спорообразования клетки клостридий изменяют свою конфигурацию.
Термин «клостридии» происходит от греческого слова closter – «веретено». Они являются возбудителями клостридиозов: эмфизематозного карбункула, злокачественного отека, брадзота, столбняка, ботулизма и др.
Извитые бактерии. Это тонкие бактерии, тело которых спиралевидно изогнуто. Извитые бактерии разделяются на вибрионы, спириллы и спирохеты. По величине бактерии бывают крупные (более 4 мкм), средние (1-4 мкм) и мелкие (0,5 мкм).
Вибрионы – имеют форму запятой или летящей чайки, поворот тела вокруг оси не превышает четверти оборота. Они могут встречаться в различных таксономических группах (возбудители кампилобактериоза сельскохозяйственных животных и холеры человека).
Спириллы – характеризуются небольшим числом крупных завитков (не более пяти). Передвигаются с помощью жгутиков. Грамотрицательные, подвижные, факультативные - аэробы.
Спирохеты – имеют штопорообразную форму с большим количеством завитков. Грамотрицательные активно подвижные микроорганизмы. На конце тела пучком расположены жгутики.
Задания
1 Ознакомиться с бактериологической лабораторией, её основным оборудованием, правилами техники безопасности.
2 Изучить устройство светового микроскопа, принципы иммерсионной и тёмнопольной микроскопии.
3 Провести микроскопию готовых окрашенных препаратов, определить и зарисовать формы микроорганизмов.
Вопросы для самоконтроля знаний
1 Принцип работы с иммерсионной системой.
2 Основные морфологические признаки бактерий.
3 Каковы основные правила работы в микробиологической лаборатории.
4 Окуляр и другие оптические части микроскопа, определение степени увеличения микроскопа.
-
Назначение и правила работы с макро- и микрометрическими винтами.
-
Назначение микроскопа при люминесцентной микроскопии.
-
Какие группы шаровидных бактерий различают по их расположению?
-
На чем основано деление бактерий на собственно бактерии, бациллы и клостридии?
9 Какие морфологические группы имеются среди извитых форм?