
Четвертый семестр / Четвертый семестр / Гидрогеология / Шварцев С.Л. Общая гидрогеология
.pdf
Таблица 5 . 1 0
Средний состав глубинных вод Тихоокеанского сегмента Земли
Ведущие компоненты |
Содержание,мг/л |
Микрокомпоненты |
Содержание,мкг/л |
|
|
|
|
рН |
6,4 |
Сl- |
4462 |
SO42- |
1241 |
HCO3- |
374 |
Na+ |
1813 |
Ca2+ |
518 |
К+ |
245 |
Mg2+ |
159 |
NH+ |
44 |
Si02 |
129 |
С у м м а |
8985 |
Fe |
28,9 |
В |
22,1 |
Al |
19,3 |
Вr |
6,8 |
F |
5,1 |
Li |
2,8 |
As |
2,3 |
V |
1,8 |
Mn |
1,7 |
Zn |
1,5 |
Sr |
826 |
Ti |
777 |
Rb |
400 |
Cs |
378 |
Ba |
347 |
Cr |
345 |
Sb |
200 |
Pb |
98 |
Sc |
89 |
Сu |
86 |
Y |
80 |
Co |
56 |
Mo |
26 |
Zr |
24 |
Ge |
22 |
Sn |
21 |
Ga |
19 |
Hg |
16 |
Ag |
11 |
Ni |
9,6 |
Be |
6,3 |
соленость в 2 раза ниже, чем воды Западно-Сибирского бассейна, они содержат в более высоких концентрациях сульфат-ион, калий, аммоний, кремнезем и почти все микрокомпоненты. Особенно резко гидротермы обогащены As, V и Ga (более чем в 100 раз), а также сульфат-ионом , Ti, Cr, Sb, Pb и Ga (от 10 до 100 раз). Вместе с тем гидротермы сильно обеднены Sr и Ва, и в меньшей мере Ni, I, Br и Na. Так проявляется способность термальных вод концентрировать одни элементы и не концентрировать другие.
Таким образом, анализ имеющихся данных показывает, что генетически
различные воды и воды в разных геологических условиях концентрируют разнообразные элементы. Так, крепкие рассолы концентрируют
преимущественно С1, Вг, Са, К, Sr, Ba, Li, Ag, Ti, Pb, соленые воды
— Na, С, N, Zn, I, Cs, Ra, Аu,
162
гидротермы — Si, Fe, Al, Mn, B, Ti, Cr, Rb, As, V, Sb, Ge, Ga, пресные воды верхней гидродинамической зоны — НСО3-, SO42-, Mg, Сu, U, Ni, Mo
и др.
Неравномерность концентрирования элементов и связанное с этим геохимическое различие подземных вод разного генезиса устанавливается и по разному соотношению в них отдельных химических элементов (табл. 5.11).
Табли ца 5 .1 1
Средние значения некоторых показателей для подземных вод глубинно го генезиса
Типы вод |
|
М, |
рН |
SiO2, |
Ca/Na |
K/Na |
SO4/Cl |
Br/Cl |
B/Cl |
|
|
г/л |
|
г/л |
|
|
|
|
|
Океанические |
34,5 |
8,0 |
7,0 |
0,038 |
0,036 |
0,14 |
3,4·10-3 |
2,4·10-5 |
|
Рассолы |
нефтегазовых |
30 |
7,0 |
30 |
0,04 |
0,015 |
5·10-4 |
3·10-3 |
3·10-3 |
районов |
|
|
|
|
|
|
|
|
|
Седиментационные |
20 |
7,1 |
25 |
0,2 |
0,05 |
5·10-3 |
2·10-3 |
5·10-4 |
|
воды |
|
|
|
|
|
|
|
|
|
Вулканогенные воды: |
|
|
|
|
|
|
|
|
|
гейзеры |
|
2,0 |
8,4 |
300 |
0,03 |
0,1 |
0,1 |
2·10-3 |
0,02 |
кислые Cl-SO4-типа |
9,0 |
2,2 |
300 |
0,8 |
0,2 |
0,7 |
6·10-4 |
0,01 |
|
Метаморфогенные |
12 |
6,8 |
80 |
0,05 |
0,02 |
0,05 |
2·10-3 |
0,1 |
|
воды |
|
|
|
|
|
|
|
|
|
Нагретые |
метеорные |
0,2 |
9,2 |
50 |
0,2 |
0,1 |
4,0 |
- |
0,1 |
воды |
|
|
|
|
|
|
|
|
|
Анализ приведенных данных показывает, что все без исключения типы подземных вод отличаются от морских более высокими содержаниями SiO2 , более низкими значениями Mg/Са и более высокими Li/Na и В/Сl отношений.
Каждый генетический тип подземных вод имеет свои характерные черты. Так, седиментогенные, по Д.Е. Уайту, воды отличаются от других относительно низкими содержаниями SiO2, но высокими NH4 , низкими
значениями K/Na, Li/Na, SO4 /C1, F/C1 и В/С1, вулканогенные и метаморфогенные воды, наоборот, высокими содержаниями SiO2 , низкими
NH4 и высокими Mg/Са, K/Na, Li/Na, SO4/C1, F/Cl, B/Cl. Смешанные воды имеют промежуточные значения большинства из отмеченных показателей. Все это еще раз подчеркивает разную геохимическую специализацию отдельных генетических типов подземных вод, детали которой требуют специального анализа.
163
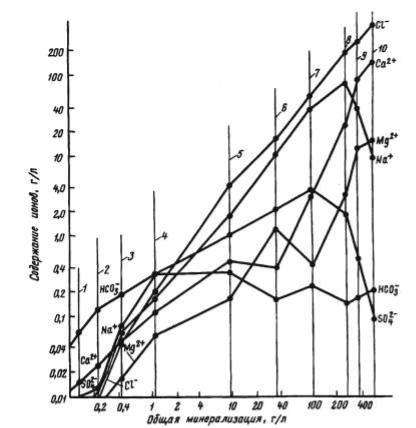
Резкое изменение состава подземных вод происходит и по мере роста общей минерализации. Особенно это наглядно видно по поведению ведущих анионов и катионов (рис. 5.2). Пресные воды с минерализацией до 1 г/л обычно являются гидрокарбонатными, так как последний резко доминирует
над сульфат- и хлор-ионами. При минерализации от 1 до 3 г/л воды чаще всего являются сульфат-
Рис. 5.2.
Зависимость химического состава подземных вод от общей минерализации.
Ср едний состав : |
1 - р ек мир а; 2 - подз емных в о д в ыщелачив ания ; 3 -подземных вод |
|||
зоны гипергенеза; |
4 - подземных вод |
континенталь ного засо ления; 5 |
- |
глубинных |
(термальных) в од |
областей актив ного |
вулканиз ма; 6 -в оды океана ; |
7 |
- слабых |
р ассолов ; 8 - кр епки х р ассолов ; 9 - |
в есь ма крепких рассолов; 10 |
— |
предельно |
|
крепких рассолов |
|
|
|
|
164
ными, а при еще более высокой минерализации — хлоридными. Следовательно, практически все пресные воды на земле являются гидрокарбонатными, а солоноватые, соленые и рассолы — хлоридными. Сульфатные воды имеют ограниченное распространение, главным образом в
районах незначительного континентального засоления, активного вулканизма и рудных месторождений. По кати-онному составу также наблюдаются
строгие закономерности. Ультрапресные и пресные воды с общей минерализацией до 0,4 г/л обычно являются кальциевыми, так как содержание натрия и магния в них значительно ниже. Но натрий более высокими темпами, чем кальций, концентрируется в водах и уже при общей минерализации более 0,4 г/л, как правило, доминирует над кальцием, и воды поэтому становятся натриевыми. Тенденция преимущественного концентрирования натрия сохраняется вплоть до крепких рассолов, и только при общей минерализации более 300 г/л натрий больше в водах не растет и весьма крепкие рассолы становятся кальциевыми. Содержания магния в подземных водах, за редким исключением, ниже, чем натрия и кальция, и магниевые воды поэтому являются экзотическими. Исключение составляют воды морей, океанов и соленых озер, где содержания магния значительно выше, чем кальция. Следовательно, по катионному составу на земле и в
земных недрах резко доминируют натриевые воды.
Отмеченные особенности изменения состава подземных вод с ростом общей минерализации не являются случайными, а обусловлены скрытой глубокой эволюцией их состава по мере взаимодействия с горными породами. Главная особенность такого эволюционного развития состоит в том, что вода, разрушая горную породу, концентрирует только те соединения, степень растворимости которых позволяет такое накопление в соответствии с законом действующих масс. Так, высокоминерализованные воды не могут быть гидрокарбонатными кальциевыми по той простой причине, что растворимость карбонатных соединений кальция низка, и она не позволяет одновременное концентрирование ионов Са2+ и НСО-з или СОз2-. Подробнее эти вопросы освещены в разделе 5.3.
В заключение отметим наиболее общие черты состава подземной гидросферы. Прежде всего обратим внимание на то, что подавляющее
большинство химических элементов сконцентрированы в подземных водах в более высокой степени, чем в океанических. И это касается не только весьма подвижных элементов, таких как С1, Вг, I, Na, Sr, В, но и малоподвижных, среди которых особое место занимают элементы — гидролизаты. Все это говорит о большом своеобразии той геохимической обстановки, которая формируется в подземной гидросфере и которую нельзя поэтому идентифицировать с обстановкой морских бассейнов. Это связано с тем, что подземные воды непрерывно взаимодействуют с горными породами, являются более кислыми и содержат более высокие концентрации
165

органического вещества, способствующего образованию комплексных
соединений с малоподвижными элементами.
Во-вторых, в гидросфере концентрируются наиболее охотно те элементы, которые не склонны к образованию устойчивой кристаллической решетки в
термодинамических условиях верхней части земной коры. К таким относятся элементы, имеющие либо большой ионный радиус (хлор, бром, калий и др.),
либо, наоборот, малый (сера, углерод, азот и др.), но способные к
образованию сложных кислородных соединений с большим радиусом (SO42- , СО32- , NO3- и др.). В этом состоит одно из важнейших отличий состава гид-
росферы от литосферы.
5.1.2. Газовый состав подземных вод
Газы являются одной из ведущих составляющих подземной гидросферы.
По В.И. Вернадскому, они определяют всю химию воды и находятся в динамическом равновесии: подземная вода — природный газ. Различают
сорбированные, растворенные и свободные газы. Между свободными и
растворенными также существует динамическое равновесие, определяемое температурой, давлением и соленостью воды. Основными газами подземной
гидросферы являются О2, N2, СО2, H2S, CH4, СnН2n+2, Н2, NH3, He, Rn и другие.
В осадочных породах, по В.А. Соколову, содержится 2,14·1014 т газов, среди которых преобладают СН4 (39%), СО2 (27%), N2 (26%), тяжелые углеводороды
(6,4%), H2S (0,3%) и Н2 (0,2%). В газах магматических пород преобладает СО2 (83,8%).
Содержание газа в воде определяется газонасыщенностью, под которой
понимается объем газа, растворенный при 0° С и нормальном давлении в 1 л воды. Газонасыщенность обычно выражается в объемных (мл/л) или
весовых (мг/л) единицах. Объем растворенного газа в воде характеризуется
также давлением насыщения или упругостью газа, т.е. величиной давления, которая удерживает газ в водорастворенном состоянии. В единицах СИ
давление насыщения выражается в мегапаскалях (МПа)*.
Способность к растворению газов в воде определяется коэффициентом растворимости каждого газа, т.е. количеством газа насыщающего 1 л воды
при 0° С и нормальном давлении. С ростом температуры коэффициент
растворимости газов, а значит, и их растворимость вначале понижается (табл. 5.12), но при температуре выше 80-90° С растет. С ростом же давления
растворимость газов растет значительно быстрее. Например, растворимость
метана в дистиллированной воде при T=70° С с повышением давления увеличивается следующим образом: при 7 МПа оно составляет 1175,5, а при
28МПа - 3129,9 см 3 /л.
*1 атм = 0,1 М Па .
166
Та б ли ца 5 . 1 2
Растворимо сть газов в воде, мл/л (по Ф.Ф. Лап теву, И.Ю. Соколову)
Газ |
|
|
Температура, °С |
|
||
|
|
|
|
|
|
|
|
0 |
10 |
20 |
30 |
40 |
50 |
|
|
|
|
|
|
|
Азот N2 |
23,5 |
18,6 |
15,5 |
13,4 |
11,8 |
10,9 |
ВодородН2 |
21,7 |
19,8 |
18,2 |
17,2 |
16,6 |
16,3 |
|
|
|
|
|
|
|
Кислород O2 |
48,9 |
38,0 |
31,0 |
26,1 |
23,1 |
20,9 |
|
|
|
|
|
|
|
Метан СH4 |
55,6 |
41,8 |
33,1 |
27,6 |
23,7 |
21,3 |
СероводородH2S |
4670 |
3400 |
2580 |
2040 |
1660 |
1390 |
Диоксид углерода СO2 |
1710 |
1190 |
878 |
665 |
530 |
436 |
|
|
|
|
|
|
|
При одновременном увеличении давления и температуры свыше 100° С растворимость газа растет особенно резко. Поэтому на глубине 2-3 км воды
содержат значительно больше газов, чем у дневной поверхности. Так, в водах океанов и морей содержится лишь 13 см3/л N2 и 3 см3/л О2. В подземных водах на глубине 3-4 км в среднем растворено примерно 500 см3/л газов, а в нефтегазоносных бассейнах, по данным А.А. Карцева, даже 10001500 см3/л, из которых основную часть составляет метан. Максимально
достоверные содержания установлены следующие: О2 20 мг/л, H2S 37 г/л,
СО2 40 г/л, СН 4 + ТУ 13000 см3/л, N2 1200 мл/л, Н 2 1500 мл/л и т.д. [13].
Общее же количество растворенных в подземной гидросфере газов, по данным В.Н. Корценштейна, достигает 10 млрд. км3, в том числе в свободных подземных водах верхнего 5-километрового слоя 0,15 млрд. км3, или 1,5·1017 м3.
Рост минерализации воды оказывает обратное влияние на растворимость
газа, так как сказывается так называемый эффект высаливания. Например, растворимость метана при 20° С и Р=5 МПа в водах с минерализацией 20
г/л составляет 1,23, а в воде с минерализацией 200 г/л — только 0,43 см3/л. На рис. 5.3 представлена зависимость коэффициента растворимости газов в подземных водах только как функция температуры.
По генезису газы в подземных водах делятся на четыре основные группы: 1) газы атмосферного происхождения (О2, СО2, N2, Аr, Кг, Ne), которые проникают в подземную атмосферу из воздуха; 2) газы биохимического происхождения (СН4, H2S, CO2, N2, тяжелые углеводороды), образующиеся при разложении микроорганизмами органических и минеральных веществ; 3) газы метаморфического и магматического происхождения (СО2, Н2, СО, N2, реже НСl, HF, SO2, NH3), образующиеся при повышенных температурах и давлениях в результате преобразования карбонатных
167

Рис. 5.3. Коэффициент растворимости газов в подземных вод ах в за висимости от температуры [29]
и глинистых минералов и воздействия магматических расплавов; 4) газы радиоактивного происхождения (Не, Rn, Аr, 3Н), образующиеся в результате радиоактивного распада.
168
Газы атмосферного происхождения распространены преимущественно в инфильтрационных водах, развитых в зоне активного водообмена;
биохимического генезиса — в седиментационных водах зоны затрудненного
водообмена; метаморфического генезиса — в глубинных водах, включая районы древнего и современного магматизма, альпийской складчатости;
магматического генезиса — в зонах спрединга и рифта; радиоактивного
генезиса — в породах с наибольшей радиоактивностью.
По данным A.M. Овчинникова, А.В. Щербакова, Л.М. Зорькина и др., с глубиной резко меняется газовый состав и газонасыщенность подземных вод.
Если в неглубоких водах зоны активного водообмена преобладают О2 и N2 при газонасыщенности не более 100 мл/л, то в глубоких водах зоны
затрудненного водообмена преобладающим газом становится метан, а
газонасыщенность вод достигает 10 000 мл/л и более. С глубиной уменьшается роль азота и возрастает роль СО2, H2S и Н2 (при
преобладающем значении СН4 + ТУ).
Вертикальная зональность газового состава подземных вод связана в основном с их генезисом в различных гидрогеологических и
геохимических условиях. Зональность может нарушаться в связи с
проявлением азональных явлений. Так, в зоне развития кислородно-азотных газов могут проявляться наложенные зоны радоновых, углекислых, азотных
идругих газов.
5.1.3.Изотопы в подземных водах
Изотопы — разновидности одного и того же химического элемента, различающиеся массой атома, но имеющие одинаковые химические свойства.
Различают стабильные и радиоактивные изотопы химических элементов как самой воды (Н и О), так и содержащихся в ней макро- и микрокомпонентов. В настоящее время известно более 260 стабильных изотопов, около 50 естественных радиоактивных (космического и радиогенного происхождения) и более 1000 искусственных радиоактивных изотопов.
Изотопный состав воды оценивается стабильными изотопами водорода
(протий и дейтерий) и кислорода (16О, 17О и 18О), распространенность которых различна (см. раздел 1.2.3). В природных водах встречаются также
короткоживущие радиогенные изотопы. У водорода их два: 3Н (тритий) с периодом полураспада 12,26 лет и весьма неустойчивый 4Н. Четыре
короткоживущих изотопа кислорода обладают следующими периодами полураспада: 14О - 74 с, 1 5 О - 2,1 мин, 1 9 О - 29 с и 2 0 О - менее 10 мин.
При гидрогеологических исследованиях используется лишь тритий. Будучи изотопом космического происхождения, естественный тритий вместе с атмосферными осадками проникает в недра Земли и служит индикатором для определения возраста, скорости и направления движения подземных вод
[23].
169
Равновесное количество трития на Земле, генерируемое кос мическими лучами, составляет ничтожно малую величину: от 3 до 10 кг. Основная часть (93%) трития содержится в гидросфере и 7% — в атмосфере. Тритий легко окисляется кислородом до молекулы НТО. При взаимодействии с
меченными тритием глинистыми породами происходят обменные реакции между тритием и про-тием. Этот эффект используется при изучении
скорости движения подземных.вод в горных породах. Измеряется содержание трития в тритиевых единицах (ТЕ). Тритиевая единица соответствует содержанию одного атома трития на 1018 атомов протия.
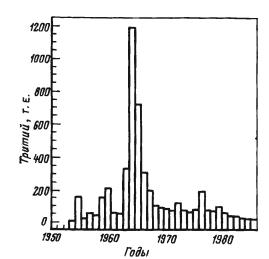
Использование трития для решения гидрогеологических и гидрологических задач началось в 50-х годах после первых испытаний термоядерного оружия, когда в атмосферу было выброшено боль шое количество этого изотопа водорода (см. рис. 3.5, рис. 5.4). Вызванное этими испытаниями повышение количества трития в атмосферных водах было принято за точку отсчета, от которой по сдвигу тритиевого максимума можно следить за временем удаления природных вод от исходной точки. Особенности обмена воздушными массами между стратосферой и тропосферой обусловливает сезонные колебания трития в атмосферных осадках, так как в поверхностных и подземных водах эти колебания
сглаживаются. Отставание максимумов трития в речных водах по отношению к максимумам в атмосферных осадках позволяет судить о
скоростях водообмена на водосборах.
Относительно хорошо изученными являются тяжелые — дейтерий D и 18О, которые несут в себе информацию о молекуле воды и отражают ее
геологическую историю вследствие процессов фракционирования (разделения) изотопов. Последнее обусловливается
Рис. 5.4. Накопление три тия в
атмосферных осадках района Бохолт (ФРГ) от термоядерных взрывов [30]
170
многими физическими и физико-химическими процессами: испарением, конденсацией воды, растворением и осаждением вещества, взаимодействием в системе вода — порода — газ —органическое вещество.
Фракционирование изотопов водорода и кислорода происходит главным
образом при фазовых переходах в процессе круговорота воды в природе. Концентрация 2Н и 18О контролируется равновесием жидкости и водяного
пара. Поскольку молекула воды 1H16O более летуча (см. табл. 1.3), при испарении и конденсации жидкая фаза обогащается 2Н и 18О, а парообразная — обедняется. Подобное фракционирование происходит и при замерзании воды, вызывая понижение концентрации обоих изотопов в твердой фазе по сравнению c жидкой.
Вкачестве эталона для оценки концентрации 2Н и 18О используется SMOW
—стандарт среднеокеанической воды, который отвечает абсолютному
содержанию дейтерия — 0,01985‰ и тяжелого кислорода — 0,1985‰. Концентрации дейтерия и тяжелого кислорода измеряются в виде отклонения от стандарта, приравненного к нулю, и оцениваются как отношение (δ) в ‰ (промилле). Положительные значения δD и δ18О показывают "утяжеление", а отрицательные — "облегчение" конкретной воды по отношению к стандарту.
Круговорот воды поддерживает в определенных пределах постоянство изотопного состава метеорных и поверхностных вод Земли в зависимости от географической широты, высоты и среднегодовой температуры местности. Концентрация тяжелых изотопов водорода и кислорода в атмосферных осадках зависит от температуры конденсации и варьирует в широких
пределах. В снеге меньше тяжелых изотопов, чем в дожде. Как показал американский исследователь Г. Крейг, высокое содержание 2Н и 18О
свойственно метеорным водам тропических широт, где оно приближается к значениям океанической воды. Намного ниже концентрация тяжелых изотопов в метеорных водах умеренного пояса, а самая низкая — в атмосферных осадках и льдах полярных областей (рис. 5.5). Так, лед Антарктиды из всех известных типов воды наиболее легок по изотопному составу: δD равно -440‰, а δ18О только -55‰. Любопытно, что изменение изотопного состава метеорных вод разных широт происходит вдоль прямой линии, которая получила название линии Крейга в честь исследователя, впервые обосновавшего ее положение и внесшего большой вклад в изучение изотопного состава воды. Линия Крейга для метеорных вод земного шара имеет вид:
δ2Н = 8δ18О + 10%,. |
(5.12) |
Изотопный состав подземных вод также в значительной степени зависит от атмосферных осадков, но эта зависимость носит более сложный характер.
Ближе всего к атмосферным осадкам по изотопному составу воды зоны активного водообмена, для которых наблюдаются определенная широтная и высотная зональности, связанные с изменением среднегодовых температур. В более глубоких
171
