
- •1. Предмет и структура физики.
- •2. Предмет механики.
- •3. Материальная точка. Система отсчёта. Радиус-вектор. Траектория. Путь. Вектор перемещения. Скорость.
- •4. Вычисление пройденного пути. Средняя скорость прохождения пути.
- •5. Ускорение. Понятие о кривизне. Нормальное и тангенциальное ускорение.
- •6. Основная задача механики.
- •7.Абсолютно твердое тело. Поступательное и вращательное движение. Вектора элементарного угла поворота, угловой скорости и углового ускорения. Связь линейных и угловых характеристик движения.
- •8. Первый закон Ньютона - постулат существования инерциальной системы отсчета.
- •9. Понятие силы и инертной массы. Импульс. Второй закон Ньютона.
- •10. Третий закон Ньютона.
- •11. Понятие о механической системе. Закон сохранения импульса (зси).
- •12. Центр масс. Теорема о движении центра масс.
- •13. Центр масс. Теорема о движении центра масс.
- •14. Реактивное движение. Формула Циолковского.
- •15. Проблемы космических полетов.
- •16. Понятие о механической работе и энергии. Мощность
- •17. Кинетическая энергия.
- •24. Абсолютно упругий удар.
- •25. Абсолютно не упругий удар.
- •26. Момент силы, момент импульса относительно точки и оси.
- •27. Уравнение моментов.
- •28. Закон сохранения момента импульса системы материальных точек.
- •29.Основное ур-ие динамики вращ. Движения.
- •30. Момент инерции. Теорема Гюйгенса – Штейнера.
- •32. Кинетическая энергия вращательного движения.
- •33. Работа и мощность при вращательном движении.
- •36.Скорость света –инвариант относительно исо. Опыт Бронч - Бруевича.
- •39. Преобразования Лоренца
- •40.Относительность одновременности.
- •41. Длина отрезка в разных системах отсчета.
- •42. Интервал времени в разных системах отсчета. Опыт с мюонами.
- •46. Взаимосвязь массы и энергии. Кинетическая энергия в релятивисткой механике.
- •47. Взаимосвязь импульса и энергии, кинетической энергии и импульса.
- •48. Частицы с массой покоя, равной нулю.
- •49. Понятие о неинерциальных системах отсчета.
- •50. Сила инерции. Принцип Даламбера.
- •51. Центробежная сила инерции.
- •52. Сила Кориолиса. Закон Бэра.
- •53. Закон всемирного тяготения.
- •54. Напряженность поля тяготения. Принцип суперпозиций для потенциалов.
- •55. Работа в поле тяготения. Потенциальная энергия в поле тяготения.
- •56. Потенциал поля тяготения. Принцип суперпозиций для потенциалов. Эквипотенциальные поверхности.
- •57. Космические скорости.
- •58. Законы Кеплера
- •59. Статистический и термодинамический методы.
- •60. Понятие об идеальном газе. Законы идеального газа.
- •61. Поток молекул.
- •62. Уравнение Клаузиуса - основное ур-е мкт идеального газа.
- •63. Следствия из основного ур-ия мкт.
- •Законы идеального газа
- •67. Поток молекул смотреть в билете №61
- •68. Следствия из основного уравнения смотреть в билете №63
- •69. Эргодическая система
- •70. Распределение молекул по скоростям.
- •1. Средняя арифмитическая скорость
- •2.Средняя квадратичная.
- •72. Барометрическая формула.
- •73. Распределение Больцмана по потенциальным энергиям. Опыт Перрена.
- •74. Степени свободы. Закон равномерного распределение энергии по степеням свободы.
- •75. Внутренняя энергия системы - функция состояния. Макроскопическая работа. Теплота. Эквивалентность теплоты и работы. Первое начало термодинамики.
- •81.Неполноценность I начала термодинамики. Различные формулировки второго начала. Круговые процессы. Тепловые машины.
- •80. Адиабатный процесс. Уравнение адиабаты. Политропный процесс.
- •76.Применение 1 начала терм-ки к изопроцессам в идеальном газе
- •82.Цикл Карно с идеальным газом
- •86.Закон возрастания энтропии. Гипотеза о тепловой смерти Вселенной
- •87.Статистический смысл 2-го начал термодинамики.
- •90.Общие сведения о явлениях переноса. Средн длина свободн пробега молекул.
- •91. Диффузия.
- •84.Термодинамическая вероятность макроскопического состояния. Распределение молекул по объёму.
- •85.Энтропия. Формула Больцмана.
1. Средняя арифмитическая скорость
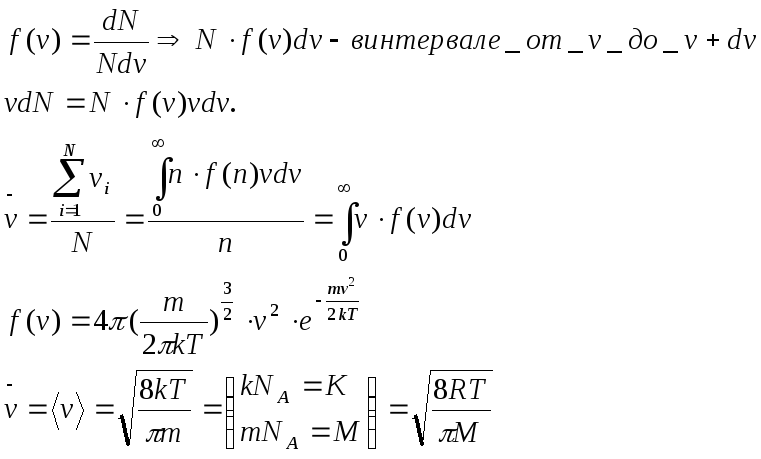
2.Средняя квадратичная.
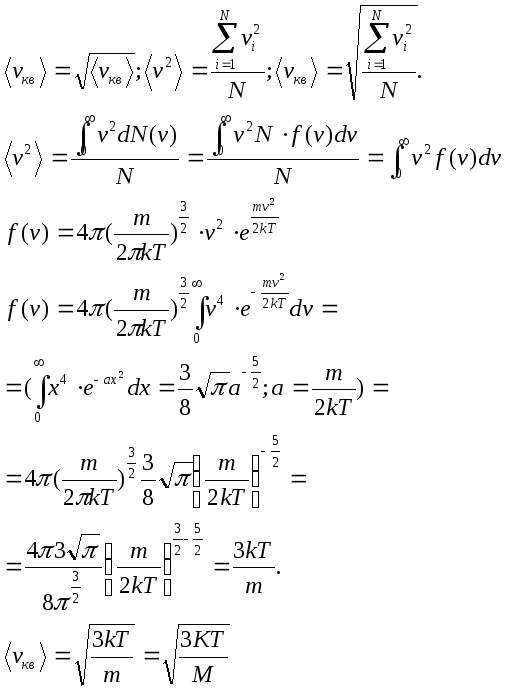
3.Наивероятнейшая скорость-соответствует максимумуму распределения Максвела.
![]()
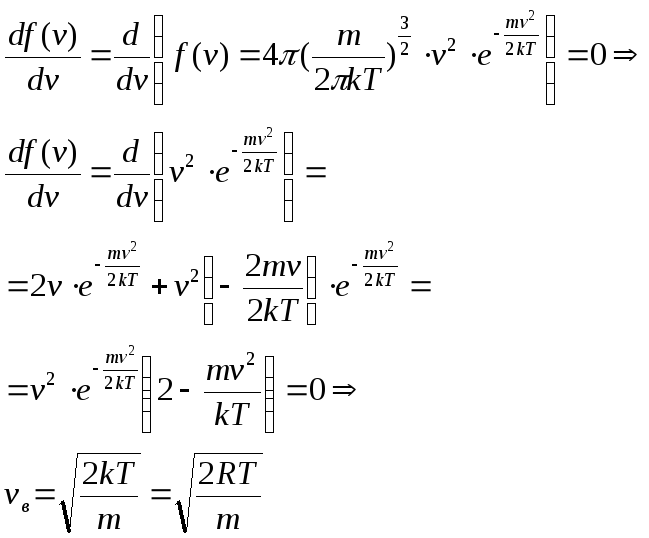
72. Барометрическая формула.
Б арометрическая
формула-зависимость давления газа от
высоты (в поле тяготения Земли).
арометрическая
формула-зависимость давления газа от
высоты (в поле тяготения Земли).
Два процесса: 1) тяготения; 2)тепловое хаотическое движение молекул приводят к некоторому стационарному состоянию.
Барометрическая формула:
Предложим: 1)идеальный газ, m=const; 2) поле тяготения однородного, g=const; 3) T=const
![]()
![]()
Знак «-» отражает то, что с увеличением h давление p падает.
![]()
![]()
![]() сила давления
столбца воздуха высотой dh сечением S.
сила давления
столбца воздуха высотой dh сечением S.
m-масса молекулы; n-концентрация молекул.
Применение: прибор для изменения высоты над поверхностью земли- высотомер(альтиметр).
 Для концентрации
молекул.
Для концентрации
молекул.
![]()
![]()
Уравнение (7).
![]()
73. Распределение Больцмана по потенциальным энергиям. Опыт Перрена.
mgh=Ep(h).
![]() (1)-потенциальная
энергия в поле тяготения.
(1)-потенциальная
энергия в поле тяготения.
![]() (2)-распределение
Больцмана. Больцман показал, что
распределение такого вида справедливо
для любого внешнего поля.
(2)-распределение
Больцмана. Больцман показал, что
распределение такого вида справедливо
для любого внешнего поля.
![]() (3) no-концентрация
молекул с нулевой потенциальной энергией
U=0.
(3) no-концентрация
молекул с нулевой потенциальной энергией
U=0.
Опыт Перенна.
![]()
m-масса шарика; mж- масса объёма жидкости, вытесненной шариком.
![]()
![]()
![]()

Опыт Перена. Определение число Авогадро.

![]()
![]()
![]()
Получим
![]()
Точное значения
74. Степени свободы. Закон равномерного распределение энергии по степеням свободы.
С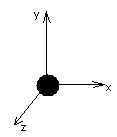 тепени
свободы- число независимых координат,
определяющих положение и конфигурацию
системы в пространстве.
тепени
свободы- число независимых координат,
определяющих положение и конфигурацию
системы в пространстве.
1.Одноатомный газ имеет три степени свободы,
т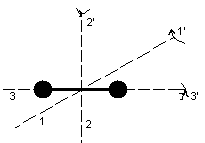 .к.
может двигаться в 3-х направлениях.
Следовательно, обладает 3 поступательными
степенями свободы.
.к.
может двигаться в 3-х направлениях.
Следовательно, обладает 3 поступательными
степенями свободы.
Молекула- материальная точка.
Энергия вращательного движения нет
![]()
2.Двухатомная жестко связанная молекула (совокупность двух точек, связанных недеформируемой связью)
обладает 3 поступательными и 2 вращательными степенями свободы. Вращение относительно оси 33’ не меняет положение молекулы в пространстве.
3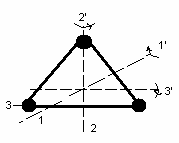 .
Трех атомная жестко связанная молекула.
.
Трех атомная жестко связанная молекула.
обладает 3 поступательными и 3 вращательными степенями свободы.
Закон равномерного распределение энергии по степеням свободы.
е![]() сли
система частиц находится в состоянии
термодинамического равновесия, то
средняя кинетическая энергия хаотического
движения молекул, приходится на 1 степень
свободыпоступательного
и вращательного
движения равна
сли
система частиц находится в состоянии
термодинамического равновесия, то
средняя кинетическая энергия хаотического
движения молекул, приходится на 1 степень
свободыпоступательного
и вращательного
движения равна
Для реальных молекул, не обладающих жёсткими
связями между молекулами, необходимо учитывать также степени свободы колебательного движения.
На колебательную степень свободы приходится не только кинетическая энергия, но и потенциальная, причём среднее значение кинетической энергии равно среднему значению и
![]()
равно , Следовательно, средняя суммарная энергия
![]()
молекулы
![]()
![]()
В идеальном газе взаимная потенциальная энергия молекул
т.к. молекулы между собой не взаимодействуют, то рассматривается только кинетическая энергия, и
1. для 1 моля газа внутренняя энергия равна сумме кинетических энергий NA молекул:
![]()
Для произвольной массы m газа:
![]() -количество вещества.
-количество вещества.
