ответы на первую часть (терм)
.docx8,9,10,11,1214,1521,23
-
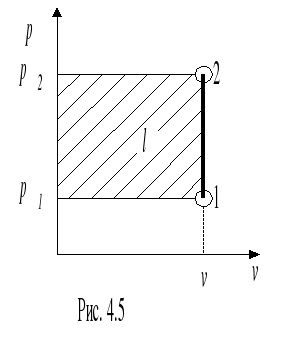
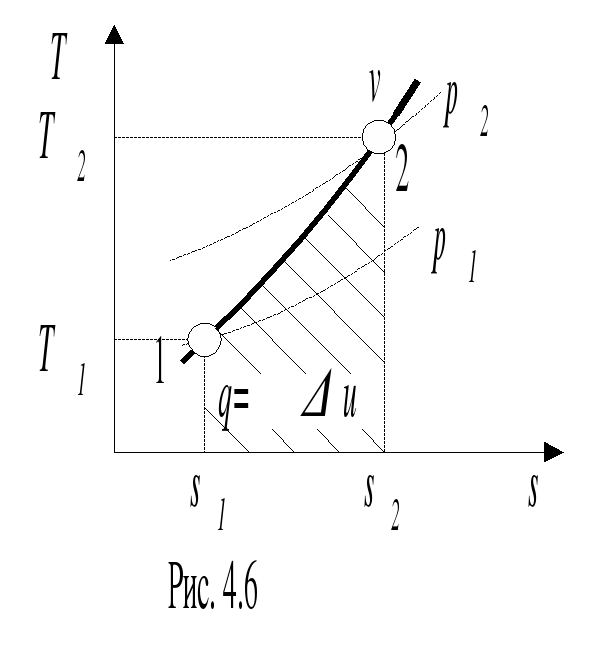
Расчёт изохорного процесса идеального газа. Изобразить процесс в p-v и T-S диаграммах.
|
|
-
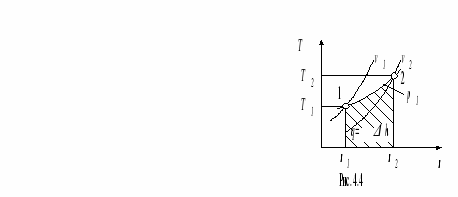
Расчет изобарного процесса

![]()
![]()
![]()
![]()
![]()
6.
Изотермический процесс идеального газа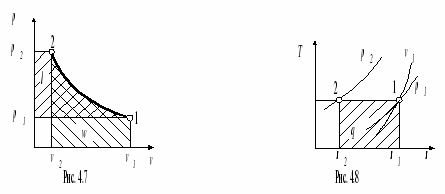
![]()
|
|
![]()
![]()
![]()
![]() 7.
Дифференциальная связь для s=f(T,p)
Использование этой связи для расчёта
энтропии.
7.
Дифференциальная связь для s=f(T,p)
Использование этой связи для расчёта
энтропии.

8. Расчитать политропный процесс идеального газа (О2) при заданных р1, v1, р2(р2˃р1) n=1,6 (n=0,85).Изобразить процесс вp-v, T-S – диаграммах
9. Расчитать политропный процесс идеального газа (О2) при заданных р1, v1, р2(р2˂р1) n=1,6 (n=0,85). Изобразить процесс вp-v, T-S – диаграммах
10. Рассчитать адиабатный процесс идеального газа при заданных p1,t1, р2˃р1 . Изобразить процесс вp-v, T-S – диаграммах
![]()
![]()

13. Расчёт калорических параметров идеальных газов и их смесей
Внутренняя энергия (u), энтальпия (h), энтропия (s) являются калорическими параметрами и рассчитываются по формулам через термические параметры p, v, T. Расчетные формулы могут быть получены на основании дифференциальных связей термодинамики
|
|
|
Калорические параметры смесей идеальных газов рассчитываются по формулам вида
|
|
|
|
|
|
16. Анергия и эксергия. Эксергетический КПД. Понятие. Расчёт.
Работоспособность, термин, применяемый в термодинамике для обозначения максимальной работы, которую может совершить система при переходе из данного состояния в равновесие с окружающей средой. Вторую составляющую А, наз. анергией (от греч. "а" - отрицат. частица и ergon - работа), ни в какую иную форму энергии, включая мех. работу, превратить нельзя.
Эксергетический
кпд системы. Диаграммы Грассмана и
непосредственно эксергетич. баланс в
форме ур-ния позволяют найти количеств,
показатели эффективности работы
анализируемой ХТС. Среди этих показателей
наиб. распространен эксергетич.
кпд![]() определяемый
соотношением:
определяемый
соотношением:
![]()
где![]() -
сумма потоков эксергий, отражающая
полезный эффект от функционирования
системы;
-
сумма потоков эксергий, отражающая
полезный эффект от функционирования
системы;![]() -
полные затраты эксергий на достижение
заданного эффекта.
Для
идеального, полностью обратимого
процесса, в к-ром потери
-
полные затраты эксергий на достижение
заданного эффекта.
Для
идеального, полностью обратимого
процесса, в к-ром потери![]() отсутствуют,
отсутствуют,![]() =
1; если подведенная эксергия полностью
теряется в процессе, то
=
1; если подведенная эксергия полностью
теряется в процессе, то![]() =
0. В реальных процессах всегда соблюдается
неравенство: 0 <
=
0. В реальных процессах всегда соблюдается
неравенство: 0 <![]() <
1; при этом чем выше численное значение
<
1; при этом чем выше численное значение![]() тем
термодинамически совершеннее система.
Из ф-лы (13) следует также, что разность
между эксергиями, обусловливающими
полезный эффект и эксергетич. затраты,
всегда равна суммарной потере эксергий
от необратимости протекающих в системе
процессов
тем
термодинамически совершеннее система.
Из ф-лы (13) следует также, что разность
между эксергиями, обусловливающими
полезный эффект и эксергетич. затраты,
всегда равна суммарной потере эксергий
от необратимости протекающих в системе
процессов
17. Параметры торможения в адиабатном потоке пара Н2О.
Параметры торможения потока водяного пара с характеристиками p1, t1, скоростью c1 определяются с помощью диаграммы либо по таблицам воды и водяного пара. При этом энтальпию (h0) рассчитывают по уравнению:
![]() Принимая
процесс торможения (1-0) адиабатным,
параметры p0, T0, v0 находят
в точке пересечения s1 и h0 (точка
0, рис. 6.4).
Принимая
процесс торможения (1-0) адиабатным,
параметры p0, T0, v0 находят
в точке пересечения s1 и h0 (точка
0, рис. 6.4).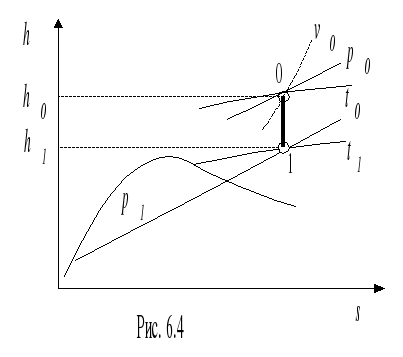
![]()
|
|
(6.7) |
Подставляя ![]() в
(6.7), получаем
в
(6.7), получаем
|
|
(6.8) |
Давление и объем в состоянии торможения рассчитываются по уравнениям
|
|
|
|
|
|
22. Температура торможения в адиабатном потоке идеального газа.
температура Т0 изоэнтропически (без теплообмена с внешней средой) заторможенного газа. Играет важную роль при движении идеального совершенного газа; в так называемом адиабатическом течении она соответствует максимально возможной температуре газа и характеризует его полную удельную энергию, которая остаётся постоянной вдоль линии тока. При отсутствии массовых сил её значение вычисляется на основе Бернулли уравнения: T0=T + V2/2cp, где Т — температура, V — скорость, cp — удельная теплоёмкость газа при постоянном давлении. Часто используется в аэродинамических расчётах в качестве характерного масштаба температуры.
25. Термические параметры состояния рабочего тела(давление объём, температура. Уравнение состояния идеального газа.
К
основным параметрам состояния, поддающимся
непосредственному измерению простыми
техническими средствами, относятся
абсолютное давление ![]() ,
удельный объём
,
удельный объём ![]() и
абсолютная температура
и
абсолютная температура ![]() .
Эти три параметра носят название
термических параметров состояния.
.
Эти три параметра носят название
термических параметров состояния.
Объём —
количественная характеристика
пространства, занимаемого телом или
веществом. Объём тела или вместимость
сосуда определяется его формой и
линейными размерами.
![]()
Давле́ние ![]() — физическая
величина,
численно равная силе F,
действующей на
единицу площади поверхности S перпендикулярно этой
поверхности. В данной точке давление
определяется как отношение нормальной
составляющей силы
— физическая
величина,
численно равная силе F,
действующей на
единицу площади поверхности S перпендикулярно этой
поверхности. В данной точке давление
определяется как отношение нормальной
составляющей силы ![]() ,
действующей на малый элемент поверхности,
к его площади:
,
действующей на малый элемент поверхности,
к его площади:
![]()
Температу́ра (от лат. temperatura — надлежащее смешение, нормальное состояние) — скалярная физическая величина, характеризующая состояние термодинамического равновесиямакроскопической системы. Температура всех частей системы, находящейся в равновесии, одинакова. Если система не находится в равновесии, то между её частями, имеющими различную температуру, происходит теплопередача (переход энергии от более нагретых частей системы к менее нагретым), приводящая к выравниванию температур в системе.
Уравнение
состояния идеального
газа—
формула, устанавливающая зависимость
между давлением,молярным
объёмом и абсолютной
температурой идеального
газа.
Уравнение имеет вид:
![]() ,
где
,
где![]() — давление,
— давление,![]() — молярный
объём,
— молярный
объём,![]() — универсальная
газовая постоянная,
— универсальная
газовая постоянная,
![]() — абсолютная
температура,К.
— абсолютная
температура,К.
18. Критические параметры при истечении, критическая скорость, отношение давлений и температур для идеального газа.

19. Теплоемкость: истинная и средняя. Связь между ними. Ср и сv. Уравнение Майера. Теплоемкость смеси. !!!!!!!!!!!!!!!!!!!!!!!!
Теплоемкостью тела называют кол-во теплоты, необходимой для нагрева тела на один градус.

 24.
Дифференциальные связи термодинамики.
Их назначение, получение(на примере
одной по выбору) и использование для
расчёта параметров идеального газа.
!!!!!!!!!!!!!!!
24.
Дифференциальные связи термодинамики.
Их назначение, получение(на примере
одной по выбору) и использование для
расчёта параметров идеального газа.
!!!!!!!!!!!!!!!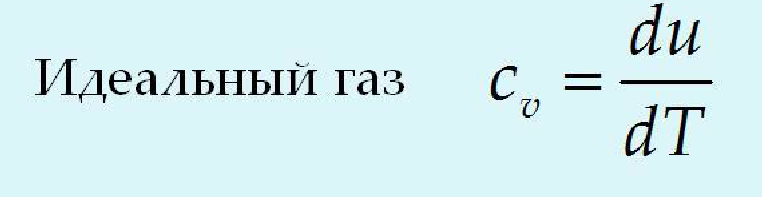


Вторые вопросы:
9 вопрос.Первый зк термод. Продолжение на фото Аня!


При описании
состояния вещества и его фазовых
переходов обычно используются
переменные ![]() и
и ![]() ,
в которых изображаются кривые равновесия
при фазовых переходах данного вещества.
Диаграмма, построенная в этих переменных,
называется диаграммой
состояния. Каждой
точке на этой диаграмме соответствует
определенное равновесное состояние.
Она позволяет определить, какие фазовые
переходы происходят при тех или иных
процессах.
,
в которых изображаются кривые равновесия
при фазовых переходах данного вещества.
Диаграмма, построенная в этих переменных,
называется диаграммой
состояния. Каждой
точке на этой диаграмме соответствует
определенное равновесное состояние.
Она позволяет определить, какие фазовые
переходы происходят при тех или иных
процессах.
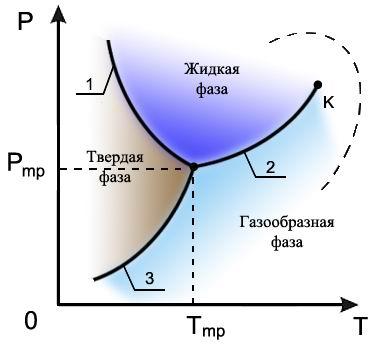
Рассмотрим случай термодинамической системы, в которой в равновесии находятся сразу три фазы однородного по физико-химическим свойствам вещества (например: лед, вода и пар). Равновесие такой системы будет наблюдаться при одновременном выполнении трех условий, соответствующих равновесию этих фаз между собой. Эти условия в общем виде можно записать в форме
|
|
(7.52) |
Равенства (7.52) приводят к системе из двух независимых уравнений
|
|
(7.53) |
|
|
(7.54) |
Решение
этой системы уравнений при условии
отсутствия химических превращений дает
совершенно определенные значения
давления ![]() и
температуры
и
температуры ![]() ,
при которых три фазы могут существовать
одновременно. Точка на диаграмме
состояния в переменных
,
при которых три фазы могут существовать
одновременно. Точка на диаграмме
состояния в переменных ![]() и
и ![]() (см.
рис. 7.6), соответствующая указанным
значениям давления и температуры,
называется тройной
точкой.
В этой точке встречаются кривая
плавления 1,
разделяющая твердую и жидкую фазы, кривая
испарения 2,
разделяющая жидкую и газообразную фазы,
и кривая
возгонки 3,
разделяющая твердую и газообразную
фазы.
(см.
рис. 7.6), соответствующая указанным
значениям давления и температуры,
называется тройной
точкой.
В этой точке встречаются кривая
плавления 1,
разделяющая твердую и жидкую фазы, кривая
испарения 2,
разделяющая жидкую и газообразную фазы,
и кривая
возгонки 3,
разделяющая твердую и газообразную
фазы.
|
|
|
Рис. 7.6. Диаграмма состояния 1 - кривая плавления, 2 - кривая испарения, 3 - кривая возгонки |
Кривая испарения 2 заканчивается критической точкой (К), в которой исчезают отличия жидкой и газообразной фаз. Если фазовый переход осуществляется в обход критической точки, как показано пунктирной линией на рис. 7.6, то пересечения кривой испарения не происходит и фазовое превращение проходит путем непрерывных изменений без образования границы раздела фаз.
Для однородного по своим физико-химическим свойствам вещества в равновесии одновременно могут находиться не более трех фаз. Это означает, что для равновесной системы могут существовать только точки, в которых сходятся три фазы вещества, например, соответствующие трем его агрегатным состояниям. Точки, в которых могли бы одновременно существовать более трех фаз, не реализуемы.
Вещество в трех различных агрегатных состояниях может наблюдаться и при значениях температуры и давления, не соответствующих тройной точке. Например, в природе при различных погодных условиях наблюдаются одновременно лед, вода и водяной пар (последний, как правило, косвенным образом). Однако, в отличие от состояния в тройной точке, указанные состояния не являются равновесными, и для них характерен постоянный переход вещества из одной фазы в другую.
Значения давления и температуры в тройной точке для различных веществ очень стабильны, что позволяет использовать тройную точку для калибровки различных температурных шкал. Тройная точка воды используется в качестве основной реперной точки для температурных шкал Кельвина и Цельсия (см. параграф 1.3).
Отличительной особенностью гелия, диаграмма состояния которого схематически изображена на рис. 7.7, является отсутствие тройной точки, соответствующей одновременному равновесному существованию твердой, жидкой и газообразной фаз.