
- •ВВЕДЕНИЕ
- •ОСНОВНЫЕ КЛАССЫ ХИМИЧЕСКИХ СОЕДИНЕНИЙ
- •ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ ЭКВИВАЛЕНТОВ МЕТАЛЛА
- •ОПРЕДЕЛЕНИЕ ТОЧНОЙ КОНЦЕНТРАЦИИ РАСТВОРА ТИТРИМЕТРИЧЕСКИМ МЕТОДОМ
- •ЖЕСТКОСТЬ ВОДЫ
- •ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
- •КИНЕТИКА ГОМОГЕННЫХ РЕАКЦИЙ
- •КИНЕТИКА ГЕТЕРОГЕННЫХ ХИМИЧЕСКИХ РЕАКЦИЙ
- •КАТАЛИТИЧЕСКИЕ РЕАКЦИИ
- •ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- •РАСТВОРЫ ЭЛЕКТРОЛИТОВ
- •ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ И ЭЛЕКТРОЛИЗ
- •КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ
- •КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- •ОГЛАВЛЕНИЕ
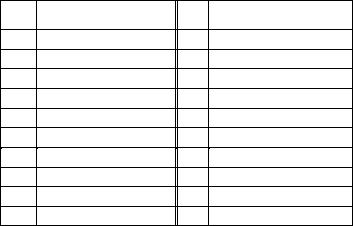
№ |
Уравнение реакции |
|
п/п |
||
|
||
101 |
SnC12 + K2Cr2O7 + H2SO4 → |
|
102 |
Sn + НNО3(разб.) → Sn(NО3)2 + NO + |
|
103 |
Sn + НNО3 (конц.) → Н2SnОЗ + NO2 + |
|
104 |
Pb+ НNО3 (разб.) → Pb (NОЗ)2 + NO + |
|
105 |
Pb+ НNО3 (конц.) → Pb (NОЗ)2 + NO2 + |
|
106 |
Al + НNО3 (разб.) → Аl(NО3)3+ NH4NО3 + Н2О |
|
107 |
PbS + НNО3 (разб.) → S + NO + Pb(NОЗ)2 + |
|
108 |
Al + K2Сr2O7 + H2SO4 → А12(SО4)3 + K2SO4 + Сr2(SО4)3+ |
|
109 |
Al + KMnO4+ H2S04 → А12(SО4)3 + MnSO4 + K2SO4 + |
|
110 |
K2SnO2 + KОН + Вi(NО3)3 → Bi + К2SnО3 + KNО3 + |
|
111 |
Al + NаNО3 + NaOH +Н2О → NaAlO2 + NН3 |
|
112 |
PbО2 + МnSO4 + H2SO4 → НМnO4 + PbSO4 + |
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
В задачах 1–20 напишите формулу комплексного соединения указанного состава. Назовите составные части комплексного со- единения, определите заряд комплексного иона, степень окисле- ния центрального атома (комплексообразователя), его координа- ционное число.
№
Состав
п/п
1CoCl3 4NH3
2CoCl3 4NH3 H2O
3PtCl2 3NH3
4PtCl2 NH3 KCl
5CrBr3 2NH3 KBr
6Cr(NO3)2 5NH3 H2O
7Fe(CN)3 3KCN
8CuSO4 4NH3
9AgCN KCN
10 Zn(OH)2 2KOH
№
Состав
п/п
11SiF4 2HF
12NiSO4 4NH3 2H2O
13AuCl3 HCl
14Fe(CN)2 3KCN NH3
15AgNO3 KNO3
16PdCl2 KCl NH3
17CrBr3 3H2O
18Pd(NO3)2 KNO3 KCl
19CoCl3 NaCl 2NH3
20CrCl3 6NH3
75
В задачах 21–40 напишите уравнения диссоциации комплекс- ного соединения в растворе и уравнения диссоциации образую- щихся при этом комплексных ионов. Составьте выражения для констант нестойкости комплексных ионов.
№ |
Соединение |
№ |
Соединение |
|
п/п |
п/п |
|||
|
|
|||
|
|
|
|
|
21 |
Cu(NH3)4 SO4 |
31 |
Cu(H2O)4 (NO3)2 |
|
22 |
K Ag(CN)2 |
32 |
Fe3 Fe(CN)6 2 |
|
23 |
H2 SiF6 |
33 |
K Au(CN)2 |
|
24 |
K3 Fe(CN)6 |
34 |
K3 Al(OH)6 |
|
25 |
K2 PtCl6 |
35 |
K3 Fe(CNS)6 |
|
26 |
Cr(H2O)6 Cl3 |
36 |
Pt(NH3)2Cl2 |
|
27 |
H AuCl4 |
37 |
CoBr2(NH3)4 (NO3)2 |
|
28 |
Na2 Zn(OH)4 |
38 |
Ag(NH3)2 Cl |
|
29 |
Pt(NH3)2Cl4 |
39 |
K4 Fe(CN)6 |
|
30 |
Ag(NH3)2 Cl |
40 |
K2 PtI6 |
В задачах 41–60 напишите выражения для констант устойчи- вости двух приведенных ионов. Какой из этих ионов более устой- чив и чем это объясняется?
№ |
Ион |
Константа |
№ |
Ион |
Константа |
|||
п/п |
устойчивости |
п/п |
устойчивости |
|||||
|
|
|||||||
|
|
|
|
|
|
|
|
|
41 |
[Au(NH3)2 + |
1,00 |
1027 |
46 |
[AlF6 3– |
4,68 |
1020 |
|
|
[Ag(NH3)2 + |
1,74 |
107 |
|
[FeF6 3– |
1,26 |
1016 |
|
42 |
[ZnBr4 2– |
3,16 10–3 |
47 |
[AuCl3 – |
2,63 |
109 |
||
|
[CdBr4 2– |
5,01 103 |
|
[AuCl4 – |
2,00 |
1021 |
||
43 |
[Cr(OH)4 – |
7,94 |
1029 |
48 |
[HgCl4 2– |
1,66 |
1015 |
|
|
[Cu(OH)4 2– |
3,63 |
1014 |
|
[SnCl4 2– |
3,02 |
101 |
|
44 |
[AgI2 – |
5,50 |
1011 |
49 |
[Al(OH)4 – |
1,00 |
1033 |
|
|
[CdI4 2– |
2,24 |
105 |
|
[Ag(OH)2 – |
1,00 |
104 |
|
45 |
[Ag(NCS)2 – |
1,70 |
108 |
50 |
[Zn(NH3)4 2+ |
5,01 |
108 |
|
|
[Co(NCS)4 2– |
5,12 |
10–1 |
|
[ZnBr4 2– |
3,16 |
10–3 |
|
76
|
|
|
|
|
|
|
Окончание |
|
|
|
|
|
|
|
|||
№ |
Ион |
Константа |
№ |
Ион |
Константа |
|||
п/п |
устойчивости |
п/п |
устойчивости |
|||||
|
|
|||||||
|
|
|
|
|
|
|
|
|
51 |
[Ag(NH3)2 + |
1,74 |
107 |
56 |
[AlF6 3– |
4,68 |
1020 |
|
|
[AgJ2 – |
5,50 |
1011 |
|
[Al(OH)4 – |
1,00 |
1033 |
|
52 |
[Cu(OH)4 2– |
3,63 |
1014 |
57 |
[Ag(CN)2 – |
7,08 |
1019 |
|
|
[Al(OH)4 – |
1,00 |
1033 |
|
[Au(CN)2 – |
2,0 1038 |
||
53 |
[Au(NH3)2 + |
1,00 |
1027 |
58 |
[SnCl4 2– |
3,02 |
101 |
|
|
[AuCl3 – |
2,63 |
109 |
|
[SnCl 6 2– |
6,61 |
106 |
|
54 |
[Ag(OH)2 – |
1,00 |
104 |
59 |
[Fe(NCS) 4 – |
3,39 |
103 |
|
|
[AgI2 – |
5,50 |
1011 |
|
[Fe(NCS)6 3– |
1,70 |
103 |
|
55 |
[CdBr4 2– |
5,01 |
103 |
60 |
[PbI4 2– |
8,32 |
103 |
|
|
[CdI4 2– |
2,24 |
105 |
|
[ZnI4 2– |
3,10 |
10–1 |
|
В задачах 61–80 сделайте вывод о термодинамической воз- можности диссоциации комплексного иона по стандартной энер- гии Гиббса процесса диссоциации и рассчитайте молярные кон- центрации катионов и анионов, входящих в состав комплексного иона, в 0,01М водном растворе соответствующего комплексного соединения.
№ |
Уравнение диссоциации |
Константа |
|
п/п |
комплексного иона |
нестойкости |
|
|
|
|
|
61 |
Ag(CN)2 – Ag+ + 2CN– |
1,00 |
10–21 |
|
|
|
|
62 |
Ag(NH3)2 + Ag+ + 2NH3 |
5,89 |
10–8 |
|
|
|
|
63 |
Ag(S2O3)2 3– Ag+ + 2S2O32– |
1,00 |
10–18 |
|
|
|
|
64 |
AlF6 3– Al3+ + 6F– |
5,01 |
10–18 |
|
|
|
|
65 |
Cd(CN)4 2– Cd2+ + 4CN– |
7,66 |
10–18 |
|
|
|
|
66 |
CdI4 2– Cd2+ + 4I– |
7,94 |
10–7 |
|
|
|
|
67 |
Cd(NH3)4 2+ Cd2+ + 4NH3 |
2,75 |
10–7 |
|
|
|
|
68 |
Co(CNS)4 2– Co2+ + 4CNS– |
1,9 100 |
|
|
|
|
|
69 |
Co(NH3)6 2+ Co2+ + 6NH3 |
4,07 |
10–5 |
|
|
|
|
70 |
Cu(CN)2 – Cu+ + 2CN– |
1,00 |
10–24 |
|
|
|
|
77
|
|
|
|
Окончание |
|
|
|
||
№ |
Уравнение диссоциации |
Константа |
||
п/п |
комплексного иона |
нестойкости |
||
|
|
|
|
|
71 |
Cu(CN)4 3– Cu+ +4CN– |
5,13 |
10–31 |
|
72 |
Cu(NH3)4 2+ Cu2+ + 4NH3 |
9,33 |
10–13 |
|
|
|
|
|
|
73 |
Fe(CN)6 4– Fe2+ |
+ 6CN– |
1,00 |
10–24 |
74 |
Fe(CN)6 3– Fe3+ |
+ 6CN– |
1,00 |
10–31 |
|
|
|
|
|
75 |
Hg Cl4 2– Hg2+ + 4Cl– |
6,03 |
10–16 |
|
76 |
Hg(CN)4 2– Hg2+ + 4CN– |
3,02 |
10–42 |
|
|
|
|
|
|
77 |
Hg(CNS)4 2+ Hg2+ + 4CNS– |
1,29 |
10–22 |
|
|
|
|
|
|
78 |
HgI4 2– Hg2+ + 4I– |
1,38 |
10–30 |
|
|
|
|
|
|
79 |
Ni(CN)4 2– Ni2+ |
+ 4CN– |
1,00 |
10–22 |
|
|
|
|
|
80 |
Ni(NH3)6 2+ Ni2+ + 6NH3 |
9,77 |
10–9 |
|
|
|
|
|
|
78

Приложение 1
Плотности водных растворов некоторых веществ при 20 °С
ω |
|
ρ, г/л |
ω |
|
ρ, г/л |
ω |
|
ρ, г/л |
|
|
|
|
|
|
|
|
|
H2SO4 |
|
HCl |
|
СН3СООН |
||||
0,003 |
|
1000 |
0,004 |
|
1000 |
0,04 |
|
1004 |
0,032 |
|
1020 |
0,024 |
|
1010 |
0,08 |
|
1010 |
|
|
|
|
|
|
|
|
|
0,062 |
|
1040 |
0,044 |
|
1020 |
0,12 |
|
1015 |
|
|
|
|
|
|
|
|
|
0,091 |
|
1060 |
0,064 |
|
1030 |
0,16 |
|
1021 |
0,120 |
|
1080 |
0,085 |
|
1040 |
0,20 |
|
1026 |
|
|
|
|
|
|
|
|
|
0,147 |
|
1100 |
0,105 |
|
1050 |
0,24 |
|
1031 |
|
|
|
|
|
|
|
|
|
0,174 |
|
1120 |
0,125 |
|
1060 |
0,28 |
|
1036 |
0,201 |
|
1140 |
0,145 |
|
1070 |
0,32 |
|
1041 |
|
|
|
|
|
|
|
|
|
0,227 |
|
1160 |
0,165 |
|
1080 |
0,36 |
|
1045 |
|
|
|
|
|
|
|
|
|
0,252 |
|
1180 |
0,184 |
|
1090 |
0,40 |
|
1049 |
0,277 |
|
1200 |
0,204 |
|
1100 |
0,44 |
|
1053 |
|
|
|
|
|
|
|
|
|
0,302 |
|
1220 |
0,223 |
|
1110 |
0,48 |
|
1056 |
|
|
|
|
|
|
|
|
|
0,326 |
|
1240 |
0,243 |
|
1120 |
0,52 |
|
1059 |
0,350 |
|
1260 |
0,262 |
|
1130 |
0,56 |
|
1062 |
|
|
|
|
|
|
|
|
|
NaCl |
|
NaOH |
|
|
КОН |
|||
|
|
|
|
|
|
|
|
|
0,01 |
|
1005 |
0,02 |
|
1020 |
0,02 |
|
1016 |
0,02 |
|
1013 |
0,04 |
|
1042 |
0,04 |
|
1034 |
|
|
|
|
|
|
|
|
|
0,04 |
|
1027 |
0,06 |
|
1064 |
0,06 |
|
1054 |
|
|
|
|
|
|
|
|
|
0,06 |
|
1041 |
0,10 |
|
1108 |
0,10 |
|
1089 |
0,08 |
|
1056 |
0,14 |
|
1153 |
0,14 |
|
1127 |
|
|
|
|
|
|
|
|
|
0,10 |
|
1071 |
0,18 |
|
1197 |
0,18 |
|
1166 |
|
|
|
|
|
|
|
|
|
0,12 |
|
1086 |
0,22 |
|
1241 |
0,22 |
|
1206 |
0,14 |
|
1101 |
0,26 |
|
1284 |
0,26 |
|
1246 |
|
|
|
|
|
|
|
|
|
0,16 |
|
1116 |
0,30 |
|
1327 |
0,30 |
|
1288 |
|
|
|
|
|
|
|
|
|
0,18 |
|
1132 |
0,34 |
|
1369 |
0,34 |
|
1330 |
0,20 |
|
1148 |
0,38 |
|
1410 |
0,38 |
|
1374 |
|
|
|
|
|
|
|
|
|
0,22 |
|
1164 |
0,42 |
|
1453 |
0,42 |
|
1418 |
|
|
|
|
|
|
|
|
|
0,24 |
|
1180 |
0,46 |
|
1487 |
0,46 |
|
1464 |
0,26 |
|
1197 |
0,50 |
|
1525 |
0,50 |
|
1512 |
|
|
|
|
|
|
|
|
|
79

Приложение 2
Термодинамические свойства веществ
Вещество |
∆ f H0298, |
S2980 , |
|
кДж/моль |
Дж/(моль·К) |
||
|
|||
|
|
|
|
Al (кр) |
0,0 |
28,3 |
|
Al2O3 (кр) |
–1675 |
57 |
|
Ag (кр) |
0,0 |
43 |
|
Ag+ |
105,75 |
73,4 |
|
C (графит) |
0,0 |
5,74 |
|
CO(г) |
–110 |
197 |
|
CO2 (г) |
–393 |
214 |
|
COCl2(г) |
–219,5 |
283,6 |
|
CCl4(г) |
–103 |
309,7 |
|
СH3Cl(г) |
–82 |
233,5 |
|
CH4( г) |
–75 |
186 |
|
C2H4(г) |
52 |
219 |
|
C2H2(г) |
227 |
201 |
|
C2H6(г) |
–85 |
229,5 |
|
CaO (кр) |
–635 |
40 |
|
Ca(OH)2(кр) |
–985 |
83 |
|
CaCO3 (кр) |
–1207 |
92 |
|
Cd(кр) |
0 |
+51,76 |
|
Cu (кр) |
0,0 |
33 |
|
Cu2+(р–р) |
67 |
–93 |
|
CuSO4(кр) |
–770,9 |
109 |
|
CuSO4·5H2O(кр) |
–2279 |
300 |
|
[Cu(NH3]2+(р–р) |
–347 |
280,5 |
|
Cu2(OH)2CO3(кр) |
–1051 |
211,6 |
|
Cl (г) |
122 |
165 |
|
Cl2 (г) |
0,0 |
223 |
|
Fe (кр) |
0,0 |
27 |
|
FeO (кр) |
–264 |
59 |
|
Fe2O3 (кр) |
–824 |
87 |
Вещество |
∆ f H0298, |
S2980 , |
|
кДж/моль |
Дж/(моль·К) |
||
|
|||
|
|
|
|
Mn (кр) |
0,0 |
32 |
|
MnO (кр) |
–385 |
60 |
|
MnO2 (кр) |
–520 |
53 |
|
MnCl2(кр) |
–481,2 |
118,2 |
|
Mo(кр) |
0,0 |
29 |
|
MoO2 (кр) |
–585 |
46 |
|
Mo2C (кр) |
18 |
82 |
|
N2 (г) |
0,0 |
192 |
|
N2O (г) |
82 |
220 |
|
NO (г) |
91 |
211 |
|
NO2 (г) |
33 |
240 |
|
N2O4 (г) |
9 |
304 |
|
NOCl(г) |
52,5 |
261,5 |
|
NH3 (г) |
–46 |
192 |
|
NH4Cl(кр) |
–315 |
95 |
|
NO3–(р–р) |
–207,4 |
146,9 |
|
Ni(кр) |
0 |
30 |
|
NiO (кр) |
–240 |
38 |
|
Ni(OH)2 (кр) |
–544 |
80 |
|
O (г) |
249 |
161 |
|
O2 (г) |
0,0 |
205 |
|
PCl3(г) |
–287 |
311,7 |
|
PCl5 (г) |
–375 |
364 |
|
SO2 (г) |
–297 |
248 |
|
SO2Cl2 (г) |
–364 |
312 |
|
SO3 (г) |
–396 |
257 |
|
Si (кр) |
0,0 |
19 |
|
SiO2 (кр) |
–859 |
42 |
|
Sn (кр) |
0,0 |
52 |
80

|
|
|
|
|
Окончание |
|
|
|
|
|
|
|
|
Вещество |
∆ f H0298, |
S2980 , |
Вещество |
∆ f H0298, |
S2980 , |
|
кДж/моль |
Дж/(моль·К) |
кДж/моль |
Дж/(моль·К) |
|||
|
|
|||||
|
|
|
|
|
|
|
Fe3O4 (кр) |
–1117 |
151 |
SnO(кр) |
–286 |
56,5 |
|
H (г) |
218 |
115 |
SnO2(кр) |
–580,7 |
52,3 |
|
H2 (г) |
0,0 |
131 |
Zn(кр) |
0 |
+41,63 |
|
H+(р–р) |
0 |
0 |
CH3OH (г) |
–238,7 |
126,7 |
|
H2O(ж) |
–286 |
70 |
CH3OH (ж) |
–239 |
127 |
|
H2O (г) |
–242 |
189 |
C2H5OH (г) |
–235 |
282 |
|
HCl (г) |
–92 |
187 |
HCOOH (г) |
–377 |
252 |
|
H2S (г) |
–21 |
206 |
HCOOH(ж) |
–426 |
91 |
|
Br2(г) |
31 |
245 |
CH3COOH(г) |
–437,4 |
282,5 |
|
HBr (г) |
–36,4 |
198,6 |
CH3COOH(ж) |
–484 |
160 |
Приложение 3
Константы диссоциации слабых кислот Ka и оснований Kb
Кислота |
Формула |
Kа |
Гидроксид |
Формула |
Kb |
|
Азотистая |
HNO2 |
4,0 10–4 |
Алюминия K3 |
Al(OH)3 |
1,4 10–9 |
|
Муравьиная |
HCOOH |
1,8 10–4 |
Аммония |
|
NH4OH |
1,8 10–5 |
Мышьяковая |
|
5,6 10–3 |
Железа(II) K2 |
Fe(OH)2 |
1,3 10–4 |
|
K1 |
H3AsO4 |
|
|
|
|
|
K2 |
1,7 10–7 |
|
|
|
|
|
K3 |
|
3,0 10–12 |
|
|
|
|
Сернистая |
|
1,3 10–2 |
Железа (III) |
|
1,8 10–11 |
|
K1 |
H2SO3 |
|
K2 |
Fe(OH)3 |
||
K2 |
|
6,2 10–8 |
|
K3 |
|
1,4 10–12 |
Сероводородная |
H2S |
5,7 10–8 |
Магния |
K2 |
Mg(OH)2 |
2,5 10–3 |
K1 |
|
|
|
|
|
|
K2 |
|
2,5 10–13 |
|
|
|
|
Угольная |
|
4,3 10–7 |
Марганца |
K2 |
Mn(OH)2 |
5,0 10–4 |
K1 |
H2CO3 |
|
|
|
|
|
K2 |
|
5,6 10–11 |
|
|
|
|
Уксусная |
CH3COOH |
1,8 10–5 |
Меди |
K2 |
Cu(OH)2 |
3,4 10–7 |
|
|
|
|
|
|
81 |
|
|
|
|
|
Окончание |
|
|
|
|
|
|
|
|
Кислота |
Формула |
Ка |
Гидроксид |
Формула |
|
Kb |
Фосфорная |
|
7,5 10–3 |
Свинца |
|
|
9,6 10–4 |
K1 |
H3PO4 |
K1 |
Pb(OH)2 |
|
||
K2 |
6,2 10–8 |
K2 |
|
3,0 10–8 |
||
K3 |
|
2,2 10–13 |
|
|
|
|
Фтористо- |
HF |
4,0 10–4 |
Хрома (Ш) K3 |
Cr(OH)3 |
|
1,0 10–10 |
водородная |
|
|
|
|
|
|
|
|
|
|
|
|
|
Хлористая |
HClO2 |
1,1 10–2 |
Цинка |
|
|
5,0 10–5 |
|
|
|
K1 |
Zn(OH)2 |
|
|
|
|
|
K2 |
|
|
1,5 10–9 |
Хлорноватистая |
HClO |
3,0 10–8 |
– |
– |
|
– |
Щавелевая |
|
5,9 10–2 |
|
|
|
|
K1 |
H2C2O4 |
– |
– |
|
– |
|
K2 |
|
5,9 10–5 |
|
|
|
|
Цианисто- |
HCN |
5,0 10–10 |
– |
– |
|
– |
водородная |
|
|
|
|
|
|
Приложение 4
Значения стандартных электродных потенциалов
Схема |
0, В |
Схема |
0, В |
Схема |
0, В |
электрода |
|
электрода |
|
электрода |
|
|
|
|
|
|
|
Li+ / Li |
–3,045 |
Y3+ / Y |
–2,372 |
Ni2+ / Ni |
–0,250 |
Rb+ / Rb |
–2,925 |
Mg2+ / Mg |
–2,370 |
Sn2+ / Sn |
–0,136 |
K+ / K |
–2,924 |
Sc3+ / Sc |
–2,077 |
Pb2+ / Pb |
–0,126 |
Cs+ / Cs |
–2,923 |
Be2+ / Be |
–1,847 |
H+ / H2 |
0,000 |
Ra2+ / Ra |
–2,916 |
Al3+ / Al |
–1,662 |
Cu2+ / Cu |
+0,338 |
Ba2+ / Ba |
–2,905 |
Mn2+ / Mn |
–1,180 |
Hg2+ / Hg |
+0,854 |
Sr2+ / Sr |
–2,888 |
Cr2+ / Cr |
–0,913 |
Ag+ / Ag |
+0,799 |
Ca2+ / Ca |
–2,864 |
Zn2+ / Zn |
–0,763 |
Rh3+ / Rh |
+0,800 |
Na+ / Na |
–2,771 |
Fe2+ / Fe |
–0,441 |
Pd2+ / Pd |
+0,915 |
Ac3+ / Ac |
–2,600 |
Cd2+ / Cd |
–0,403 |
Pt2+ / Pt |
+0,963 |
La3+ / La |
–2,522 |
Co2+ / Co |
–0,277 |
Au3+ / Au |
+1,498 |
82 |
|
|
|
|
|
