
_________________________________________________________________
Лабораторная работа № 6 (с) изучение спектра атома водорода и определение постоянной ридберга
ЦЕЛЬ РАБОТЫ: Изучить структуру спектра атомарного водорода для серии Бальмера. Определить постоянную Ридберга.
ПРИБОРЫ: Монохроматор УМ-2, газоразрядная трубка, ртутная лампа ДРШ-250.
Теоретическая часть
Излучение и поглощение света веществом сопровождается переходом части атомов или молекул из одного энергетического состояния в другое. Атомы в обычных условиях находятся в основных, т.е. в невозбужденных, состояниях, при этом они не излучают и не поглощают энергию. Чтобы перевести атомы вещества в возбужденное состояние надо сообщить им дополнительную энергию, например, за счет соударений с электронами при газовом разряде, как это происходит в газоразрядной трубке или ртутной лампе ДРШ-250.
Возбужденные атомы излучают линейчатые спектры. Этот процесс сопровождается переходом атомов из состояния с большей энергией (возбужденное) в состояние с меньшей энергией (основное). Спектры являются характеристикой атомов или молекул. Самый простой спектр имеет атом водорода, спектральные линии которого сгруппированы в несколько серий.
Рассмотрим с точки зрения квантовой механики атом водорода, т.е. систему, состоящую из неподвижного ядра и электрона, находящегося в поле ядра. Движение электрона в электрическом поле неподвижного ядра описывается волновой функцией, удовлетворяющей стационарному уравнению Шредингера
![]() (1)
(1)
где![]() - оператор Лапласа,
- оператор Лапласа,
m - масса электрона,
E- полная энергия электрона,
![]() -потенциальная энергия электрона в
поле ядра
-потенциальная энергия электрона в
поле ядра
r - расстояние электрона от ядра.
Сама волновая функция физического смысла не имеет, но квадрат ее модуля определяет вероятность dP того, что микрочастица будет обнаружена в пределах некоторого объема dV
dP =2dV(2)
Так как потенциальная энергия обладает сферической симметрией (т.е. зависит только от модуля радиуса), то оператор Лапласа и волновую функцию выражают в сферической системе координат через переменные r,, .
![]()
Уравнение (1) при отрицательных значениях энергии E(электрон связан с ядром) имеет решение только при вполне определенных дискретных значениях энергии (энергия электрона квантуется)
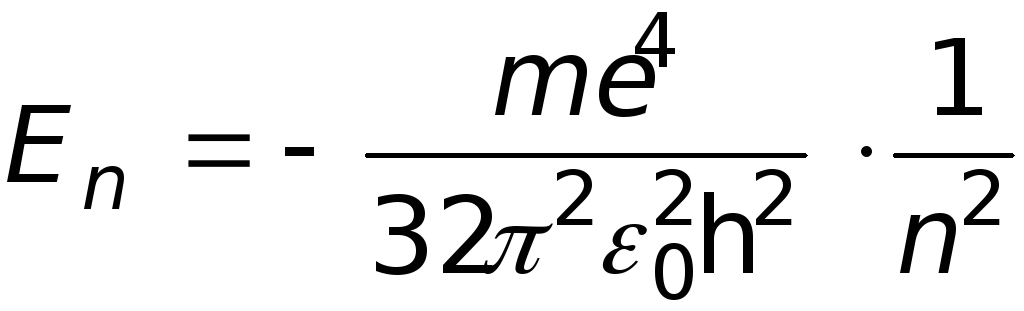 (3)
(3)
n = 1, 2, 3....
При этом вид волновой функции = n l m (r, , )зависит от трех квантовых чисел n, l, m.
Параметр n - главное квантовое число,- характеризует энергетическое состояние системы и совпадает с номером стационарного состояния.
Из решения уравнения Шредингера (1) следует, что орбитальный момент импульса электрона в атоме Lтакже принимает дискретные значения (квантуется)
![]()
![]() (4)
(4)
где l- азимутальное (орбитальное) квантовое число, характеризующее модуль момента импульса электрона, движущегося по орбите.
Кроме квантования энергии существует так называемое пространственное квантование. Вектор момента импульса электрона может принимать лишь те ориентации в пространстве, при которых проекция LzвектораL на некоторое направлениеz(например, внешнего магнитного поля) принимает дискретные значения, кратные
![]() (5)
(5)
где m= 0, 1, 2,.. l - магнитное квантовое число.
При заданном главном квантовом числе n, числаlиmмогут принимать несколько значений. Этому соответствуют различные волновые функции. Следовательно, атом водорода может иметь одно и то же значение энергии, находясь в различных состояниях, отличающихся значениями квантовых чиселlи m. Состояния с одинаковой энергией называются вырожденными, а число различных состояний с одним значением энергии называют кратностью вырождения этого состояния. Для атома водорода кратность вырождения уровня энергии равна:
![]() .
.
Ряд
возможных значений энергии атома
водорода для различных значений
азимутального квантового числа
представлен в виде схемы (рис.1). Показаны
переходы, разрешенные правилом отбора
для l(
l=1). Это
означает, что возможны только такие
переходы электрона, при которыхlменяется на единицу. Это правило
обусловлено тем, что фотон обладает
спином - собственным моментом импульса.
При испускании фотон уносит этот момент,
а при поглощении атомом энергии прин![]() осит,
так что правило отбора дляl
является следствием закона
сохранения момента импульса.
осит,
так что правило отбора дляl
является следствием закона
сохранения момента импульса.
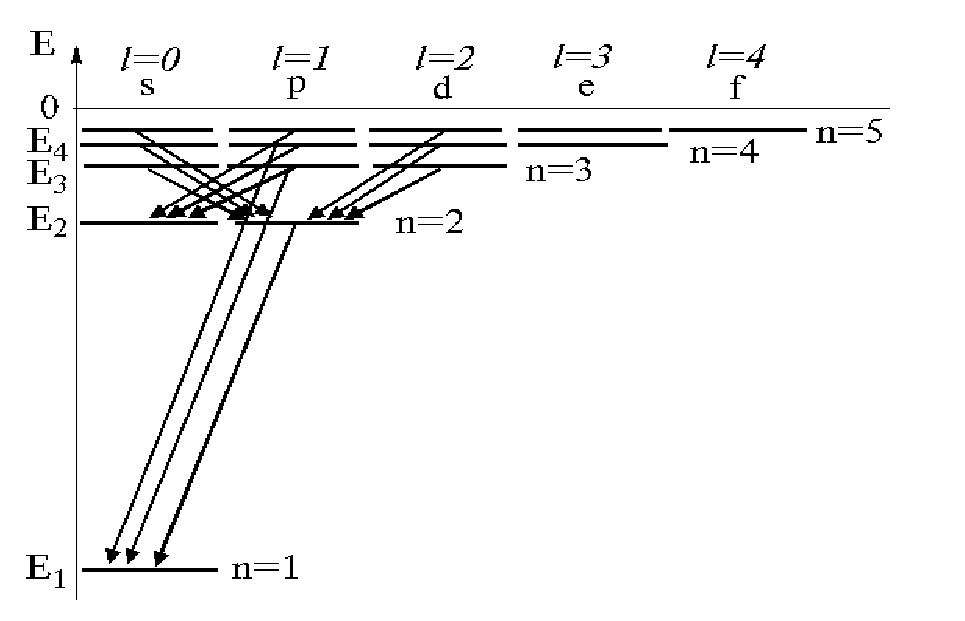 Рис.
1 Уровни энергии атома водорода и
образование
спектральных линий.
Рис.
1 Уровни энергии атома водорода и
образование
спектральных линий.
Зная структуру энергетических уровней, можно представить и структуру спектра излучения-поглощения. Поскольку
![]() (6)
(6)
то, частоты, соответствующие различным спектральным линиям, можно записать в виде:
![]() . (7)
. (7)
Таким образом, решение уравнения Шрeдингера для электрона в атоме водорода дает объяснение экспериментально наблюдаемым спектральным сериям в спектре водорода. Спектр водорода состоит из ряда закономерно повторяющихся спектральных линий, которые объединены в серии:
1 - серия Лаймана (m=1, n=2, 3, 4...) лежит в дальней ультрафиолетовой области (97-122нм);
2 - серии Бальмера (m=2, n=3,4,5...) в видимой и близкой ультрафиолетовой области (397-656нм);
3 - серии Пашена (m=3), Брекета (m=4), Пфунда (m=5) находятся в инфракрасной области (свыше 956 нм).
В данной работе изучается серия Бальмера атомарного водорода, в которой обнаружено 25 линий от n=3 доn=27. Для этой серии можно записать формулу Бальмера
![]() , (8)
, (8)
где R- постоянная Ридберга
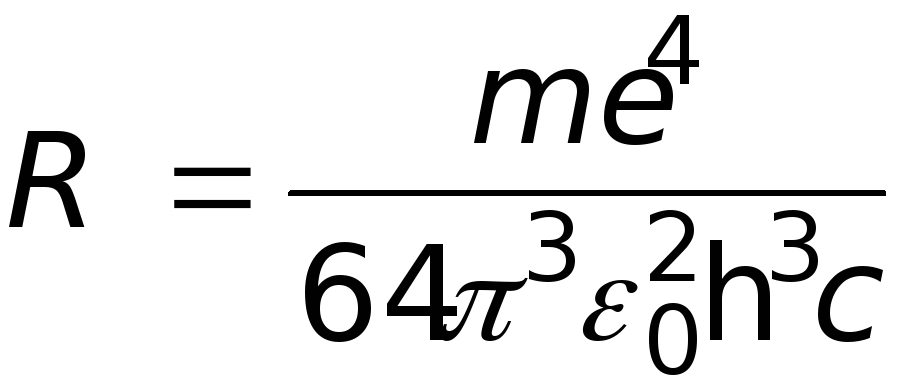 (9)
(9)
c=3108м/c - скорость света в вакууме, -
0=8,8510-12Ф/м - электрическая постоянная,
m =9,110-31кг - масса электрона,
e =1,610-19Кл -заряд электрона,
=1,0510-34Дж с - постоянная Планка.
В видимую область спектра попадают первые линии серии Бальмера , , ,которые соответствуютn= 3, 4, 5, 6 и находятся в красной, зеленой, голубой и фиолетовой областях спектра. Интенсивность линий убывает с возрастанием n. Легко наблюдаются в спектре линии , , ,а линиюможно найти при внимательном рассмотрении сине-голубой области спектра.
