
Тесты по химии Итогового зачета для педиатрического факультета
1. Количество вещества (моль) в одном литре раствора
+ 1. молярность 4. мольная доля
2. моляльность 5. массовая доля
3. титр
2. При помещении клеток в гипертонический раствор происходит
+ 1. плазмолиз 4. гомеостаз
2. лизис 5. гидратация
3. гемолиз
3. Число молекул, участвующих в элементарном акте химической реакции:
1. порядок реакции 4. стехиометрические коэффициенты
2. скорость реакции 5. константа скорости
3. молекулярность реакции
4. Степень
окисления комплексообразователя в
соединении
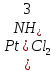
1. +2 4. +3
2. +6 5. +5
+ 3. +4
5. Системы, состоящие из твердой дисперсной фазы и жидкой дисперсной среды
1. аэрозоли 4. эмульсии
+ 2. суспензии 5. Истинные растворы
3. пены
6. Количество вещества (моль) в 1 кг растворителя
1. молярность 4. мольная доля
+ 2. моляльность 5. массовая доля
3. Титр
7. При помещении клеток в гипотонический раствор наблюдается
1. плазмолиз 4. гомеостаз
+ 2. лизис 5. гидратация
3. Гемолиз
8. Фосфатная буферная система действует
1. в слюне 4. В селезенке
+ 2. в плазме крови 5. В почках
3. в моче
9. Степень
окисления комплексообразователя в
соединении
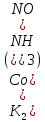
1. +5 4. +2
2. +3 5. +1
3. +4
10. Положительный индуктивный эффект в бензольном кольце проявляет заместитель:
1. –Cl 4. –CH3
2. –OH 5. -Br
3. –NH2
11. Масса вещества в граммах, содержащаяся в 1мл раствора
1. молярность 4. мольная доля
2. моляльность 5. массовая доля
+ 3. титр
12. Коллигативное свойство растворов
1. масса 4. Ионная система
+ 2. осмотическое давление 5. Водородный показатель
3. температура
13. Среда кислая (рН>7) в водном растворе
1.
 4.
4.
2.
 5.
5.

3.

14. Система постоянно обменивающаяся и энергией, и веществом с окружающей средой
1. закрытая 4. Равновесная
2. изолированная + 5. Открытая
3. стационарная
15. В крови дисперсионной средой является
+ 1. вода 4. кислород
2. эритроциты 5. Углекислый газ
3. белки
16. Масса вещества в граммах, содержащаяся в 100 г раствора
1. молярность 4. мольная доля
2. моляльность + 5. массовая доля
3. титр
17. Коллигативное свойство растворов
1. масса 4. Ионная система
+ 2. осмотическое давление 5. Водородный показатель
3. Температура
18. рН>7 в растворах солей
1.
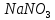 4.
4.
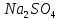
2.
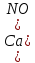 5.
5.
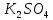
+ 3.
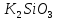
19. Способность сходных по свойствам веществ образовывать смешанные кристаллы
1. гомеостаз 4. коагуляция
2. седиментация 5. аллотропия
+ 3. изоморфизм
20. Система, которая не обменивается ни веществом, ни энергией с окружающей средой
1. закрытая 4. Равновесная
+ 2. изолированная 5. открытая
3. Стационарная
21. Раствор, содержащий 0,9 % NaCl
+ 1. в 100 г раствора содержится 0,9 г NaCl 4. В 1кг растворителя содержится 0,9 г NaCl
2. в 100 мл раствора содержится 0,9 г NaCl 5. В любой массе раствора содержится 0,9 г NaCl
3. в 1 л раствора содержится 0,9 г NaCl
22. Коллигативные свойства растворов зависят от
1. природы растворенного вещества 4. давления
2. температуры 5. обьема
+ 3. концентрации растворенного вещества
23. Константа
гидролиза Буры ( рассчитывается по
рассчитывается по
+1. К=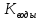 /
/
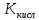
2. К=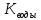 /
/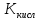 *
*
3. К=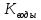 /
/
24. Радиоактивный Sr* опасен, так как замещает в костной ткани атомы
+ 1. Ca 4. H
2. P 5. Ba
3. O
25. Система, обменивающаяся и веществом и энергией
1. закрытая 4. Равновесная
2. изолированная + 5. открытая
3. стационарная
26. Растворы глюкозы с молярной концентрацией 3 моль/л
+ 1. в 1 л растворе содержится 3 моль глюкозы
2. в 100 мл растворе содержится 3 моль глюкозы
3. в 1 кг растворителя содержится 3 моль глюкозы
4. в 100 г растворе содержится 3 моль глюкозы
5. в 1 мл растворе содержится 0,3 моль глюкозы
27. Одностороннее движение молекул растворителя через полупроницаемую мембрану под действием разности концентраций
1. броуновское движение 4. Хаотическое движение
2. диффузия 5. электрофорез
+ 3. осмос
28. Константа гидролиза ацетата аммония рассчитывается по формуле
1. К=К_воды/ К_кисл
+ 2. К=К_воды/К_кисл*К_осн
3. К=К_воды/К_осн
29. Растворы, рН которых сохраняется примерно постоянным при разбавлении и добавлении небольших количеств кислот или оснований
1. сопряженные 4. концентрированные
+ 2. буферные 5. нейтральные
3. разбавленные
30. Реакция, тепловой эффект которой равен теплоте образований глюкозы
+ 1. 6С + 6 +
3
+
3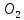 =
=
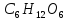
2. 6С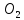 +
6
+
6
 О=
О=
 +
+
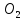
3. 6С + 6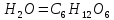
4.
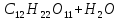 =
=
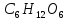 +
+
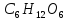
31. Раствор
 с молярной концентрацией эквивалента
0,25 моль/л
с молярной концентрацией эквивалента
0,25 моль/л
1. в 1 л
раствора содержится 0,25 моль
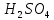
2. в 1 кг
растворителя содержится 0,25 моль
эквивалента
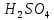
3. в 1 л
раствора содержится 0,25 моль эквивалента

4. в 1 л
растворителя содержится 0,25 моль
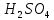
+5. в 2 л
раствора содержится 0,25 моль
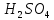
32. Растворы с одинаковым осмотическим давлением
+ 1. изотонические 4. насыщенные
2. гипертонические 5. пересыщенные
3. гипотонические
33. Соль, гидролизующаяся и по катиону и по аниону
+ 1.
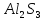
2.
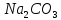
3.
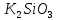
4.

34. Буферные системы поддерживают в организме равновесия
+ 1. кислотно-основные
2. окислительно-восстановительные
3. гетерогенные
4. лигандообменные
5. кислотно-солевые
35. При растворении твердых веществ, при кариесе энтропия
1. убывает
+ 2. возрастает
3. не изменяется
36. Фактор
эквивалентности
 в реакции
в реакции
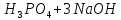 =
...
=
...
1. 2/3
2. 1/2
3. 1/3
4. 2
5. 3
37. Раствор NaCl изотоничен плазме крови
+ 1. 0,9 %
2. 1,1 %
3. 1,3 %
4. 1,5 %
5. 1,7 %
38. Степень
гидролиза
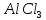 при подкислении
при подкислении
+ 1. уменьшается
2. увеличивается
3. не изменяется
4. сначала увеличивается, затем уменьшается
5. сначала уменьшается, затем увеличивается
39. Максимальную буферную емкость системы имеют при
+ 1. рН=рК
2. рН>рК
3. рН<рК
4. эти параметры не связаны между собой
40. Критерий самопроизвольно протекающих процессов в биологии
1. энтальпия
+ 2. энергия Гиббса
3. энтропия
4. внутренняя энергия
5. температура
41. Титриметрический анализ – это метод количественного анализа, основанный на ….
+ 1. точном измерении объема раствора определяемого вещества
2. точном измерении объема раствора – титранта и определяемого вещества
3. определении массы раствора реагента
4. определении массы определяемого вещества
5. определении плотности раствора
42. Осмотическое давление пропорционально
+ 1. молярной концентрации
2. моляльной концентрации
3. молярной концентрации эквивалента
4. молярной доле
5. массовой доле
43. Гетерогенное равновесие создается при соприкосновении твердой фазы с раствором
1. ненасыщенным
+ 2. насыщенным
3. пересыщенным
4. разбавленным
44. Значение крови в норме, поддерживаемое буферными системами организма
+ 1. 7,4
2. 6,7
3. 1-2
4. 5,6
5. 4,8-7,5
45. Направление
протекания реакции
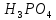 + аденозин = АМФ +
+ аденозин = АМФ +
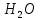 , 𝜟
, 𝜟 =
14 кДж/моль
=
14 кДж/моль
1. прямое
2. обратное
3. реакция находится в состоянии равновесия
4. любое
5. требуются дополнительные условия
46. Титриметрический анализ основан на законе …
1. сохранение массы
2. кратных отношений
+ 3. эквивалентов
4. постоянства состава
5. Авогадро
47. Повышение температуры кипения и понижение температуры замерзания раствора пропорционально
1. молярной концентрации
