
5_kollok_Belki_i_nekleinovye_kisloty
.docx
1.
Функция белков:
-структурная
-сократительная
-рецептораня
-сигнальная
-транспортная
-защитная
-каталитическая
-энергетическая
Нормы белка в питании:
70-150 гр/в сут. в засимости возраста, пола, региона, профессии и тд.
Белковый минимум – необходимое кол-во белка для поддержания азотистого равновесия. При питании на уровне белкового минимума весь поступивший белок идет на распад и выделение азота. ( 40г.)
Азотистый баланс - это соотношение кол-ва азота, поступившего в организм и выделенного из него.
2.
Ферменты ЖКТ:
Желудка: (белки->полипептиды)
-пепсин (пепсиноген)<-HCl
-Гастриксин (пепсиноген)
-Ренин (у гр. детей)
12ПК: (Полипептиды->олигопептиды):
-трипсин (трипсиноген)
-химотрипсин (ген)
-эластаза
-карбоксипептидаза АиВ
-аминопептидаза
-иминопептидаза
-дипептидаза
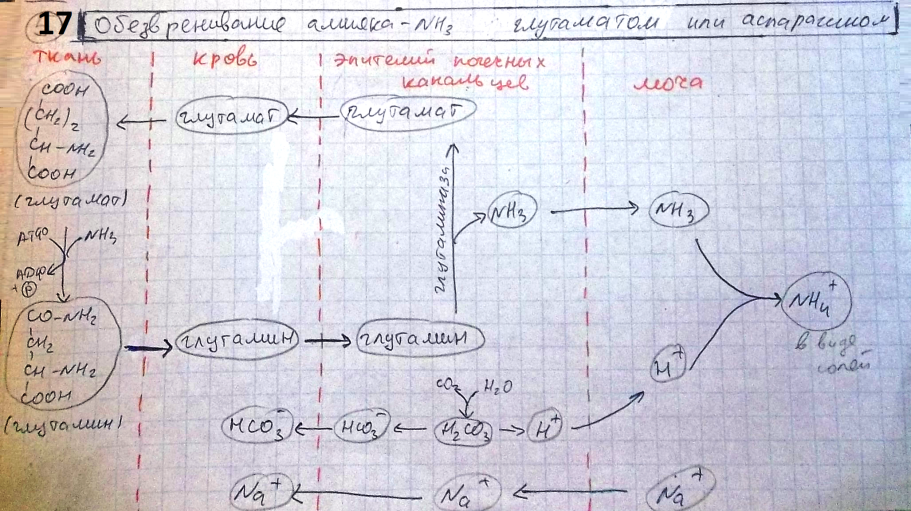
3)Белки подвергаются в ЖКТ распаду при учпротеолитич фермент, ускоргидролитичрасщ пептидных связей между АК. пептидгидролазыоблад относ специфич, способ кат расщепл пептид связей между опред АК. Пептидгидролазы выдел в неакт форме. Актив они при поступл пищи в Жкт или при виде пищи по мех условнрефл. Активация пепсина и трипсина происх по мехавтокатализа, дрпептидгидролазыактивиртрипсином.
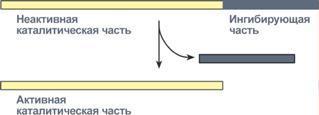
4)Протеолитич ферм поджел ж (трипсин, химотрипсин эластаза) синтез в виде неактпредшеств. Их актив в нейтр или слабощ среде под влиян энтерокиназыэндопептидазы, секретир слизистой 12-ойкишки.Желчь актив фермент поджел и киш соков, липазы, Киш сок сод многочисл ферм (аминопептид, дипептидазу, мальтазу, лактазу, фосфолипазу.), обеспечивающ конечные этапы перевар Б Ж У.
5)АК могут всас активно (натрий-зав трансп) и пассивно (натрий-незавтрансп). Активно всаснейтрАК, фен, мет, про, оксипро. Пассивно лей, фен, полярныеАК (лиз, арг, асп, глу). АКвсас. 5 транспортных систем,. 1 транспорт крупных нейтрАк,. 2специал на транспордвухоснАК (лиз, арг, орн) и цис-цис. 3 для перемещчзмембрдикарбонАК. 4трансп малых по молекул гли, опро, про. 5трансп только про. В основном АКвсас путем вторич-активнтрансп 1) с участием АТФ-аза за счет создград конц ионов нат по одну сторону мемб; 2) с участием ГГТ Для раб этого ферм треб обязглутатион кот расщепл с обр g-глутамила. g-глутамил выходит из клетки, взаимод с опредАК, обр дипептид – глутамил-транспАК и в таком виде под влиянием ГГТ перенос в стенку киш. В цитопл клетки кишрасщепл на g-глутамил и АК, g-глутамил для ресинтеза GSH, а АКиспол для нужд клетки. 3) в небол кол всасди-, трипептиды и некот белки (ботулотоксин, протеазы,).
5)АК могут всас активно (натрий-зав трансп) и пассивно (натрий-незавтрансп). Активно всаснейтрАК, фен, мет, про, оксипро. Пассивно лей, фен, полярныеАК (лиз, арг, асп, глу). АКвсас. 5 транспортных систем,. 1 транспорт крупных нейтрАк,. 2специал на транспордвухоснАК (лиз, арг, орн) и цис-цис. 3 для перемещчзмембрдикарбонАК. 4трансп малых по молекул гли, опро, про. 5трансп только про. В основном АКвсас путем вторич-активнтрансп 1) с участием АТФ-аза за счет создград конц ионов нат по одну сторону мемб; 2) с участием ГГТ Для раб этого ферм треб обязглутатион кот расщепл с обр g-глутамила. g-глутамил выходит из клетки, взаимод с опредАК, обр дипептид – глутамил-транспАК и в таком виде под влиянием ГГТ перенос в стенку киш. В цитопл клетки кишрасщепл на g-глутамил и АК, g-глутамил для ресинтеза GSH, а АКиспол для нужд клетки. 3) в небол кол всасди-, трипептиды и некот белки (ботулотоксин, протеазы,).
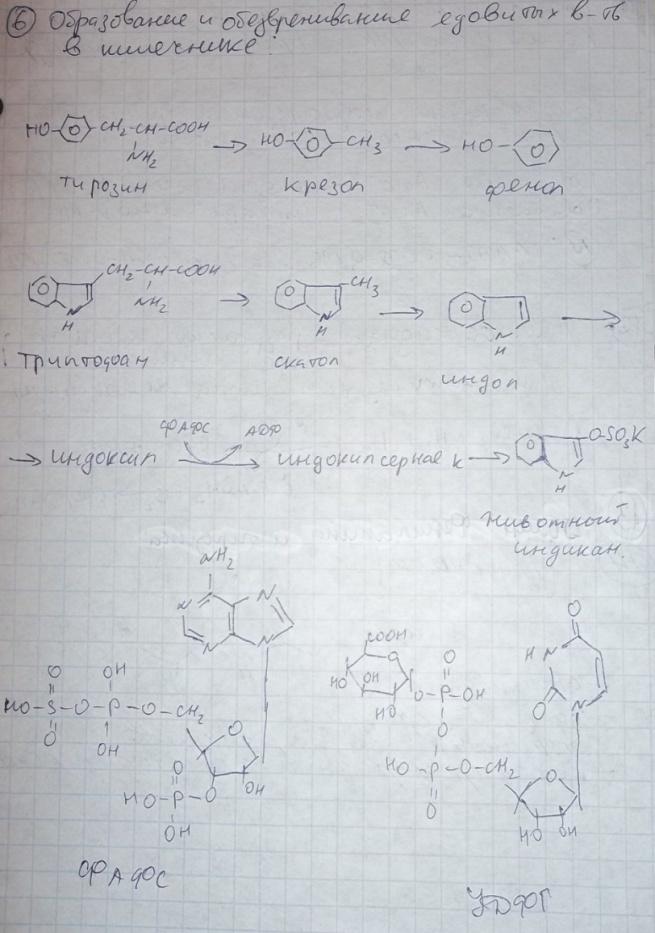
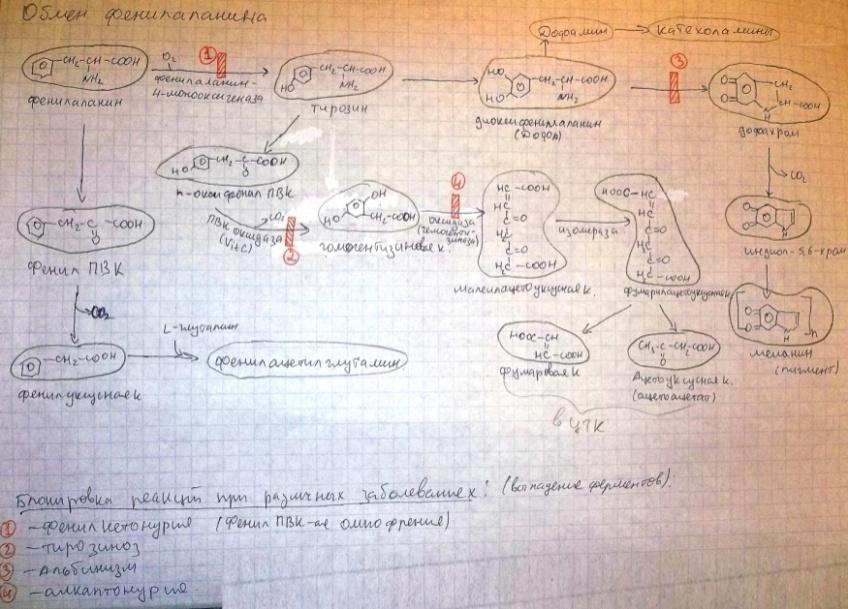
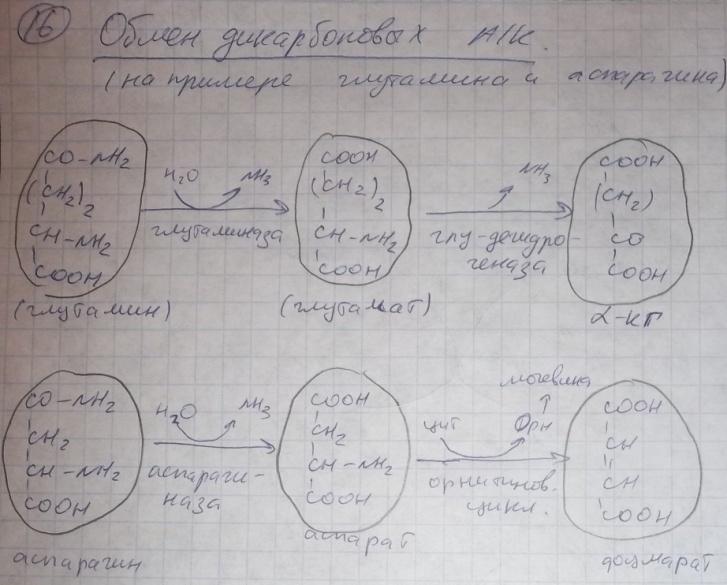
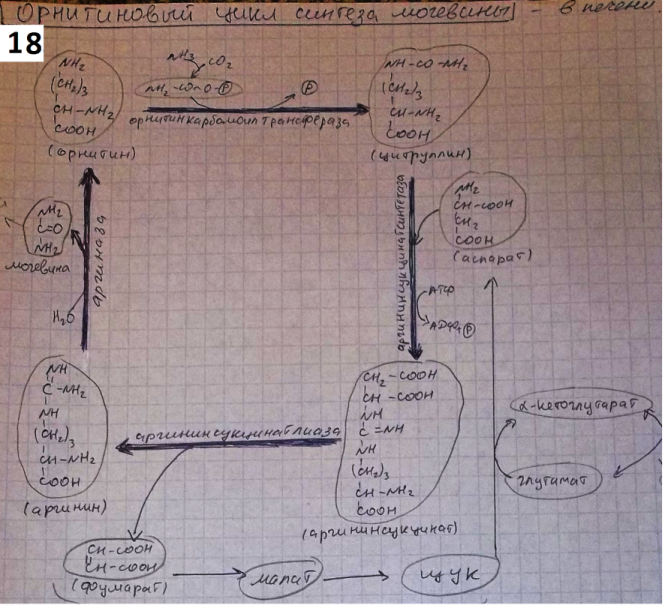
8)Клетметабол пул АК.Часть свобод АК включ в тк белки. Вслед распада белка эти АК возвращ в пул своб АК через различ врем стан пригод для повтор исп в синтбелка.Частьсвоб АК подверг катаболреакц приводит к потере углерод скелета в виде СО2или к отлож в виде гликогена и жира,азот вывод с мочой. Некот АК исп для азотсодсоед, пурин основя, креатин, адреналин и т. д. они постеп расщеп без возвращконечпрод в пул своб АК (напр, пурины распад до моч к, замен АК обр в орг с испаминогр, получ из др АК и углер скелетов, обр в обыч для метабол промеж реакц. АК исп в кач строит эл белка, и служат предшестбиосинт биолог и физиолсоед.
9)причин распада тк белков.1.Стар кл или их поврежвнеш фактор (токсич вещ, излуч). клетки разруш путем апоптоза или фагоцитир; все их компоненты, включая белки, деполимеризуются в лизосомах. 2. Денатурир белки более доступ субстр для протеолит ферм.3.Частич протеолиз белков в ходе посттрансляцдостройки. При превращпроферм и предшдр белков в функц акт белки отщеплчасть пептидной цепи гидролиз до АК. 4Перевар белков пищевар соков за сутки выдел в киш 50 г белков, в основ ферм. белки перевар, а АКвсас. 5.Рег конц белков путем индукции и репрессии. за сутки распадоколо 400 г тк белков, Часть белков распад после их включ в лизосомы при дейвнутрилизпептидгидр.





— универсальный носитель генетической информации и наследственных признаков у всех существующих на Земле организмов, представляет собой биополимер (полианион), мономером которого является нуклеотид. Каждый нуклеотид состоит из остатка фосфорной кислоты, присоединённого по 5'-положению к сахару дезоксирибозе, к которому также через гликозидную связь (C—N) по 1'-положению присоединено одно из четырёх азотистых оснований. Полимер ДНК обладает довольно сложной структурой. Нуклеотиды соединены между собой ковалентно в длинные полинуклеотидные цепи. Внутри одной цепи ДНК соседние нуклеотиды соединены фосфодиэфирными связями, которые формируются в результате взаимодействия между 3'-гидроксильной (3'—ОН) группой молекулы дезоксирибозы одного нукдеотида и 5'-фосфатной группой (5'—РО3) другого. Асимметричные концы цепи ДНК называются 3' (три прим) и 5' (пять прим Репликация Уникальным свойством ДНК является ее способность удваиваться (реплицироваться). В природе репликация ДНК происходит следующим образом: с помощью специальных ферментов (гираз), которые явлся катализаторами, в клетке происходит расплетение спирали в том ее участке, где должна происходить репликация (удвоение ДНК). Далее водородные связи, которые связывают нити, разрываются и нити расходятся. В построении новой цепи активным «строителем» выступает специальный фермент — ДНК-полимераза. Для удвоения ДНК необходим также стратовый блок или «фундамент», в качестве которого выступает небольшой двухцепочечный фрагмент ДНК. Этот стартовый блок, а точнее - комплементарный участок цепи родительской ДНК — взаимодействует с праймером — одноцепочечным фрагментом из 20—30 нуклеотидов. Происходит репликация или клонирование ДНК одновременно на обеих нитях. Из одной молекулы ДНК образуются две молекулы ДНК, в которых одна нить от материнской молекулы ДНК, а вторая, дочерняя, вновь синтезированная. Таким образом, процесс репликации ДНК (удваивания) включает в себя три основных этапа:Расплетение спирали ДНК и расхождение нитей, Присоединение праймеров, Образование новой цепи ДНК дочерней нити. В основе анализа методом ПЦР лежит принцип репликации ДНК — синтеза ДНК, который современным ученым удалось воссоздать искусственно: в лаборатории врачи вызывают удвоение ДНК, но только не всей цепи ДНК, а ее небольшого фрагмента. Синтез одной нити ДНК идет непрерывно (она называется лидирующая или ведущая нить), а синтез другой нити осуществляется короткими фрагментами (они называются фрагментами Оказаки в честь ученого, который их описал). Потом эти фрагменты сшиваются, и такая нить называется запаздывающей, в целом репликация этой нити идет медленней. Структура, которая образуется во время репликации, называется репликативной вилкой.
20. В построении новой цепи активным «строителем» выступает специальный фермент — ДНК-полимераза. Для удвоения ДНК необходим также стратовый блок или «фундамент», в качестве которого выступает небольшой двухцепочечный фрагмент ДНК. Этот стартовый блок, а точнее - комплементарный участок цепи родительской ДНК — взаимодействует с праймером — одноцепочечным фрагментом из 20—30 нуклеотидов. Происходит репликация или клонирование ДНК одновременно на обеих нитях. Из одной молекулы ДНК образуются две молекулы ДНК, в которых одна нить от материнской молекулы ДНК, а вторая, дочерняя, вновь синтезированная. Элонгация ( удлинение) цепи ДНК осуществляется ДНК-зависимыми ДНК-полимеразами. Терминация - Остановка синтеза полипептидной цепи при достижении терминирующего кодона в мРНК; также терминация – завершение синтеза РНК в процессе транскрипции или ДНК в процессе репликации. Теломеры - это концевые участки линейной молекулы ДНК, которые состоят из повторяющейся последовательности нуклеотидов. У человека теломеры содержат единственный повтор GGGTTA.Теломераза — фермент, добавляющий особые повторяющиеся последовательности ДНК (TTAGGG у позвоночных) к 3'-концу цепи ДНК на участках теломер, которые располагаются на концах хромосом в эукариотических клетках. Теломеры содержат уплотненную ДНК и стабилизируют хромосомы. При каждом делении клетки теломерные участки укорачиваются. Теломераза является обратной транскриптазой.
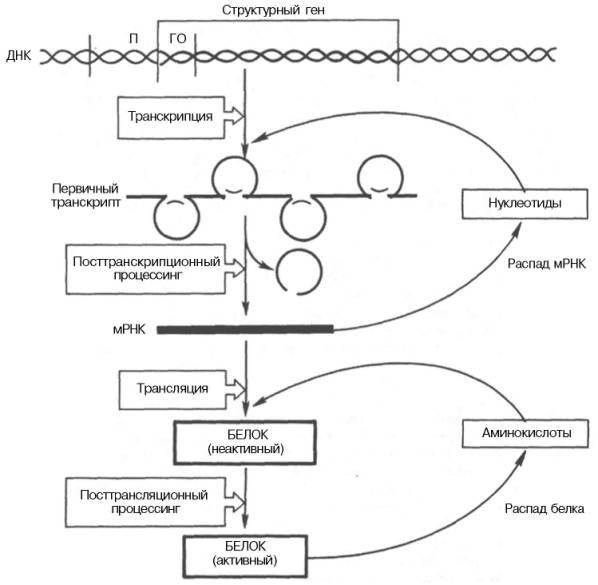
21. РНК – это полинуклеотиды, но состоят только из одной цепи, их мол.масса меньше, чем у ДНК. Кроме этого, они отличаются следующим: 1) количество РНК в клетке зависит от возраста, физиологического состояния, органной принадлежности клетки; 2) в мононуклеотидах РНК содержатся рибоза, вместо тимина урацил; 3) для РНК не характерны правила Чаргаффа; 4) в РНК больше минорных оснований, чем в ДНК, при этом в т-РНК количество минорных оснований приближается к 50. Все РНК синтезируются на ДНК, этот процесс называется транскрипцией. В зависимости от локализации в клетке, функции различают 3 вида РНК: м-РНК (матричная, или информационная), транспортная – т-РНК, рибосомальная. РНК-полимераза — фермент, осуществляющий синтез молекул РНК. Ферменты класса РНК-полимераз очень важны для функционирования клетки, поэтому они имеются во всех организмах и во многих вирусах. Химически РНК-полимеразы являются нуклеотидил-трансферазами. Процесс транскрипции разделяют на 4 основные стадии: 1) связывание молекул РНК-полимеразы с ДНК и распознавание промотора ; 2) инициация ; 3) элонгация ; 4) терминация . После связывания с ДНК молекулы РНК-полимеразы осуществляют поиск промоторов, на которых происходит формирование инициационных комплексов. Начальная стадия инициации транскрипции завершается образованием нескольких первых фосфодиэфирных связей в молекуле синтезируемой РНК, после чего наступает стадия элонгации - последовательного удлинения синтезируемых молекул РНК, которая заканчивается по достижении молекулами РНК-полимераз специальных регуляторных последовательностей ДНК, называемых терминаторами транскрипции , после чего происходит освобождение синтезированных молекул РНК и РНК-полимераз из транскрипционных комплексов. Освободившиеся молекулы РНК-полимераз приобретают способность вступать в новый цикл транскрипции. Разделение процесса транскрипции на стадии является упрощенной моделью, оно используется для удобства описания механизмов биосинтеза РНК. Основные этапы транскрипции и дальнейшие пути реализации генетической информации представлены на рис. I.6 . В обычных условиях холофермент РНК-полимераз эубактерий для инициации транскрипции не требует дополнительных факторов. В отличие от этого для точной инициации транскрипции РНК- полимеразой II требуется наличие, кроме ее субъединиц, еще и основных факторов транскрипции . Синтез РНК, который не зависит от присутствия регуляторных молекул, получил название базальной транскрипции . Транскрипция является регулируемым процессом, который требует участия белков-активаторов или репрессоров. Белок-активатор (тканеспецифический фактор транскрипции) взаимодействует с регуляторными последовательностями ДНК и активирует синтез РНК. Такая транскрипция получила название индуцированной, или активированной . Базальная транскрипция не может происходить in vivo, и этот термин используется только при описании результатов исследований синтеза РНК in vitro, в бесклеточных системах транскрипции.
22. Генетический код — единая система записи наследственной ин формации в молекулах нуклеиновых кислот в виде последова тельности нуклеотидов. Генетический код основан на использо вании алфавита, состоящего всего из четырех букв-нуклеотидов, отличающихся азотистыми основаниями: А, Т, Г, Ц. Основные свойства генетического кода следующие: 1. Генетический код триплетен. Триплет (кодон) — последовательность трех нуклеотидов, кодирующая одну аминокислоту. Поскольку в состав бел ков входит 20 аминокислот, то очевидно, что каждая из них не может кодироваться одним нуклеотидом (поскольку в ДНК всего четыре типа нуклеотидов, то в этом случае 16 аминокислот оста ются незакодированными). Двух нуклеотидов для кодирования аминокислот также не хватает, поскольку в этом случае могут быть закодированы только 16 аминокислот. Значит, наименьшее число нуклеотидов, кодирующих одну аминокислоту, оказыва ется равным трем. (В этом случае число возможных триплетов нуклеотидов составляет 43 = 64). 2. Избыточность (вырожденность) кода является следствием его триплетности и означает то, что одна аминокислота может кодироваться несколькими трип летами (поскольку аминокислот 20, а триплетов — 64). Исключение составляют метионин и триптофан, которые кодируются только одним триплетом. Кроме того, некоторые триплеты вы полняют специфические функции. Так, в молекуле иРНК три из них УАА, УАГ, УГА — являются терминирующими кодонами, т. е. стоп-сигналами, прекращающими синтез полипептидной цепи. Триплет, соответствующий метионину (АУГ), стоящий в начале цепи ДНК, не кодирует аминокислоту, а выполняет функцию инициирования (возбуждения) считывания. 3. Одно временно с избыточностью коду присуще свойство однозначнос ти, которое означает, что каждому кодону соответствует только одна определенная аминокислота. 4. Код коллинеарен, т.е. по следовательность нуклеотидов в гене точно соответствует после довательности аминокислот в белке. 5. Генетический код непере крываем и компактен, т. е. не содержит «знаков препинания». Это значит, что процесс считывания не допускает возможности перекрывания колонов (триплетов), и, начавшись на определенном кодоне, считывание идет непрерывно триплет за триплетом вплоть до стоп-сигналов (терминирующих кодонов). Например, в иРНК следующая последовательность азотистых оснований АУГГУГЦУУААУГУГ будет считываться только такими трип летами: АУГ, ГУГ, ЦУУ, ААУ, ГУГ, а не АУГ, УГГ, ГГУ, ГУГ и т. Д. или АУГ, ГГУ, УГЦ, ЦУУ и т. д. или еще каким-либо образом (допустим, кодон АУГ, знак препинания Г, кодон УГЦ, знак пре пинания У и Т. п.). 6. Генетический код универсален, т. е. ядер ные гены всех организмов одинаковым образом кодируют инфор мацию о белках вне зависимости от уровня организации и систематического положения этих организмов Информационная (матричная) РНК (иРНК). Молекулы иРНК могут содержать от 300 до 3 тыс. рибонуклеотидов и имеют линейную структуру. Являются посредником между ДНК и полипептидом. В процессе синтеза молекулы иРНК с молекулы ДНК переписывается информация о структуре полипептида. Далее молекулы иРНК переносят эту информацию из ядра в цитоплазму к рибосомам, где и происходит синтез полипептида. иРНК составляет ~ 0,5–1 % массы всех РНК клетки. 23. Молекулы транспортной РНК (тРНК) играют ключевую роль в экспрессии генов, участвуя в переводе информации, содержащейся в матричных РНК в виде кодонов, на язык аминокислотных остатков белковых цепей. В статье описаны первичная, вторичная и пространственная структуры молекул тРНК и функции тРНК на первом этапе биосинтеза белков. Основное назначение транспортной РНК (тРНК) - доставлять активированные остатки аминокислот в рибосому и обеспечивать их включение в синтезирующуюся белковую цепь в соответствии с программой, записанной генетическим кодом в матричной, или информационной, РНК (мРНК).
24. иосинтез белка (трансляция) делится на три этапа: инициация, элонгация и терминация. На этапе инициации происходит сборка трансляционного комплекса: к инициирующему триплету мРНК (AUG) присеодиняется малая субъединица рибосомы, к этому же триплету присоединяется тРНК с аминокислотой метионином. Далее последовательно прсоединяются белковые факторы инициации, магний, большая субъединица рибосомы и GTP. Трансляционнный комплекс готов. В собранной рибосоме на этом этапе выделяют два центра А и Р. В Р-центре сейчас находится тРНК с метионином, А центр свободен. Этап элонгации в свою очередь состит из трех последовательных стадий: 1) присоединение аа-тРНК, 2) транспептидация и 3) транслокация. 1) в А центр присоединяется аминоацил-тРНК с аминокислотой, соответствующей тому триплету, который находится в этом центре (тРНК присоединяется к кодону (триплету) мРНК с помощью комплементарного участка, который называется антикодон), таким образом первичная структура белка будет зависеть от последовательности нуклеотидов в мРНК (а значит, изначально в ДНК). 2) происходит образование петидной связи между метионином и второй аминокислотой, метионин "отрывается" от своей тРНК и перносится на аминокислоту в А-центр. Т.е. Р-центр сейчас свободен, в А-центре находится т-рнк с дипептидом. 3) Происходит передвижение рибосомы вдоль мРНК на один триплет. При этом Р-центр перемещается на тот триплет, который был в А-центре, в А-центр попадает следующий триплет. Таким образом, теперь в Р-центре дипептид, А-центр свободен. Далее все три стадии элонгации повторяются: присоединяется новая аминоацилТРНК с аминокислотой, образуется пептидная свзь, рибосома смещается еще на триплет. Стадия терминации начинается тогда, когда в А-центре оказывается один из трех стоп-кодонов (триплеты не соответствующие ни одной кислоте). Тогда к рибосоме присоединяется фактор терминации, который способствует отсодинению получившегося полипептида от трнк. полипептид и тРНК покидают рибосому, рибосома "разваливается" на субъединицы. Далее происходят посттрансляционные модификации белка.
25. Посттрансляционные изменения белков включают формирование высших структур белка после синтеза полипептидной цепи в рибосомах. Описаны более сотни различных вариантов посттрансляцийних изменений в белках. К наиболее известным принадлежат: 1.Частичный протеолиз. Многие белки первично синтезируются в виде неактивных предшественников, из которых потом путем ограниченного протеолиза образуются отдельные функционально активные белки. Так, большинство протеолитических ферментов пищеварительного тракта образуется в виде неактивных проферментов (пепсиногена, триписиногена, прокарбоксипептидазы и т.д.), и активируются после отщепления пептидов, блокирующих их активный центр. Белковые гормоны также синтезируются в виде неактивных предшественников. Путем протеолиза из препроинсулина образуется инсулин, проопиомеланокортина - пептидные гормоны гипофиза и т.д. Секреторные белки, синтезированные на рибосомах, при прохождении через мембраны эндоплазматического ретикулума и аппарата Гольджи поддаются ограниченному протеолизу. Примером является отщепление N-концевых формилметионина и метионина от синтезированной полипептидной цепи. 2. Гликозилирование. Белки, входящие в состав плазматических мембран или секретирующиеся клеткой наружу в процессе дозревания, поддаются действию многочисленных гликозилтрансфераз мембран эндоплазматического ретикулума и аппарата Гольджи. Углеводов присоединяются по ОН группам серина и треонина (О-гликозилирование) или по NН2 аспарагина (N-гликозилирование).
Фолдинг белков. Это свертывание полипептидной цепи в трехмерную структуру. Если белок состоит из нескольких субъединиц, то фолдинг включает и их объединение в одну макромолекулу. Фолдинг - это обязательный этап превращения полипептидной цепи, которая сходит с рибосомального конвеера, на функционально активный белок. В результате фолдинга у полипептида уменьшается свободная энергия, гидрофобные остатки аминокислот упаковываются преимущественно в середину молекулы, а гидрофильные остатки располагаются на поверхности белковой глобулы.
Нарушение фолдинга белков лежит в основе болезни Альцгеймера, при которой в мозге откладывается β-амилоид – агрегаты белка, потерявшего свою α-спирализацию. Он имеет β-складчатую структуру, малорастворим и плохо поддается протеолизу. Амилоид накапливается в нервных клетках, нарушает их функцию и вызывает гибель. Аналогично действуют и прионовые белки. Приони не только самые лишены нормальной спирализации, но и при контакте с другими белками вызывают потерю ими нормальной конформации. Человек может заражаться прионовыми белками употребляя мясо животных, содержащих прионы, как это бывает при болезни Крейтцфельдта-Якоба.Прионовые болезни - группа заболеваний, связанных с нарушением метаболизма и накоплением в клетках ЦНС прионовых белков. Этот белок содержится в организме человека и в норме. Он кодируется одним из генов 20-й хромосомы. Особенно высока его концентрация в нейронах головного мозга. При патологии в головном мозге накапливается модифицированная форма прионного белка, устойчивая к действию протеаз.
26.
Регуляция на уровне транскрипции (образование первичного транскрипта) — наиболее распространенный механизм регуляции синтеза белков. Этот процесс иначе называют регуляцией действия генов или регуляцией экспрессии белков. Различают две формы регуляции: индукция синтеза (положительная регуляция) и репрессия синтеза (отрицательная регуляция).
Регуляция генов.
Понятия индукции и репрессии предполагают изменение скорости синтеза по отношению к некоторому исходному, базальному уровню . Синтез в базальном состоянии называют конститутивным синтезом. Если скорость конститутивного синтеза некоторого белка высока, то такой белок обычно регулируется по механизму репрессии синтеза, и наоборот — при низкой базальной скорости обычно бывает индукция синтеза. При промежуточной базальной скорости синтез белка может регулироваться и путем индукции, и путем репрессии.Понятия «положительная регуляция» и «отрицательная регуляция» относятся также и к регуляции активности белка — ингибированию или активации уже имеющегося белка.
Ф. Жакоб и Ж. Моно выдвинули в 1961 году гипотезу оперона. По этой схеме гены функционально неодинаковы. Один из них - структурный ген, содержит информацию о расположении аминокислот в молекуле белка фермента, другие выполняют регуляторные функции, оказывающие влияние на активность структурных генов – гены – регуляторы. Структурные гены располагаются рядом и образуют блок – оперон. Они программируют синтез ферментов. Кроме того в оперон входят участки, относящиеся к процессу включения транскрипции. Вся группа генов одного оперона функционирует одновременно, поэтому ферменты одной цепи реакции либо синтезируются все, либо не синтезируется ни один из них. В самом начале структуры оперона находится ген – оператор, который включает и выключает структурные гены. Оператор контролирует ген – регулятор. Ген-регулятор кодирует синтез белка-репрессора. Репрессор в активной форме блокирует транскрипцию, считывание генетической информации прекращается и весь оперон выключается. До тех пор, пока репрессор связан с геном-оператором, оперон находится в выключенном состоянии. При переходе в неактивную форму ген-оператор освобождается, происходит включение оперона и начинается синтез соответствующей РНК с последующим процессом синтеза ферментов. Оперонная система представляет собой один из механизмов регуляции синтеза белка.
27.
В клетках эукариот от ДНК исходят сигналы, которые в конечном счете передаются РНК-полимеразе: стимулируют или подавляют инициацию синтеза РНК. Источником сигналов служат определенные локусы ДНК — регуляторные элементы. Эти участки имеют небольшие размеры, порядка 10 н. п. Регуляторные элементы, стимулирующие транскрипцию, называют энхансерами (англ. enhancer — усилитель), а подавляющие транскрипцию — сайленсерами (англ. silencer — глушитель, успокоитель).
Регуляторные элементы могут избирательно соединяться с белками-регуляторами.
Белки, соединяющиеся с энхансерами, называют индукторами, а соединяющиеся с сайленсерами — репрессорами.Цис-элементы действуют на гены только той молекулы ДНК, в которой они сами находятся. Энхансеры и сайленсеры могут располагаться вблизи от промотора и от стартовой точки транскрипции регулируемого гена, но могут быть и удалены от него, даже на тысячи нуклеотидных пар, как в сторону 5'-конца, так и в сторону З'-конца. Однако они могут быть сближены в результате изгибания молекулы ДНК.
Белки-регуляторы (индукторы и репрессоры) содержат по крайней мере три домена:1) домен, узнающий определенную нуклеотидную последовательность ДНК; эти домены часто имеют супервторичную структуру типов а-спираль-пово-рот-а-спираль, лейциновая застежка-«молния», цинковый палец;
2) домен, узнающий трансэлементы;
3) домен, взаимодействующий с факторами транскрипции в области ТАТА-последовательности; в результате этого белки-регуляторы влияют на транскрипцию, а именно увеличивают (индукторы) или уменьшают (репрессоры) частоту инициации транскрипции.
Каждый ген регулируется независимо от других. Следовательно, для каждого гена существуют специфические регуляторные элементы (локусы ДНК) и специфические регуляторные белки, узнающие эти элементы. Уже известно много ре-гуляторных белков и регуляторных элементов разных генов, и постоянно обнаруживаются все новые и новые.
