- •Теоретические циклы двигателя.
- •Анализ теоретических циклов.
- •Термический кпд смешанного цикла.
- •После преобразований получаем:
- •Анализ термического кпд t.
- •2). Цикл со смешанным подводом теплоты.
- •Действительные циклы двигателей.
- •Основы теории наддува.
- •Теоретический цикл состоит из цикла двс и цикла ткр
- •Процесс впуска.
- •Температура заряда в конце такта впуска.
- •Коэффициент наполнения.
- •Факторы, влияющие на коэффициент наполнения ηv
- •2.Давление в конце впуска
- •3.Давление остаточных газов.
- •5.Подогрев заряда.
- •6.Частота вращения.
- •7.Нагрузка.
- •Коэффициент остаточных газов.
- •Процесс сжатия.
- •Характеристика свежего заряда.
- •Смесеобразование в карбюраторных двигателях.
- •Смесеобразование в дизелях. Подача и распыление топлива.
- •Типы смесеобразования в дизелях. Объемное смесеобразование.
- •Объемно-пленочное смесеобразование
- •Процесс сгорания.
- •Сущность объемного и диффузного сгорания. Сущность объемного сгорания.
- •2.Сущность диффузионного горения.
- •Воспламенение смеси и распространение пламени в карбюраторных двигателях.
- •Самовоспламенение и сгорание в дизелях.
- •Анализ процесса сгорания в двс по индикаторной диаграмме.
- •Потери теплоты во время сгорания
- •Параметры газа в конце процесса сгорания
- •Теоретическое количество воздуха для полного сгорания топлива.
- •Состав и количество продуктов сгорания бедных смесей
- •Факторы, влияющие на процесс сгорания в двигателях с искровым зажиганием
- •Факторы, влияющие на процесс сгорания в дизеле.
- •Нарушение процесса сгорания в карбюраторных двигателях Детонация.
- •Преждевременное воспламенение (калильное зажигание).
- •Воспламенение от сжатия при выключенном зажигании
- •Процесс расширения
- •Процесс выпуска
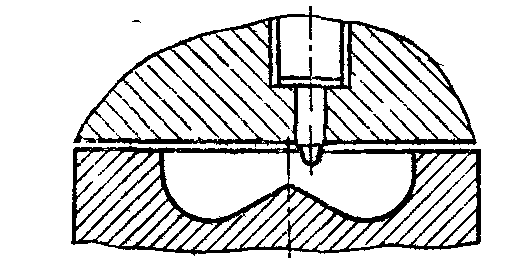
Объемно-пленочное смесеобразование
Такое смесеобразование
получается при меньших диаметрах камеры
сгорания
![]() ,
когда примерно 50% топлива достигает
стенок камеры сгорания, а другая половина
находится в объеме камеры сгорания.
Данный тип смесеобразования осуществляется
в дизелях с непосредственным впрыском
и неразделёнными камерами сгорания.
,
когда примерно 50% топлива достигает
стенок камеры сгорания, а другая половина
находится в объеме камеры сгорания.
Данный тип смесеобразования осуществляется
в дизелях с непосредственным впрыском
и неразделёнными камерами сгорания.
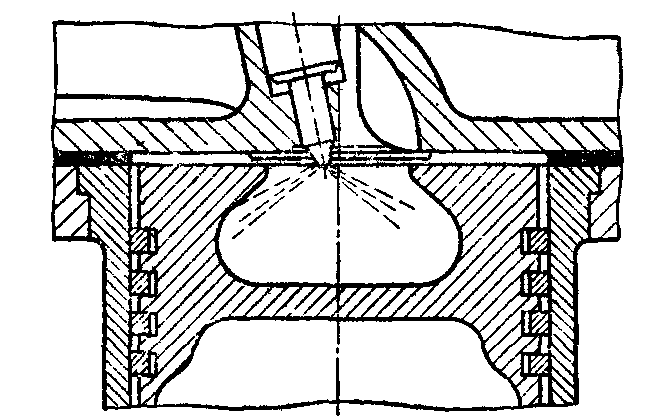
|
Рис. 26. Тороидная камера сгорания; камера ЦНИДИ |
Для улучшения смесеобразования предусмотрено вихревое движение воздуха вдоль оси цилиндра за счёт тангенциально расположенных впускных клапанов (Vтан=25 – 30 м/с)
Температура стенок камеры сгорания должна быть достаточной для осуществления испарения, но недостаточной для термического расщепления молекул с образованием нагара (330 – 350С)
Данный тип смесеобразования обеспечивает хорошее протекание рабочего процесса, высокие мощностные и экономические показатели.
Процесс сгорания.
Процесс сгорания топлива представляет собой химическую реакцию окисления углеводородов (СН) топлива кислородом воздуха при высоких скоростях с выделением теплоты. Согласно современной перекисной теории процесс окисления происходит через ряд последовательных реакций образования промежуточных продуктов, осуществляющих переход реагирующей системы от исходного состояния к конечным продуктам. Вся реакция окисления разделяется на два этапа: предпламенное окисление и пламенное. В результате предпламенного окисления в процессе впуска и сжатия смеси в карбюраторных двигателей и в начальный период впрыска топлива в дизелях образуются перекиси типа R-O-O-R и молекулы с группой OH, атомы Н2 и О2, а также радикалы ОН, СН, СН2. С точки зрения химической теории в основе этих реакций лежит элементарный акт столкновения молекул топлива и воздуха, в результате которого разрушаются внутримолекулярные связи исходных компонентов, замещаясь новыми. Чтобы происходила химическая реакция, число столкновений должно составлять 109… 1012 сек-1. Частота столкновений в единице объёма определяет скорость реакции:
![]()
A = 1013 … 1014 – коэффициент, характеризующий зависимость скорости реакции от свойства смеси и концентрации реагентов; частота собственных колебаний;
Р – давление смеси;
n – порядок реакции, определяемый числом реагентов, участвующих в реакции
![]() –число, определяющее
вероятную долю активных столкновений;
–число, определяющее
вероятную долю активных столкновений;
Е – энергия активизации, т.е. та минимальная дополнительная энергия, которую необходимо сообщить молекулам при данных Р и Т, чтобы их столкновение привело к разрушению межмолекулярных связей. Величина Е = 8,4… 16,8 МДж/моль и зависит от химической природы топлива и условий, при которых происходит реакция. Если молекулы имеют свободные незамещенные связи и движутся с высокими скоростями, то энергия активации невелика. В случае инертных молекул для возникновения реакции требуются высокие значения Е. Дизельное топливо имеет меньшее значение Е по сравнению с бензином.
R – универсальная газовая постоянная;
Т – температура смеси
Некоторые элементы предпламенных реакций обладают повышенной реакционной способностью, вызывая самоускорение реакции по цепному принципу, т.е. исходные вещества переходят в конечные через более или менее длинную цепь отдельных реакций с образованием ряда промежуточных элементов, не редко крайне неустойчивых. Ведущую роль в развитии цепной реакции играют химически активные элементы, обладающие свободными валентностями, легко вступающие в соединение с исходными или промежуточными продуктами без термической активации (атомы ОН, радикалы ОН). В результате указанных реакций получаются конечные продукты и, одновременно, вновь образуется некоторое количество таких же или других активных частиц, которые снова вступают в реакцию, возобновляя цепь превращений.
Если в результате элементарного акта химически активной частицы с какой-либо молекулой воссоздаётся лишь одна активная частица, то имеет место простое продолжение реакции и она является неразветвлённой. Скорость неразветвлённой цепной реакции определяется числом активных частиц, возникающих в единицу времени, и средней длиной цепи.
Если в результате элементарной реакции с участием одной активной частицы возникают две или большее число новых активных частиц, то имеет место разветвленная реакция. Скорость такой реакции очень быстро возрастает со временем даже при отсутствии повышенной температуры. Обрыв цепи происходит при столкновении между собой химически активных частиц и в результате адсорбции их стенками, окружающими реагирующую смесь.
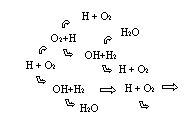
Рис.27. Схема цепной реакции окисления водорода.
Поэтому увеличение концентрации химически активных веществ сопровождается увеличением числа обрывов цепей и, как следствие, скорость разветвлённой цепной реакции стабилизируется, а затем уменьшается в результате впрыскивания исходных элементов.