
645 Химическая кинетика. Химическое равновесие
.pdf
12
ношению к первоначальной, определяется отношением V1 / V = 3ka4b / ka4b = 3; 2) V2 = k(3a)4b = 81ka4b, V2 / V = 81ka4b / ka4b = 81; 3) увеличение давления в три раза во столько же раз увеличивает концентрацию газообразных реагиру-
ющих веществ, поэтому V3 = k(3a)43b = 243ka4b; V3 / V = 243ka4b / ka4b = 243. Ответ. 1) V1 / V = 3; 2) V2 / V = 81; 3) V3 / V = 243.
Пример 3
Температурный коэффициент реакции равен 3. Как изменится скорость этой реакции, если температуру ее проведения повысить на 40ºС?
Решение. Обозначим скорость реакции при низкой температуре V1. В со-
ответствии с правилом Вант-Гоффа, скорость реакции возрастает в 3 раза при повышении температуры на каждые 10ºС. По условию задачи температура повысилась на 40ºС. Значит, V2 = V1·γ(40/10) = V1·34 = 81V1.
Обратите внимание на то, что для решения подобных задач не нужно знать вид кинетического уравнения.
Ответ. Скорость реакции возрастет в 81 раз.
Пример 4. Вычисление времени протекания реакции при изменении тем-
пературы.
При 353 К реакция заканчивается за 20 секунд. Сколько времени длится реакция при 293 К, если температурный коэффициент этой реакции равен 2,5?
Решение. Между скоростью протекания химических реакций и их про-
должительностью существует обратно пропорциональная зависимость:
V2/V1 = τ1/τ2,
где V1 и τ1 – скорость и время протекания реакции при температуре Т1, V2 и τ2 –
скорость и время протекания реакции при температуре Т2.
Правило Вант-Гоффа в данном случае можно записать в виде:
τ1 |
|
T2 -T1 |
||
= |
10 |
|
||
τ2 |
||||
|
, |
|||
откуда τ1 = τ2·γ(T2-T1)/10, τ1 = 20·2,5(353-293)/10 = 20·2,56; τ1 = 4879 с = 1 ч 21 мин 19 с.
Ответ. При 293 К реакция длится 1 ч 21 мин 19 с.
13
Пример 5
Для реакции 2Fe3+ + Sn2+ = 2Fe2+ + Sn4+ определите порядок относительно
каждого реагента, суммарный порядок и напишите кинетическое уравнение на основании следующих кинетических данных:
Концентрация, моль/л |
V0 |
|
||
[Fe3+]0 |
|
[Sn2+]0 |
|
|
C |
|
C |
V |
|
2C |
|
C |
4V |
|
2C |
|
2C |
8V |
|
Решение. Из приведенных данных видно, что увеличение [Fe3+]0 в 2 раза |
||||
при неизменной концентрации [Sn2+]0 |
приводит к увеличению скорости в 4 ра- |
|||
за, следовательно, порядок по железу равен 2. Увеличение обеих концентраций в 2 раза приводит к увеличению скорости в 8 раз. Так как порядок по железу равен 2, такое изменение скорости соответствует первому порядку по олову.
Тогда общий порядок равен 3. Кинетическое уравнение реакции:
V = k[Fe3+]2 · [Sn2+].
Ответ. V = k[Fe3+]2·[Sn2+]. Порядок по Fe3+ – 2, – по Sn2+ – 1, общий – 3.
Пример 6
Определите энергию активации Еа реакции, для которой при повышении температуры от 22ºС до 32ºС скорость удваивается, если концентрации реаген-
тов остаются при этом постоянными.
Решение. Так как концентрации реагентов одинаковы, то удвоению ско-
рости соответствует удвоение константы скорости. Запишем уравнение Арре-
ниуса для двух температур в виде:
ln k1 = ln A - Eа / RT1, ln k2 = ln A - Eа / RT2. Возьмем их разность: ln k2 - ln k1 = - Eа / RT2 + Eа / RT1,
отсюда R ln (k2/k1) = Eа (1/T1 - 1/T2); Eа = R ln (k2/k1) / (1/T1 - 1/T2).
Отношение k2/k1 = 2 по условию, Т1 = 295 К, Т2 = 305 К. Находим значе-
ния обратных температур: 1/T1 = 1/295 = 0,00339; 1/T2 = 1/305 = 0,00328;. Полу-
чаем Еа =8,3 · ln 2 / (0,00011) = 52353.
Ответ. Еа = 52353 Дж =52,4 кДж.
14
1.3. Экспериментальная часть
Лабораторная работа
Скорость химических реакций
Цель работы: изучить влияние различных факторов на скорость химиче-
ских реакций в гомогенной и гетерогенной системах.
Приборы и реактивы. Секундомер. Термостат (стакан вместимостью
200-250 мл и крышка к нему с отверстиями для пробирок). Термометр на 100ºС.
Фарфоровая ступка с пестиком. Тигельные щипцы. Спиртовка. Шпатель. Стек-
лянная палочка. Бюретка (10 мл). Колба коническая (50 мл). Лучинка. Раство-
ры: тиосульфата натрия (1н), йодата натрия или калия (0,25н), серной кислоты
(0,5н, 2н), соляной кислоты (2н), хлорида железа (III) (0,0025н, 0,5н, насыщен-
ный), роданида калия (0,0025н, насыщенный), дихромата калия (0,5н), гидрок-
сида аммония, гидроксида натрия, крахмального клейстера, пероксида водорода
(10%-ный), перманганата калия (0,1н), щавелевой кислоты (0,5н), сульфата марганца (II) (0,5н). Кристаллические вещества: сульфит натрия, нитрат свинца,
йодид калия, порошок алюминия, йод, оксид марганца (IV). Алюминиевая фольга.
1.3.1. Опыт 1. Влияние концентрации реагирующих веществ
на скорость реакции в гомогенной системе
Опыт 1а. Взаимодействие тиосульфата натрия с серной кислотой
Реакция взаимодействия тиосульфата натрия с серной кислотой протекает по уравнению:
Na2S2O3 + H2SO4 = Na2SO4 + S↓ + SO2↑ + H2O. |
|
Эта реакция протекает в 3 стадии (система последовательных реакций): |
|
Na2S2O3 + H2SO4 = H2S2O3 + Na2SO4, |
(а) |
H2S2O3 = H2SO3 + S↓, |
(б) |
H2SO3 == H2O + SO2↑. |
(в) |
Скорость всего процесса определяется скоростью наиболее медленной реакции, в данном случае это реакция (б). Постановка опыта основывается на

15
следующем: разложение тиосерной кислоты (H2S2O3) сопровождается выделением эквивалентного количества коллоидной серы, поэтому по оптической плотности ее суспензии можно судить о скорости данной реакции.
Для предварительного ознакомления с характером изучаемой реакции проделайте качественный опыт: внесите в пробирку 5-10 капель 1н раствора тиосульфата натрия и 1-2 капли 2н раствора серной кислоты. Обратите внимание, что выделяющаяся сера образует суспензию, которая делает раствор мутным. По времени начала помутнения можно судить о начале реакции и о ее скорости.
Порядок проведения опыта и оформление
1)Запишите уравнение реакции.
2)Начертите таблицу 1.
|
|
|
|
|
|
|
Таблица 1 |
|
|
|
|
|
|
|
|
|
|
|
Кол-во |
|
|
Общий |
Условная |
Время |
|
Скорость |
№ |
Кол-во |
Кол-во |
объем |
концентра- |
|
реакции в |
||
капель |
течения |
|
||||||
про- |
капель |
капель |
раствора |
ция |
|
усл. ед., |
||
раствора |
реакции, |
|
||||||
бирки |
Н2О |
H2SO4 |
(кол-во |
Na2S2O3, |
|
V = 1/ , |
||
|
Na2S2O3 |
|
|
капель) |
моль/л |
, с |
|
с-1 |
1 |
4 |
8 |
1 |
13 |
1С |
|
|
|
2 |
8 |
4 |
1 |
13 |
2С |
|
|
|
3 |
12 |
- |
1 |
13 |
3С |
|
|
|
3) Налейте в три пробирки количество капель тиосульфата натрия и воды в соотношениях, указанных в таблице 1. Первую и вторую пробирки осторожно встряхните. Таким образом, содержание (концентрация) тиосульфата натрия во второй пробирке будет в два раза больше, чем в первой, а в третьей – в три раза больше, чем в первой, т. е. приготовлены три раствора тиосульфата натрия различной концентрации. Если условно обозначить молярную концентрацию тиосульфата натрия в пробирке № 1 С моль, то в пробирке № 2 будем иметь концентрации 2С моль, а в пробирке № 3 3С моль.
4) Возьмите пробирку № 1 и добавьте в нее одну каплю 2н раствора серной кислоты и тотчас же включите секундомер или начните отсчет времени по секундной стрелке часов. Следите за тем, чтобы капля серной кислоты точно

16
попала в раствор, а не на стенку пробирки. При появлении в растворе опалесценции (начальных признаков помутнения) выключите секундомер. Запишите в таблицу 1 время ( ) с момента добавления кислоты до помутнения раствора, то есть время начала реакции.
5) Рассчитайте скорость реакции, как величину обратно пропорциональную времени: V = 1/ и запишите в таблицу.
Опыт повторите поочередно с пробирками № 2 и № 3, отмечая время с момента добавления кислоты до помутнения раствора. Обратите внимание на то, чтобы во всех опытах время фиксировалось при появлении одной и той же плотности помутнения. Для этого его должен отмечать один и тот же студент.
6)На миллиметровой бумаге начертите график зависимости скорости реакции от концентрации тиосульфата натрия. Для этого на оси абсцисс отложите
вопределенном масштабе относительные концентрации тиосульфата натрия, а на оси ординат – отвечающие им скорости: V = 1/ , с-1.
7)Запишите выражение закона действующих масс для рассматриваемой реакции, определите ее молекулярность и порядок.
8)На основании проделанных опытов и графика сделайте вывод о зависимости скорости реакции от концентрации реагирующих веществ. Как согласуются ваши наблюдения с законом действующих масс?
9)Найдите из графика величину константы скорости реакции. На основании этого сделайте вывод: велика или мала скорость данной реакции? Зависит ли константа скорости от концентрации реагирующих веществ?
Опыт 1б. Взаимодействие йодата натрия с сульфитом натрия
Процесс окисления сульфита натрия йодатом натрия выражается уравне-
нием:
2NaJO3 + 5Na2SO3 + H2SO4 = J2 + 6Na2SO4 + H2O.
Эта реакция протекает по двум ступеням.
Первая ступень: 3Na2SO3 + NaJO3 = Na2SO4 + NaJ, 3SO32- + JO3- = 3SO42- + J-.

17
После полного окисления сульфита натрия (конец первой реакции), образовавшийся йодид натрия вступает во взаимодействие с непрореагировавшим йодатом натрия.
Вторая ступень: NaJO3 + 5NaJ + 3H2SO4 = 3J2 + 3Na2SO4 + 3H2O, JO3- + 5J- + 6H+ = 3J2 + 3SO42- + 3H2O.
Выделяющийся молекулярный йод образует с присутствующим в растворе крахмалом соединения, окрашивающие раствор в синий цвет.
Появление синей окраски указывает на начало второй ступени и на конец первой. Реакция окисления сульфита йодатом натрия протекает довольно медленно, поэтому время ее протекания можно измерить с помощью секундомера. Началом реакции считают момент приливания сульфита натрия к раствору йодата, а концом – появление синей окраски. Выделение даже незначительного количества свободного йода обнаруживается в присутствии крахмала.
Порядок проведения опыта и оформление
1)Запишите уравнение реакции.
2)Начертите таблицу 2.
|
|
|
|
|
|
|
Таблица 2 |
|
|
|
|
|
|
|
|
|
|
|
Кол-во |
|
Кол-во |
Общий |
|
|
Скорость |
|
|
|
капель |
Условная |
Время |
||||
№ |
капель |
Кол-во |
объем |
реакции |
||||
восста- |
концентра- |
течения |
||||||
про- |
раство- |
капель |
раствора |
в у. е., |
||||
бирки |
ра |
Н2О |
нови- |
(кол-во |
ция NaJO3, |
реакции, |
V = 1/ , |
|
тельной |
моль/л |
, с |
||||||
|
NaJO3 |
|
капель) |
с-1 |
||||
|
|
смеси |
|
|||||
|
|
|
|
|
|
|
||
1 |
4 |
12 |
2 |
18 |
1С |
|
|
|
2 |
8 |
8 |
2 |
18 |
2С |
|
|
|
3 |
12 |
4 |
2 |
18 |
3С |
|
|
3) В трех сухих пробирках приготовьте одинаковые объемы растворов йодата натрия различной концентрации. Для этого в первую пробирку внесите 4 капли 0,25н раствора йодата натрия и 12 капель дистиллированной воды, во вторую пробирку – 8 капель этого же раствора йодата натрия и 8 капель воды, в третью пробирку – 12 капель йодата натрия и 4 капли воды. Таким образом, концентрация йодата натрия во втором и третьем случае будет соответственно
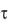
18
в 2 и 3 раза больше, чем в первом. Если условно обозначить молярную концентрацию йодата в пробирке № 1 С моль, то в пробирках № 2 и № 3 будем иметь концентрацию 2С и 3С моль соответственно. Пробирки поставьте в штатив.
4) Приготовьте восстановительную смесь: 2 микрошпателя сульфита натрия внесите в пробирку и растворите в 10 каплях воды. В раствор добавьте 10 капель свежеприготовленного крахмала и 2 капли 2н серной кислоты. Смесь размешайте стеклянной палочкой.
5)Внесите 2 капли приготовленной восстановительной смеси в пробирку
№1. По секундомеру отметьте время от момента добавления восстановительной смеси до появления в растворе синей окраски. Опыт повторите поочередно с пробирками № 2 и № 3, отмечая время с момента добавления восстановительной смеси до появления в растворе синей окраски.
6)На миллиметровой бумаге начертите график зависимости скорости реакции от концентрации йодата натрия. На оси абсцисс отложите в определенном масштабе относительные концентрации йодата натрия, а на оси ординат отвечающие им скорости: V = 1/ , с-1.
7)Запишите выражение закона действующих масс для рассматриваемой реакции, определите ее молекулярность и порядок.
8) На основании проделанных опытов и графика сделайте вывод о зависимости скорости реакции от концентрации йодата натрия. Как согласуются ваши наблюдения с законом действующих масс?
9) Найдите из графика величину константы скорости реакции. На основании этого сделайте вывод: велика или мала скорость данной реакции? Зависит ли константа скорости от концентрации реагирующих веществ?
1.3.2. Опыт 2. Влияние температуры на скорость гомогенной
химической реакции
Порядок проведения опыта и оформление
1)Напишите уравнение реакции.
2)Начертите таблицу 3.

19
|
|
|
|
|
|
Таблица 3 |
|
|
|
|
|
|
|
№ наблю- |
Температура |
Время те- |
Скорость |
Обратная |
Логарифм |
|
дения |
опыта |
чения ре- |
реакции, |
температура, |
скорости, |
|
|
t, оС |
Т, К |
акции, , с |
V = 1/ , с-1 |
103/Т, К- |
lg V, [с-1] |
1 |
t комн. |
|
|
|
|
|
2 |
t комн. + 10 |
|
|
|
|
|
3 |
t комн. + 20 |
|
|
|
|
|
4 |
t комн. + 30 |
|
|
|
|
|
3)Изучение зависимости скорости реакции от температуры проводят в термостате при температурах на 10оС, на 20оС и на 30оС выше комнатной. В качестве термостатов могут служить стаканы с крышками, наполненные дистиллированной водой. В крышках имеются 4 отверстия. В одно из отверстий крышки термостата вставлена коническая пробирка с 2н раствором серной кислоты и опущенной в нее пипеткой. Закрепите термометр во втором отверстии крышки термостата.
4)Изучение зависимости скорости реакции от температуры проводят на примере реакции взаимодействия тиосульфата натрия с серной кислотой (смотри опыт 1а).
В четыре микропробирки поместите по 4 капли раствора Na2S2O3 и 8 капель Н2О (условная концентрация С моль), встряхните пробирки для перемешивания полученного раствора и две пробирки поставьте в термостат, две другие пробирки оставьте на штативе.
5)Первое наблюдение проделайте при комнатной температуре. Отметьте
изапишите в таблицу 3 температуру воды в термостате. Это и будет температура первого наблюдения. Внесите в одну из пробирок одну каплю раствора 2н
H2SO4. Определите и запишите в таблицу 3 время ( ) с момента добавления кислоты до помутнения раствора при комнатной температуре.
6) Поставьте термостат на плитку и нагрейте воду в термостате до температуры на 10оС выше комнатной. Снимите термостат с плитки и сразу внесите во вторую пробирку 1 каплю серной кислоты. При проведении опыта пробирки из термостата не вынимайте. Определите и запишите в таблицу 3 время ( ) с

20
момента добавления кислоты до помутнения раствора при температуре на 10оС
выше комнатной.
7) Замените использованные микропробирки в термостате на пробирки с приготовленным раствором тиосульфата натрия концентрации С моль, находя-
щиеся на штативе. Повторите опыт с раствором тиосульфата и серной кислоты
втермостате, нагрев его до температуры на 20 С выше комнатной и на 30 С
выше комнатной, измеряя время течения реакции в пробирках № 3 и № 4, как и
впервом случае. Данные наблюдений занесите в таблицу 3.
8)Рассчитайте скорости реакции в условных единицах для всех четырех наблюдений (V = 1/ ). На основании опытных данных рассчитайте температур-
ный коэффициент реакции для трех температурных интервалов (γ1-2, γ2-3, γ3-4) и
среднее значение температурного коэффициента (γср = (γ1-2 + γ2-3 + γ3-4) / 3). Как согласуются полученные величины температурного коэффициента с правилом Вант-Гоффа?
9) Начертите график зависимости скорости реакции от температуры в координатах: V (1/ ), с-1 – t, С.
10) Сравните графики в опытах 1а и 2 и ответьте на вопрос: какой из фак-
торов больше влияет на скорость рассматриваемой реакции – температура или концентрация реагирующих веществ?
11)Сформулируйте вывод о зависимости скорости химической реакции от температуры. Как согласуется вид кривой на полученном графике зависимости скорости реакции от температуры с правилом Вант-Гоффа?
12)На основании величин двух последних колонок таблицы 3 постройте график зависимости lg V = f (103/T) (рис. 2). Используя полученный график,
рассчитайте энергию активации по формуле:
Еа = -2,3R · tg β,
где β – угол наклона прямой к оси температур.
13) Рассчитайте энергию активации также по формуле:
Ea = (2,3 R (T2·T1) / (T2 - T1)) · lg (k2/k1)

21
для самой медленной стадии изучаемой реакции взаимодействия тиосульфата
натрия с серной кислотой.
Логарифм скорости, lgV
0
-1
-2
-3
-4
-5
-6
Обратная температура, 1000/T, К-1
Рис. 2. Зависимость lg V от обратной температуры 103/T, K-1
14) Сделайте вывод о скорости реакции.
1.3.3. Опыт 3. Влияние степени смешения реагентов на скорость
гетерогенной химической реакции
В сухой ступке осторожно смешайте (не растирая пестиком) несколько кристалликов нитрата свинца и йодида калия. Происходит ли изменение окрас-
ки? Энергично разотрите в ступке кристаллы пестиком. Что происходит? Из пипетки добавьте к смеси несколько капель воды: смесь моментально окраши-
вается в ярко-желтый цвет. Дайте объяснение проведенному опыту в целом. За-
пишите уравнение реакции.
1.3.4. Опыт 4. Влияние величины поверхности реагирующих веществ
на скорость химической реакции в гетерогенной системе
Горение металлического алюминия
Тигельными щипцами возьмите маленький кусочек алюминиевой фольги и внесите в пламя спиртовки. Отметьте, что горение алюминия не наблюдается.
Внесите в пламя спиртовки мелкий порошок алюминия. Для этого не-
большое его количество возьмите маленькой ложечкой или шпателем и мед-
ленно ссыпьте сверху в пламя спиртовки. Отметьте наблюдаемое явление,
напишите уравнение реакции и сделайте вывод о влиянии величины поверхно-
сти реагирующего вещества на скорость реакции.
