
lec_08-03-01_2014
.pdf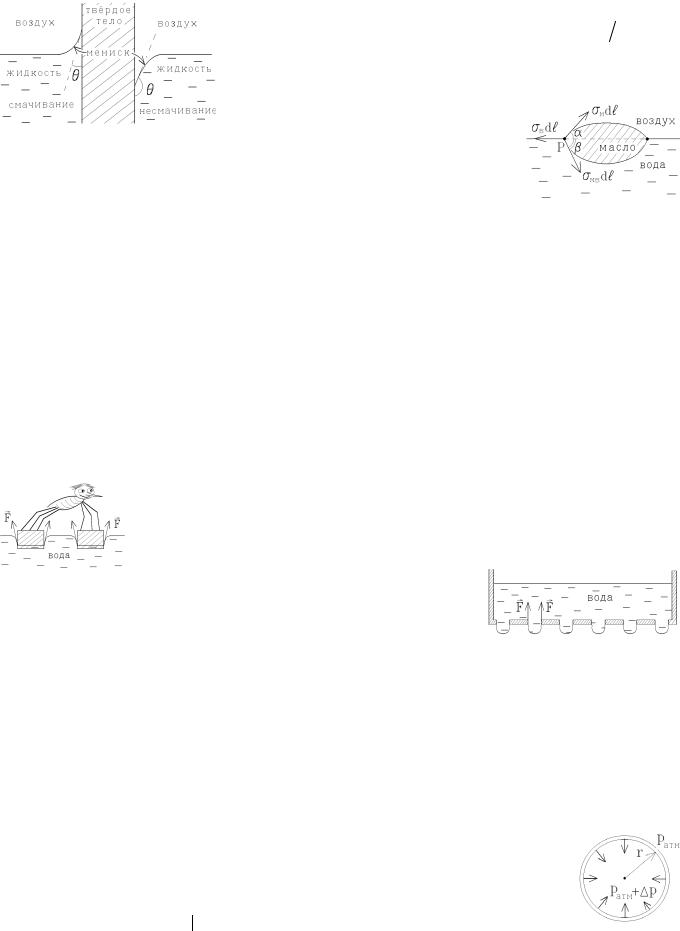
61
виде хлопьев-глобул. Для раствора сахара, наоборот, sраств > sводы , и молекулы сахара вытесняются с поверхности
воды вглубь. Поверхность сладкого чая или кофе в чашке образована чистой, а не сладкой водой.
Можно сделать и другой вывод. Растягивая поверхность жидкости и смещая ее границу на dx, мы совершаем работу против силы поверхностного натяжения и увеличива-
ем площадь поверхности на dS = ldx, т.е. dA |
|
T = sdS = sldx , откуда s = |
|
l - коэффи- |
|
F |
|||
|
|
|
циент поверхностного натяжения численно равен силе поверхностного натяжения, действующей на единицу длины контура, ограничивающего поверхность жидкости. Э силы
стремятся стянуть контур в точку и направлены по касательной к поверхности жидкости. Например, капнем на поверхность воды немного масла, коэффициент поверхно-
стного натяжения sМ которого больше, чем соответствующий коэффициент sВ воды
(а плотность - меньше, так что утонуть капля масла не может. Молекулы масла поразному взаимодействуют с молекулами воздуха и воды. Поэтому коэффициент поверхностного натяжения σ зависит от граничной с жидкостью среды. На границе масло -- воздух он имеет другое значение, чем на границе масло - вода: sМВ ¹ sМ . Выделим в точке P на границе раздела трех сред малый участок границы dl (он направлен перпенди-
кулярно плоскости рисунка). На этот участок действуют силы sВdl, sМ dl и sМВdl , стремящиеся сократить, соответст-
венно, поверхности раздела вода - воздух, масло - воздух и масло - вода. Условием равновесия границы будет равенство нулю равнодействующей этих сил:
sВ = sМ cos a + sМВ cos b ; sМ sin a = sМВ sin b .
Из этих уравнений можно определить углы α и β, т.е. форму плавающей капли. Если sВ > sМ + sМВ , то капля растечет-
ся по всей поверхности воды подобно мыльной пленке.
Молекулы жидкости взаимодействуют не только друг с другом, но и с молекулами твердых тел, граничащих с поверхностью жидкости. В случае притяжения этих молекул край поверхности жидкости изгибается, "наползая" на твердую стенку. Говорят, что жидкость смачивает твердую поверхность. В случае отталкивания молекул (например, на границе воды и парафина) поверхность жидкости изгибается в другую сторону, отдаляясь от твердой поверхности, и наблюдается несмачивание. Угол θ между поверхностью жидкости и поверхностью твердой стенки называется краевым углом. В случае
полного смачивания q = 0o , а при полном несмачивании q = 180o . Изогнутый край поверхности жидкости называется мениском.
Пример: на несмачиваемое тело, плавающее в воде, действуют силы поверхностного натяжения, направленные вверх и стремящиеся сократить изогнутую поверхность воды. Эти силы не позволяют утонуть даже тем небольшим телам, плотность которых больше плотности воды! Так, благодаря силам поверхностного натяжения, бегают по воде и не тонут жуки - водомерки.
По этой же причине можно носить воду в решете с достаточно малым размером отверстий, стенки которых покрыты несмачиваемым ма-
териалом (рис.7.24): на контур, ограничивающий выступающую из отверстия поверхность капли, действует сила поверхностного натяжения, сокращающая поверхность капли, т.е. направленная вверх и предотвращающая вытекание капли. Аналогично, уменьшая диаметр вертикального капилляра, заполненного водой, можно получить висящую на кончике капилляра и не падающую каплю.
Сростом температуры молекулы жидкости расходятся на бó льшие расстояния, силы их притяжения ослабевают,
икоэффициент поверхностного натяжения также будет уменьшаться. При температуре кипения жидкости ее поверхностное натяжение вообще исчезает - молекулы свободно переходят из кипящей жидкости в пар и наоборот.
При увеличении свободной поверхности жидкости она поглощает некоторое тепло. При сокращении поверхности это тепло выделяется. Оно называется скрытой теплотой образования поверхности. Если поверхность уменьшается на
единицу площади, то выделяется теплоQ = -T ¶s .
¶T
13.5. Капиллярные явления. Формула Лапласа. Осмос
Стремясь сократиться, искривленная поверхность жидкости давит на молекулы внутри жидкости, т.е. создает избыточное давление p . Чтобы найти величину этого давления, рассмот-
рим мыльный пузырь радиуса r с поверхностным натяжением σ. Снаружи пузыря давление воздуха равно атмосферному, а внутри (из-за сдавливания мыльной пленки) оно возрастает на p .
При изотермическом увеличении радиуса пузыря на dr расширяющийся
внутри воздух совершит работу\ dA T = Dp × 4pr2dr . Эта работа затрачивается на увеличение сво-
62
бодной поверхностной энергии двух поверхностей мыльной пленки:
dA T = dFпов = 2 ×s 4p(r + dr )2 - 4pr2 dr = 16psrdr , откуда Dp = 4s r . Одна искривленная поверхность создаст вдвое
r . Одна искривленная поверхность создаст вдвое
меньшее давление. Произвольно изогнутая двумерная поверхность характеризуется двумя главными радиусами кривизны R1 и R2 . Под такой искривленной поверхностью давление внутри жидкости возрастает на величину
|
1 |
|
1 |
|
|
|
Dp = s |
|
+ |
|
|
- это формула Лапласа. |
|
R1 |
R2 |
|||||
|
|
|
|
Для сферической поверхности мыльного R1 = R2 = r и Dp = 2s r . Но при другой форме мыльной пленки, например - ме-
r . Но при другой форме мыльной пленки, например - ме-
жду двумя кольцами, с обеих сторон пленки давление равно атмосферному, и Dp = s(1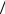 R1 +1 R2 ) = 0 . Пленка примет вид катеноида
R1 +1 R2 ) = 0 . Пленка примет вид катеноида
- выпукло - вогнутой поверхности, для которой один главный радиус кривизны положителен, а другой - отрицателен, так что в любой точке пленки R1 = - R2 .
Рассмотрим теперь тонкий вертикальный открытый капилляр, опущенный в жидкость. Если стенки капилляра не смачиваются жидкостью, то ее поверхность будет выпуклой.
Столбик жидкости в капилляре опустится на высоту h так, чтобы уменьшение гидростатического давления уравновесило лапласовское увеличение давления: Dp = rgh , где ρ − плотность жидкости.
Если же жидкость смачивает стенки капилляра, то форма ее поверхности вогнута, радиусы кривизны отрицательны и давление жидкости под вогнутой поверхностью уменьшается на величину p . Чтобы скомпенсировать уменьшение давления,
столбик жидкости поднимается в капилляре на высоту rgh = Dp . В случае полного смачивания R1 = R2 = r (радиус капилляра), и высота подъема жидкости h = 2s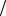 (rgr ) .
(rgr ) .
Капиллярные явления очень часто встречаются в природе. Так, ручка пишет из-за того, что чернила втягиваются лапласовским давлением к кончику пера. Влага поднимается из почвы в ствол растения по капиллярам древесных волокон и т.п. Или, например, две соринки или два пузырька , плавающие на поверхности воды, стремятся сблизиться, сцепиться друг с другом.
Действительно, при сближении на малое расстояние вода поднимается в узком зазоре между пузырьками, как по капилляру. Давление под вогнутой поверхностью жидкости уменьшается на величину p , а с противоположных сторон на пузырьки действуют силы атмосферного давления, подталкивающие их друг к
другу.
По аналогичной причине трудно растянуть две плоские стеклянные пластинки, между которыми попал тонкий слой воды: давление в воде меньше атмосферного, и избыточное давление прижимает пластинки друг к другу.
Но радиус капли в древесных волокнах не может быть r » 10−6 м , иначе
вязкость воды не позволит ей течь по капилляру (как это следует из формулы Пуазейля. В таком случае капиллярное давление
позволяет воде подняться только до высоты h = 2sводы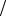 (rgr ) » 10 м . Каким же образом
(rgr ) » 10 м . Каким же образом
вода поднимается в кроны более высоких деревьев?
Действует другое физическое явление – осмос. Как и многие другие биологические ткани, стенки растительных волокон являются полунепроницаемыми мембранами. Они свободно пропускают в обе стороны молекулы воды. Поэтому парциальное давление воды по обе стороны стенки будет одинаковым. Но молекулы растворенных в воде солей не пропускаются такой мембраной и задерживаются внутри волокна. Давление внутри волокна будет значительно выше, чем у чистой воды, поскольку, помимо молекул воды, это давление создают молекулы растворенных веществ. Разность давлений раствора внутри мембраны и растворителя (чистой воды) вне мембраны называется осмотическим давлением. Его величина в растительных волокнах достигает нескольких атмосфер, и за счет этого давления раствор может подняться к кронам самых высоких деревьев.
13.6. Упругие деформации и напряжения. Закон Гука. Пластические деформации. Предел прочности.
Реальная твердая среда, как аморфная, так и кристаллическая, также меняет свою форму и размер под действием внешней нагрузки, т.е. деформируется. Простейшая деформация происходит при сжатии или растяжении вдоль оси
63
симметрии тела и характеризуется нормальным напряжением sн - это скалярная
величина, равная отношению приложенной к деформируемому участку среды нормальной или “ растягивающей” силе к площади поперечного сечения S: sн = Fn / S (см. рисунок, где S = pd 2 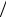 4 ).
4 ).
Если sн > 0 , то тело растягивают, сли sн < 0 - сжимают. Измеряют на-
пряжение в паскалях. При такой деформации меняется не только продольный размер телаl ® l + Dl , но и его поперечный размер d ® d + Dd , и объем V → V + V . Вводят величину относительного удлинения e = Dl l , относительного попе-
l , относительного попе-
речного сжатия Dd d и относительного изменения объёма DV
d и относительного изменения объёма DV  V . Если прилагаемые силы Fn и относительные дефор-
V . Если прилагаемые силы Fn и относительные дефор-
мации не слишком велики, то действует закон Гука:
s = Еe = E × Dl l
т.е.удлинение или сжатие пропорционально прилагаемой нагрузке. Коэффициент Е называется модулем упругости или модулем Юнга, его величина зависит от физических параметров деформируемой среды. При этом поперечное сжатие определяется как Dd d = -me , где μ − коэффициент Пуассона, а изменение объема DV
d = -me , где μ − коэффициент Пуассона, а изменение объема DV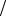 V = (1 - 2m) e .
V = (1 - 2m) e .
Как видно из графика зависимости прилагаемого напряжения от величины относительного удлинения, одобные небольшие деформации обратимы на участке 0А, где действует закон Гука. После снятия внешней нагрузки размеры тела возвращаются к прежним значениям (e = 0) . Затем до точки В – границы текучести (на участке АВ)
закон Гука нарушен, и тело продолжает удлиняться с ростом напряжения медленнее, деформации слишком велики. Если теперь убрать нагрузку, то тело останется деформированным (сохранится остаточное удлинение eост ). Такие деформации называются
пластическими – тело под воздействием нагрузки плавно меняет форму и размеры, не разрушаясь.
После достижения границы текучести В (на участке ВС) среда “ течет”, увеличивает размер без изменения величины нагрузки, а в точке С, которая называется пределом прочности, тело разрушается.
|
Кроме нормальных напряжений, существуют касательные напряжения tн , где |
||
tн = Fτ / S , |
Fτ - касательная или ” скалывающая” сила, направленная вдоль поверхности де- |
||
формируемого тела S и вызывающая сдвиг деформированного тела на угол α. Если этот угол |
|||
мал, то действует закон Гука для касательных, сдвиговых деформаций: |
|||
|
|
tн = G × tg a G × a , |
|
где G – |
модуль сдвига, который, как и tн измеряется в паскалях. Для изотропного твердого |
||
тела, свойства которого одинаковы по всем направлениям имеется связь: |
G = E ×(1 + m) / 2 . |
||
|
|
|
|
Если среда не изотропна и на выделенную площадку DS (вектор площади направлен по |
|||
|
|
|
|
нормали n к площадке) действует сила DF , то вводят вектор напряжений t , равный отношению |
|||
|
|
|
|
этой силы к величине площади: t |
= DF / DS . Непараллельные векторы t |
и n связывают матрич- |
|
ным умножением с помощью тензора напряжений sij , где i, j = x, y, z :
t |
|
sxx |
|
x |
|
ty |
= syx |
|
|
|
|
|
||
tz |
szx |
|
sxy
syy
szy
sxz |
|
n |
|
|
|
|
x |
syz |
× ny . В случае невязких жидкостей или газов давление изотропно передается по всем направ- |
||
|
|
|
|
|
|
||
szz |
nz |
||
лениям одинаково и тензор напряжений превращается в единичную матрицу умноженную на величину давления: t = DF / DS = p × n .
14. ФАЗОВЫЕ ПРЕВРАЩЕНИЯ 14.1. Термодинамические фазы и компоненты. Условие равновесия фаз
Любой однородный по своим физическим свойствам участок сложной термодинамической системы называется термодинамической фазой. Фазой может быть опреде Фазы могут отличаться любыми другими свойствами. Например, углерод в твёрдом состоянии образует либо кристаллическую решётку графита, либо алмаза, т.е. разные кристаллические фазы. Одна и и та же кристаллическая решётка железа при разных температурах ведёт себя или как ферромагнетик, или как парамагнетик, т.е. различается магнитными свойствами и образует разные фазы.
Фаза может состоять из различных компонентов, т.е. молекул или атомов разного сорта. Например, воздух (одна газообразная фаза) является смесью многих газов; разбавленный спирт будет однородным раствором (жидкой фазой) из разных молекул. Однако, сплав двух металлов не образует однородную фазу: он состоит из перемешанных мелких кристалликов (зёрен) этих металлов и является сложной комбинацией двух фаз, двух различных кристаллических решёток.
Рассмотрим сложную термодинамическую систему, состоящую из n компонентов (молекул разного сорта), которые образуют m разных фаз. Примером будет перенасыщенный раствор поваренной соли, над которым, отводя поршень П, создают атмосферу из водяного пара. Здесь n = 2 (молекулы Н2О и NaCl), а m = 3 (газообразная, жидкая и
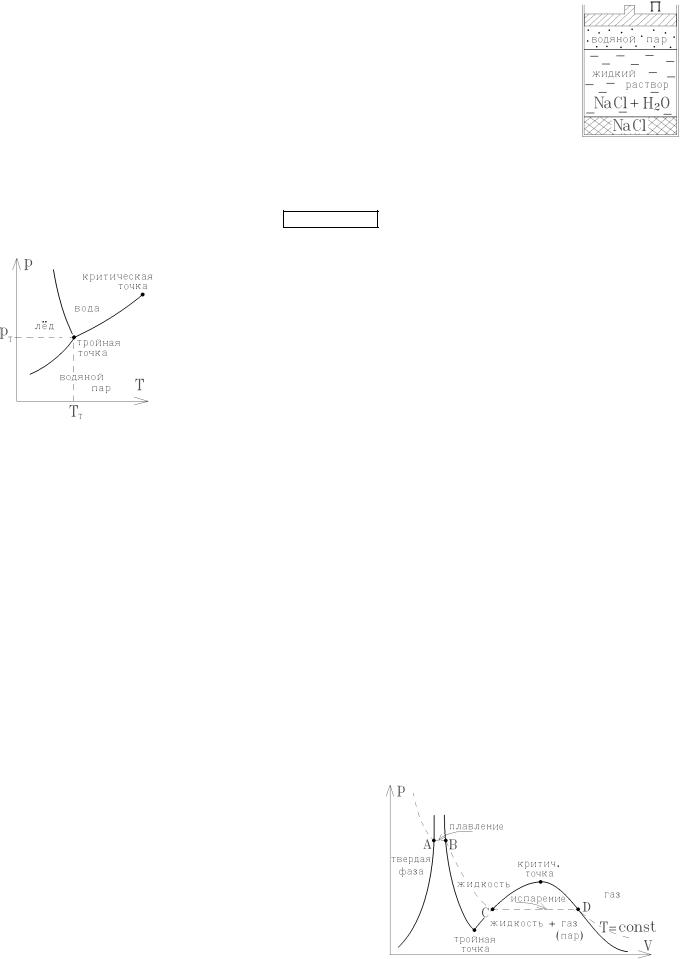
64
твёрдая фазы). Общим свойством всех термодинамических систем является переход части молекул из одной фазы в другую при изменении термодинамических параметров. Так, при нагревании системы, изображённой на рисунке, часть воды испарится, увеличивая газообразную фазу, а избыточные молекулы NaCl перейдут в кристаллическую твердую фазу.
Любая термодинамическая система, в том числе многофазная, стремится самопроизвольно перейти в равновесное состояние. Это происходит в результате совместного действия механических сил, уменьшающих энергию системы, и энтропийных сил, увеличивающих её энтропию. Поэтому Гиббс сформулировал условие термодинамического равновесия следующим образом:
если система уже находится в равновесном (устойчивом) состоянии, то любые процессы, не меняющие энтропию, могут только увеличить внутреннюю энергию системы dU ³ 0 , а любые процессы, не меняющие её энергию, могут только уменьшить энтропию системы dS £ 0 .
Количество существующих фаз m не может быть любым в любой сложной термодинамической системе, состоящей из n разных сортов молекул (компонентов) и находящейся в термодинамическом равновесии. Такая система должна описываться I = 2 + n - m независимо меняющимися термодинамическими параметрами. Ясно, что
I = 2 + n - m ³ 0 .
Это – правило фаз Гиббса, связывающее число возможных фаз в системе с числом составляющих её компонентов. Для примера рассмотрим однокомпонентную систему (чистое химическое
вещество из молекул одного сорта, например, вода). Для неё I = 3-m. При определённых условиях система становится однофазной m=1. Так, при высокой температуре вся вода превращается в пар (газ). Состояние газа описывается I=2 независимыми параметрами: давлением p и температурой T.
При более низких температурах однокомпонентная система может находиться в равновесии в двухфазном состоянии (m=2: лёд - вода, вода - пар или лёд - пар). В этом состоянии I=3-2=1, и переменные p и T связаны некоторым соотношением p=p(T). На диаграмме состояний, показанной на рисунке, видно, что двухфазное состояние осуществляется только на трёх кривых p=p(T), разделяющих твёрдую, жидкую и газообразную фазы.
Наконец, если в равновесии сосуществуют три фазы однокомпонентной системы, то I=0, т.е. все термодинамические параметры в этом состоянии фиксированы и не могут изменяться без того, чтобы хотя бы одна из фаз исчезла. Это состояние единственно и называется тройной точкой. Для чистой воды в тройной
точке Tт ≈ 0, 0078о С , рт ≈ 6 Па . Только при таких условиях лёд, вода и пар одновременно находятся в устойчивом
состоянии.
Реальные многокомпонентные среды состоят из огромного числа молекул или атомов различных сортов. Поэтому в них может сосуществовать в равновесии очень большое число разных фаз.
14.2. Фазовые переходы первого рода
Фазовым переходом называется процесс, при котором объем одной фазы растёт за счет уменьшения объёма другой, т.е. одна фаза вещества теряет молекулы, которые переходят в другую фазу.
Превращение твердой фазы в жидкую называется плавлением (обратный процесс - отвердеванием или кристаллизацией); превращение жидкой фазы в газообразную называется испарением (обратный процесс - конденсацией); превращение твердой фазы в газообразную называется возгонкой (обратный процесс - сублимацией). Все перечисленные здесь процессы сопровождаются выделением (или поглощением) тепла, которое называется скрытой теплотой фазового перехода. Переходы с выделением или поглощением скрытой теплоты называются фазовыми переходами первого рода. Теплоёмкость системы при этом меняется скачком.
Существуют также фазовые переходы, при которых тепло не выделяется и теплоемкость не меняется. Это - фазовые переходы второго рода. Примерами таких переходов будут: изменение типа кристаллической решетки твердого тела, переход металлов в сверхпроводящее состояние, превращение ферромагнетика в парамагнетик при нагревании и т.п.
Температура, при которой происходят фазовые переходы 2-го рода, называется температурой Кюри. Фазовые переходы первого рода, такие как плавление,
испарение или возгонка, происходят при постоянных давлении p и температуре T. На фазовой диаграмме p-V им соответствуют горизонтальные участки изотерм Известно, что при понижении давления жидкость начинает кипеть при меньшей температуре. Например, уже на высоте 1 км температура кипения воды
уменьшается на to = 3o C . Кипение (испарение) жидкости при
уменьшении давления начинается в точке C (см.диаграмму). Тепловая энергия, сообщаемая системе, расходуется на разрыв связей между молекулами, т.е. на превращение жидкости в газ (пар).
Полностью в пар жидкость превратится в точке D. На горизонтальном участке C-D система находится в двухфазном состоянии (жидкость + пар). Тепло, необходимое для превращения еди-

65
ницы массы жидкости в пар, называется удельной теплотой парообразования q.
Пример: пар от кипящей жидкости обжигает сильнее, чем кипяток, так как при его конденсации должна выделиться вся скрытая теплота парообразования. Для воды q = 2250 кДж/кг и легко вычислить, что при попадании на ладонь
1 г пара выделится такая же теплота, как при попадании 9,5 г кипятка.
Участок A-B на диаграмме состояний соответствует другому фазовому переходу - плавлению. На этом участке система также находится в двухфазном равновесном состоянии (твердая фаза + жидкость).
Можно изобразить изотерму на другой фазовой диаграмме p-T. На ней участки C-D и A-B превращаются в точки, лежащие на кривых p=p(T) раздела двух фаз. Но приведенные здесь фазовые диаграммы изображены для нормальных веществ, у которых температура плавления увеличивается с ростом давления. Однако существуют аномальные вещества, для которых температура плавления уменьшается с ростом давления.
К таким аномальным веществам относится вода. Пример: кромка лезвия конька соз-
дает очень большое дополнительное давление на микронеровности льда,
p ≈ 400 ÷ 500 атмосфер. При таком дав-
лении лед начинает плавиться при более низких, минусовых температурах, и образуется тонкий слой воды - "смазки", обеспечивающий скольжение конька.
По этой причине нельзя кататься на коньках по замерзшим нормальным веществам - с ростом давления жидкая прослойка не образуется, и из-за большой силы трения конек не скользит (попробуйте
прокатиться на коньках по твердой асфальтовой поверхности). Заметим, что скольжения лыж добиваются другим способом при трении лыжи о снег выделяется тепло, благодаря которому снег подтаивает и образуется тонкий слой "смазки" - воды. Для лучшего скольжения надо, чтобы это тепло не отводилось, поэтому лыжи делают из плохо проводящего тепло материала (дерево), а не из металла, как коньки.
Заледеневшие дороги посыпают песком, и если минусовая температура не очень низка, то при надавливании на песчинки лёд под ними из-за дополнительного давления плавится, и песчинки вмерзают в лёд, создавая шероховатую поверхность. Но при очень сильном морозе использовать песок бесполезно – точка плавления достигнута не будет, и песок будет скользить по льду вместе с подошвой обуви. То же самое касается специальных шин с шипами, используемых для автомобилей.
Уравнение кривой раздела двух фаз на фазовой диаграмме определяется уравнением Клапейрона-Клаузиуса, позволяющим найти зависимость температуры T фазового перехода от величины давления p:
|
|
dp |
q |
|
|
|
|
||||
|
|
|
= |
|
|
|
|
|
, |
|
|
|
|
dT |
T (v |
2 |
− v ) |
||||||
|
|
|
|
|
|
|
1 |
|
|
|
|
где удельные объемы v1 = 1 ρ1 и v2 = 1 ρ2 – |
|
это объемы, заполняемые единицей мас- |
|||||||||
сы вещества в состоянии 1-й и 2- фазы соответственно. Заметим, что удельная теплота |
|||||||||||
фазового перехода q зависит от температуры T. Так, температурная зависимость |
|||||||||||
удельной теплоты парообразования воды показана на рисунке справа. Из уравнения |
|||||||||||
|
|
|
|
|
dp |
|
|
|
|
qплавления |
|
Клапейрона - Клаузиуса следует, что, что |
|
= |
|
< 0 , так как |
|||||||
dT |
T (1 ρводы −1 ρльда ) |
||||||||||
ρльда ≈ 916 кг/м3 < ρводы ≈ 1000 кг/м3 , т.е вода – аномальное вещество.
Аномальные свойства воды сохраняются и для жидкой фазы - её плотность при нагревании выше 0о С продолжает увеличиваться и достигает максимума ρводы max = 1000 кг/м3 при to = +4o C (в точке плавления, при 0о С , плот-
ность воды чуть меньше: ρводы 0o C = 999,8 кг/м3 ). Различие очень небольшое, но существенное - более нагретая и тяжё-
лая вода опускается на дно, а холодная поднимается на поверхность. Поэтому лед образуется только на поверхности рек и озер, а так как теплопроводность льда мала, то он служит тепловой изоляцией между водой и холодным воздухом. У
дна водоёмов, куда опускается самая плотная вода, её температура даже зимой остается равной +4o C . Если бы вода бы-
ла нормальным веществом, то температура ее плавления была бы равна −95o C , а температура кипения −80o C . При этом исчезла бы практически вся существующая биосфера Земли.
14.3. Процессы испарения и конденсации. Центры конденсации
Пар над жидкостью образуется при низких температурах, т.е. процесс испарения
может происходить при температурах, значите льно мèньших температуры кипения жидкости. Если над поверхностью жидкости создать вакуум, она мгновенно начнет испаряться до тех пор, пока не установится равновесии между жидкостью и образовавшимся паром: число молекул, отрывающихся от поверхности жидкости, будет равно числу молекул, возвращающихся в жидкость из пара. Такой пар называется насыщенным.
Для равновесной системы процесс испарения (конденсации) описывается уравнением

66
Клапейрона -- Клаузиуса, связывающим давление рн насыщенного пара с температурой системы:
dp |
= |
qиспарения |
> 0 , так как 1 rпара 1 rжидкости . |
|
н |
|
|||
dT |
T ×1 rн пара |
|||
|
|
Из этого уравнения следует, что пар будет существовать над жидкостью при любой ее температуре, вплоть до температуры замерзания. Давление (и плотность) пара уменьшаются при уменьшении температуры. Ниже температуры замерзания пар будет существовать над замерзшей твердой фазой (процесс возгонки).
Но реальная термодинамическая система воздух - жидкость многокомпонентна, а в такой системе условия равновесия фаз допускают сосуществование жидкой и газообразной фаз при одном атмосферном давлении и разных температурах. В уравнение Клапейрона -Клаузиуса, описывающее процесс испарения жидкости в воздушной среде, входит парциальное давление насыщенного пара - част атмосферного давления, являющегося суммой парциальных давлений всех составляющих атмосферу газов.
Если первоначально в воздухе отсутствуют пары жидкости, например, воды, то жидкость будет вести себя в воздушной атмосфере так же, как и в вакууме, т.е. начнёт испаряться до тех пор, пока её пар не станет насыщенным. При ком-
натной температуре +20o C парциальное давление насыщенного водяного пара в воздухе мало: pн Н2О 20o C
но по мере увеличения температуры это давление (т.е. доля молекул H2O в окружающем жидкость воздухе) растёт и, согласно уравнению Клапейрона -- Клаузиуса, при темпера-
туре +100o C достигает атмосферного давления pн Н2О 100o C = 1 атм . Газообразная фаза вблизи от поверхности кипящей при воды +100o C состоит только из молекул водяного
пара.
Если сосуд с нагреваемой жидкостью сообщается с атмосферой, то в момент, когда давление её насыщенного пара сравняется с атмосферным, начинается процесс бурного испарения жидкости, который называют кипением. Давление пара при дальнейшем нагре-
вании остается равным атмосферному и увеличиться не может, а потому не может возрасти и температура кипящей жидкости. Именно эту температуру, выше которой жидкая фаза существовать не может, называют температурой кипения.
Подставляя плотность пара из уравнения состояния идеального газа rн = pmH2O / RT в уравнение Клапейрона -
Клаузиуса и интегрируя это уравнение, находим
p dp |
|
qmH O T |
dT |
|
1 |
|
|
R |
|
p |
−1 |
|
||||
∫ |
|
= |
|
2 |
∫ |
|
|
, откуда T = |
|
- |
|
|
ln |
|
|
, гдеT = 373Kтемпература кипения воды при 1 атм, а удельная |
p |
R |
|
|
|
|
|
|
p |
||||||||
|
|
|
2 |
T qm |
H2O |
|
|
0 |
||||||||
p0 |
|
|
|
|
T0 T |
|
|
0 |
|
|
0 |
|
|
|||
теплота парообразования воды q=2250 кДж/кг. Но с высотой, например, атмосферное давление уменьшается согласно барометрической формуле: p = p0 exp(-h / 8) , где p0 = 1атм , а h выражено в километрах, и на высоте h = 7 км из полу-
ченной формулы следует, что вода будет кипеть уже при +77o C (в вакууме, где p=0, любая жидкость закипает уже при
Т=0 К).
С другой стороны, нагревая воду в закрытом сосуде (с предохранительным клапаном!), можно добиться высокой температуры кипения. Так, при р = 2 атм давлении вода будет кипеть уже при температуре +212o C . Но при открывании
крышки сосуда резкое падение давления до р = 1 атм и ниже приводит к тому, что жидкость оказывается сильно перегретой и вскипает во всём объёме, а содержимое сосуда разлетается из-за взрывного испарения.
В очень узком слое вблизи поверхности жидкости давление пара практически равно давлению pн насыщенного пара (установление локального равновесия), и поэтому к процессу испарения или кипения жидкости можно применять полученное выше уравнение Клапейрона -Клаузиуса. Но вдали от жидкости концентрация молекул пара мала, и парциальное давление pпара пара меньше величины pн. Такой пар называется ненасыщенным. Чтобы описать содержание пара
в воздушной атмосфере, вводят
понятие относительной влажности атмосферы - это отношение упругости (парциального давления) pпара водяного пара к упругости pн. насыщенного водяного пара при данной температуре, т.е. величина f = ( pпара 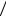 рн )×100% . Абсолютной влажностью атмосферы называется плотность rпара
рн )×100% . Абсолютной влажностью атмосферы называется плотность rпара
водяного пара в ней. Показанная на рисунке система неравновесна. В ней возникают потоки молекул пара, и объём жидкости уменьшается до тех пор, пока во всех точках не установится равновесие (пар всюду станет насыщенным), либо до полного испарения жидкости.
Невозможно поднять температуру жидкости и окружающих её тел выше температуры кипения жидкости. Температуру и давление пара над кипящей жидкостью также увеличить нельзя. Это свойство называется абляцией.
Так спускаемые на Землю космические аппараты покрывали специальным абляционным слоем из вещества

67
с относительно невысокой температурой кипения Tк. Эти аппараты движутся с такой же скоростью, как и метеориты, и при входе в атмосферу Земли должны разрушаться и сгорать. Но на спускаемом аппарате кипит и испаряется абляционный слой, и до тех пор, пока он полностью не испарится, температура внешней поверхности аппарата не превысит Tк.По той же причине можно поставить чайник с водой на плиту с любой, как угодно высокой температурой. Пока вода не выкипит, температура чайника практически равна температуре воды.
До сих пор мы рассматривали испарение молекул с плоской поверхности жид-
кости. Если учесть искривление этой поверхности, то из рисунка видно, что результи-
рующая межмолекулярных сил Fрез , стремящаяся втянуть молекулу вглубь жидкости,
должна быть больше для молекулы A, находящейся на выпуклой поверхности, чем для
молекулы B во впадине. Молекуле B легче оторваться от жидкости, чем молекуле A. Жидкость сильнее испаряется в тех точках, где ее поверхность вогнута, и слабее в тех
точках, где поверхность выпукла. Как установил Кельвин, давление насыщенного пара вблизи вогнутой поверхности жидкости уменьшается по сравнению с давлением насыщенного пара над плоской поверхностью жидкости на величину
Dpн = |
srпара |
|
1 |
+ |
1 |
|
|
|
|
|
|
|
(формула Кельвина), |
||
|
|
|
|||||
|
rжидкости - rпара |
R1 |
|
R2 |
|
||
где σ – коэффициент поверхностного натяжения, R1 и R2 – |
главные радиусы кривизны поверхности. Над выпуклой по- |
||||||
верхностью жидкости давление насыщенного пара возрастает на ту же величину Dpн .
Рассмотрим начало процесса кипения жидкости. При температуре кипения давление образующегося пара pпара равно давлению жидкости pжидк . Но внутри возникающего пузырька
пара, окружённого вогнутой поверхностью жидкости, давление насыщенного пара меньше на величину Dpн . Пар внутри пузырька будет пересыщенным, так как его давление pпара = pжидк
больше, чем давление насыщенного пара pжидк - Dpн . Эта система неравновесна: в жидкость возвращается больше молекул, чем из нее испаряется. При малом радиусе r пузырька Dpн вели-
ко, и возникающий пузырек пара немедленно исчезает, конденсируясь обратно в жидкость. Вода не хочет закипать. При атмосферном давлении она остается жидкостью при температуре выше температуры кипения!
Такая жидкость называется перегретой (см. участок AB на фазовой диаграмме). Дистиллированную воду в открытом со-
суде с очень гладкими стенками можно при давлении 1 атм нагреть до +200o C .
Однако вблизи плоской поверхности перегретой жидкости вместе с температурой T должно расти и давление pн
насыщенного пара, а вместе с ним по формуле Кельвина растет давление pн - Dpн = pн - 2srпара 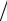 r (rжидкости - rпара )
r (rжидкости - rпара )
насыщенного пара внутри пузырька. Как только это давлении превысит давление жидкости pжидк 1 атм , пар с давле-
нием pпара = pжидк внутри пузырька станет ненасыщенным, жидкость будет продолжать испаряться, а пузырек пара расти. По тойже причине чтобы внутри закипающей жидкости образовались и начали расти пузырьки пара, они должны
иметь конечный размер r > rп = |
2srпара |
, где величина давления насыщенного пара pн |
опре- |
|
( pн - pжидкости )(rжидкости - rпара ) |
||||
|
|
|
деляется из уравнения Клапейрона-Клаузиуса.
Такие пузырьки возникают вокруг центров парообразования, т.е. песчинок, неровностей дна и стенок, любых частиц примеси с размером ³ rп Размер этих посторонних частиц мал. Перегрев жидкости обычно также незначителен -
при размерах центров парообразования rп » 1 мкм вода вокруг них начнет кипеть при нагревании до +100, 5o C . Так как
чайник, например, нагревается через дно, то перегрев воды начинается вблизи микронеровностей дна и осажденных на дно частиц, где и возникают пузырьки пара.
Если в нагретую до температуры кипения жидкость высыпать мелко истолченный порошок (например, соль), то жидкость начнет бурно вскипать вблизи частиц порошка, т.е. во всем объеме. Отрываясь, микропузырьки пара поднимаются вверх и попадают в вышележащие слои жидкости с чуть меньшей температурой. Давление насыщенного пара опять становится меньшим, чем давление жидкости, пар конденсируется, и пузырьки исчезают. При схлопывании пу-
зырьков возникают колебания частиц жидкости, которые порождают звуковые волны. Закипающий чайник начинает шуметь, причем шум возникает задолго до начала кипения.
Теперь рассмотрим свойства пара, содержащегося в воздухе. Влажный воздух легче сухого (сравните молярную массу сухого воздуха mвозд = 29 г/моль и водяного пара mН2O = 18 г/моль . Поэтому образующийся при испарении водяной пар все время поднимается в верхние слои атмосферы и в реальных условиях будет ненасыщенным даже над водоёмами. Относительная влажность воздуха обычно меньше 100%. При уменьшении температуры T будет уменьшаться давление pн насыщенного пара, и при некоторой температуре Tp , которая называется точкой росы, это давление срав-
нивается с парциальным давлением пара, находящегося в атмосфере. В точке росы пар становится насыщенным и при температуре ниже Tp конденсируется в капли воды.
Однако вблизи выпуклой поверхности крохотной капли давление насыщенного пара должносогласно формуле
68
Кельвина возрасти до величины pн + pн . Пар с давлением pпара = pн (Tp ) , который в точке росы
был насыщенным вблизи плоской поверхности жидкости, является ненасыщенным вблизи выпуклой капли, и капля немедленно испарится. Пар будет охлаждаться ниже точки росы, не конденсируясь в жидкость, т.е. будет переохлажденным (участок DE на фазовых диаграммах).
При переохлаждении пара (T < Tp ) давление pн еще уменьшится. Если в воздухе имеют-
ся центры конденсации (пылинки, частички сажи, бактерии, электрически заряженные ионы и т.п.),
то вокруг них могут образоваться капли с таким конечным радиусом r, вблизи которых давление насыщенного пара при температуре T < Tp , которое согласно формуле Кельвина равно pн + pн = pн + 2σρпара  r (ρжидкости − ρпара ) , станет меньше действительного давления пара $ pпара = pн (Tp ) . Такой пар будет пересыщенным и начнет конденсироваться,
r (ρжидкости − ρпара ) , станет меньше действительного давления пара $ pпара = pн (Tp ) . Такой пар будет пересыщенным и начнет конденсироваться,
образуя туман (дым, облака). Т.е. для начала конденсации пара необходимо присутствие в воздухе центров конденсации.
Опускаясь вниз, капельки тумана попадают в более нагретые слои воздуха, испаряются, и пар снова поднимается вверх. Поэтому крошечные капельки воды и кристаллики льда, оразующие облака, висят на большой высоте, и только сливаясь вместе и не успевая испариться, попадают на землю в виде дождя.
Пример: инверсионные следы, остающиеся за самолетами, летящими в безоблачном небе. За самолетом образуется участок с низким давлением, который быстро (адиабатически расширяясь) заполняет окружающий воздух. При этом он охлаждается ниже точки росы, и содержащийся в нём пар конденсируется на вылетающих частичках сгоревшего топлива. Так как процесс образования капелек за-
нимает конечное время, то туман возникает на некотором удалении от летящего самолета. Аналогичный след (облачко тумана) образуется над
охлажденной открытой бутылкой насыщенного газом напитка: выходя, сжатый газ, расширяется, охлаждается, и влага в нём конденсируется в микроскопические капельки.
Напомним, что процессы испарения и конденсации сопровождаются поглощением или выделением большой скрытой теплоты парообразования. В качестве примера использования скрытой теплоты парообразования можно рассмотреть систему парового отопления, предложенную Кином (1918 г.). Радиатор в ней соединен с источником тепла единственной трубой, по которой поступает нагретый пар. Конденсируясь, он отдает тепло, а образовавшаяся вода стекает по той же трубе в нагреватель, где снова превращается в пар.
14.4. Процессы плавления и отвердевания. Центры кристаллизации
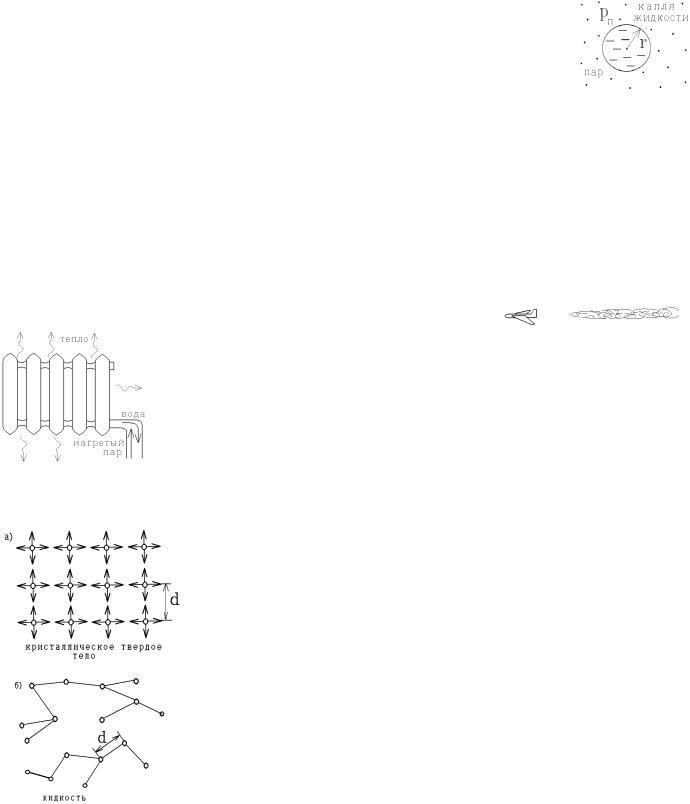
В кристаллическом твердом теле атомы упорядочены в жесткую
кристаллическую решетку и |
совершают тепловые колебания вблизи ее узлов |
(рисунок а). Расстояние d между узлами соответствует минимуму потенциальной |
|
энергии взаимодействия Uвз |
двух соседних атомов. Соответствующие этой энергии |
силы притяжения связывают атомы друг с другом. |
|
При нагревании твердого тела увеличивается амплитуда тепловых колеба- |
|
ний атомов, но межатомные связи сохраняются. Только при достижении определен- |
|
ной температуры плавления Tплавления они начинают разрываться. Вся поступающая теплота при этом идет не на нагревание вещества, а на разрыв межатомных связей, т.е. превращается в скрытую теплоту плавления q. При неизменной температуре Tплавления в твердом теле образуются участки жидкой фазы, которые постоянно разрастаются, до тех пор, пока все твердое тело не превратится в жидкость. Только после этого температура снова начнет расти. При неизменной температуре фазового перехо-
да Tплавления сосуществуют твердая и жидкая фазы.
В жидкостях часть межатомных связей разорвана, но оставшиеся связи, попрежнему, объединяют атомы в большие комплексы (рисунок б). Атомы с легкостью переходят из одного комплекса в другой, т.е. жидкость легко деформируется, течет. Но сохранившиеся связи не позволяют атомам разлететься, и плотность жидкости не
слишком отличается от плотности твердого тела.
При охлаждении жидкости до температуры Tплавления начинается обратный процесс. В жидкости присутствуют центры кристаллизации - посторонние частицы твердой примеси, загрязнения. Вокруг них появляются зародыши кристаллической решетки и эти участки начинают расти. Идет процесс кристаллизации - объем жидкой фазы уменьшается, а твердой кристаллической фазы растет при неизменной температуре Tплавления . При кристаллизации выделяется скрытая теплота q.
Если жидкость очень чистая и в ней отсутствуют посторонние частицы (центры кристаллизации), то ее можно охладить ниже температуры Tплавления . Такая жидкая фаза будет переохлажденной. Это состояние нестабильно или внутренне неравновесно - при малейшем возмущении переохлажденная жидкость кристаллизуется, превращаясь в однофазную твердую среду. Переохлажденная жидкость имеет малую текучесть.

69
15. ЭЛЕКТРОСТАТИЧЕСКОЕ ПОЛЕ В ВАКУУМЕ.
15.1. Поле покоящегося точечного заряда. Напряженность и потенциал поля. Принцип суперпозиции. Поле системы покоящихся зарядов. Сила Кулона
Электрическое поле возникает вокруг тел, имеющих электрический заряд. Действительно, каждое заряженное тело окружено "облаком" непрерывно испускаемых и поглощаемых виртуальных частиц (виртуальных фотонов). Возникают эти частицы в соответствии с законами квантовой физики, и образуемое ими "облако" проявляется в в виде электромагнитного поля, позволяющего заряженным частицам взаимодействовать на расстоянии. Заряженные тела взаимодействуют на расстоянии, обмениваясь виртуальными фотонами, переносящими энергию Е и импульс p от одной заря-
женной частицы к другой, как показано на рисунке.
Вначале мы рассмотрим свойства покоящихся зарядов, между которыми действуют только электрические силы. Электрическое поле, созданное системой покоящихся зарядов, называется электростатическим полем.
Электрический заряд q характеризует величину электрического взаимодействия и измеряется в кулонах. Точечным зарядом является заряженное тело, геометрическими размерами которого в данных условиях можно пренебречь. Закон Кулона устанавливает, что сила Кулона или сила взаимодействия двух точечных электрических зарядов q1 и q2 , находящихся в вакууме на расстоянии r друг от друга, определяется выражением
|
= k |
q1q2 |
r |
, где k = |
1 |
9 ×109 м/Ф , а постоянная ε0 = 8,85 × 10-12 Ф/м называется электри- |
|
F12 |
|||||||
r3 |
|
||||||
|
|
|
|
4pe0 |
|||
ческой постоянной. Заметим, что нескомпенсированный заряд в 1 Кл — это очень большой заряд: два точечных заряда в 1 Кл каждый, находящиеся на расстоянии 1 м друг от друга, будут отталкиваться с силой Кулона Fкyл = 9×109 Н!
Заметим также, что закон Кулона для двух точечных взаимодействующих зарядов и закон гравитационного притяжения Ньютона для двух материальных точек имеют аналогичный вид. Так, если поместить один точечный заряд q в начало координат (рис.), то на другой точечный заряд q0 будет действовать сила Кулона
|
qq0 |
|
|
|
|
||
Fкул = |
|
|
er |
, где |
er |
= r r - единичный вектор, направленный вдоль радиус-вектора, |
|
4pe0r |
2 |
||||||
|
|
|
|
|
|||
соединяющего заряды. Подобным же образом запишется и сила гравитационного притяжения Ньютона для аналогично расположенных материальных точек с массами т и m0 :
Fграв = G mm0 er . Поэтому все классические законы для электростатического и гравита- r2
ционного полей одинаковы по форме. Однако между электростатическим и гравитационным взаимодействиями существуют и некоторые отличия.
1)Знак массы (гравитационного заряда) всегда положителен, и гравитационная сила притягивает положительные массы. Электрический же заряд q может быть и положительным, и отрицательным, причем сила Кулона отталкивает одноименные заряды и притягивает разноименные.
2)Электрическое взаимодействие намного сильнее гравитационного. А так как наш мир электрически нейтрален, т.е. полный (положительный и отрицательный) заряд в нем равен нулю, то значительно более слабые гравитационные силы в нем становятся заметными и могут достигать огромной величины только из-за большой суммарной массы всех частиц.
3)Электрический заряд нельзя уменьшать до сколь угодно малой величины. Имеется минимально возмож-
ный и неделимый заряд, равный или заряду электрона |е| = 1,602×10–19 Кл, или зарядам кварков — | е|/3, 2|е|/3 . Но кварки объединены в элементарные частицы, заряды которых также кратны заряду электрона е. Поэтому все заряды в природе кратны заряду электрона: q = Ne, где N - целое.
Величину электрического поля точечного заряда q характеризуют или напряженностью, или потенциалом. Поднесем к заряду q некоторый пробный заряд q0 и разделим силу их взаимодействия на вели-
чину пробного заряда. Полученный вектор называется напряженностью поля, созданного точечным зарядом q на расстоянии r:
= Fкул =
E
q0
q
4pe0r2 er .
Напряженность поля численно равна кулоновской силе, действующей на единичный положительный заряд, внесенный в поле, и направлена вдоль этой силы.
Но кулоновская сила центральна, а все центральные силы консервативны, т.е. работа силы Кулона при изменении расстояния r между точечными зарядами q и q0 идет на изменение потенциальной энергии кулоновского электрического взаимодействия между зарядами (энергию электромагнитных взаимодействий принято обозначать буквой W):

70
|
|
|
|
|
|
|||
dA = Fкулdr = |
0 |
cos q× |
dr |
= |
0 |
dr = -dWкул . |
||
4pe0r2 |
4pe0r2 |
|||||||
|
|
|
|
|
|
|||
Интегрируя, получаем выражение этой энергии:
Wкул = |
|
qq0 |
|
dr = |
qq0 |
|
. |
∫ 4pe0r |
2 |
4pe0r |
|
||||
|
|
|
|
||||
Потенциальная энергия определена с точностью до постоянной, которую считаем равной нулю (заряды, разнесенные на бесконечное расстояние r = ∞ не взаимодействуют, а поле любого заряда на бесконечном удалении равно нулю).
Разделив эту энергию на величину пробного заряда q0 , получаем потенциал поля, созданного точечным зарядом q на расстоянии r:
j = |
Wкул |
= |
q |
|
. |
||
|
|
||||||
|
q |
4pe |
0 |
r |
|
||
0 |
|
|
|
|
|
||
Потенциал – это скалярная характеристика электрического поля, равный энергии единичного положительного заряда, находящегося в данном поле.
Если поле создается системой точечных зарядов, то напряженности полей, созданных каждым точечным зарядом q1, складываются векторно, и результирующее поле в точке А, указанной на рисунке, выражается формулой
|
|
qi |
|
|
|
|
|
|
|
|
|
||
EA = ∑ Ei = ∑ |
|
|
|
ri |
. Это – |
принцип суперпозиции полей. |
|
|
|
|
|
||
4pe |
|
|
|
|
|
|
|
||||||
i |
i |
0 |
r3 |
|
|
|
|
|
|
|
|
||
|
i |
|
|
|
|
|
|
|
|
||||
Аналогично вычисляется суммарный потенциал электрического поля системы точечных зарядов: |
jA = ∑ji = ∑ |
qi |
|
. |
|||||||||
4pe |
r |
|
|||||||||||
|
|
|
|
|
|
|
|
i |
i |
|
|
||
|
|
|
|
|
|
|
|
|
0 i |
|
|
||
Заметим, что результирующий потенциал системы вычислить проще, так как потенциалы отдельных зарядов складываются скалярно, без учета направления их полей, но записанная сумма будет алгебраической, учитывающей знаки отдельных зарядов.
В прикладных технических задачах обычно заряд распределен по некоторой области. В этом случае объём, заполненный зарядом разбивают на крошечные участки dV, которые имеют заряд dq и которые можно считать точечными
зарядами. Вводят величину объёмной плотности электрического заряда r = |
lim |
Dq |
Кл |
. Тогда dq = rdV |
и можно |
||
|
|
|
|
||||
DV |
|
||||||
|
V →0 |
м3 |
|
|
|
||
применить тот же принцип суперпозиции, заменяя сумму на интеграл по объему, заполненному зарядом:
EA = ∫ dE = ∫ |
dq |
r = ∫ rdV |
r |
и |
jA = ∫ d j = ∫ dq = ∫ rdV |
. |
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
V |
V 4pe0r3 |
V 4pe0r3 |
|
|
|
|
V |
|
V 4pe0r V 4pe0r |
|
|
|
|
|||||||||||||
|
|
|
|
Пример: пусть заряд q равномерно распределен по тонкому кольцу радиуса R. |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Dq |
Кл |
||
|
В этом случае вводят линейную плотность заряда rлин = lim |
|
|
, разбивая |
||||||||||||||||||||||
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
l→0 Dl |
|
м |
|||
|
кольцо на крошечные участки длиной dl, заряды dq = rлинdl на которых будут точеч- |
|||||||||||||||||||||||||
|
ными (в данном примере rлин = q 2pR ). Тогда, так как r = R2 + х2 |
и cos φ = х/r, то в |
||||||||||||||||||||||||
|
точке А на оси кольца на расстоянии x |
от его центра O получим |
|
|
|
|||||||||||||||||||||
|
Eрез = |
∫ |
dE cos j = |
1 |
|
cos j |
∫ |
dq = |
|
qx |
|
|
. |
|
|
|
|
|
|
|||||||
|
|
|
r 2 |
4pe0 (R |
|
|
|
2 3 2 |
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
4pe0 |
|
2 |
+ x |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
) |
|
|
|
|
|
|
|
|
||||
15.2. Работа по перемещению заряда в электростатическом поле
Если точечный заряд q0 движется в поле системы точечных зарядов qi , то, используя принцип суперпозиции
|
|
|
|
|
|
|
|
||||||||
dA = F |
рез × dr |
= ∑ Fi dr |
= ∑ dAi и интегрируя, находим работу по перемещению заряда q0 |
из точки 1 в точку 2 в элек- |
|||||||||||
|
|
|
i |
|
|
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
q q |
|
q q |
|
||
тростатическом поле системы покоящихся точечных зарядов: A1→2 |
= ∑ Ai = |
|
|
∑ |
i 0 |
- |
i 0 |
, где r1i , r2i – рас- |
|||||||
4pe |
|
r |
r |
|
|||||||||||
|
|
|
|
|
|
|
i |
0 |
|
|
2i |
|
|||
|
|
|
|
|
|
|
|
i |
1i |
|
|
|
|||
стояния от точек 1 и 2 до заряда qi . Учитывая выражение для потенциала данной системы зарядов, записываем данную
формулу в более удобном виде: |
A12 = q0 (j1 - j2 ) |
. |
Работа по перемещению точечного заряда в электростатическом поле равна произведению заряда на величину разности потенциалов в точках начального и конечного положения заряда.
Можно сказать, что энергия точечного заряда q в поле с потенциалом ϕ равна W = qϕ .
