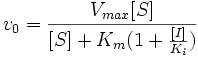- •2)Ингибиторы ферментов. Конкурентный и неконкурентный механизмы ингибирования.
- •Окислительное декарбоксилирование пирувата
- •5)Типы мышечных волокон. Особенности энергообразования в быстро и медленносокращающихся мышечных волокнах.
- •8)Биологические принципы спортивной тренировки. Принцип обратимости действия.
Понятие о простых и сложных белках. Характеристика отдельных представителей классов.
Простые и сложные белки. Все белки подразделяются на две большие группы: простые и сложные. Простые белки построены только из аминокислот, в состав сложных белков кроме аминокислот входят атомы металлов или других сложных веществ небелковой природы
Простые белки отличаются друг от друга растворимостью в воде и других растворителях. Белки, способные растворяться в чистой дистиллированной воде, называются альбуминами. Примером альбуминов являются яичный белок, а также белки пшеницы и гороха. Белки, способные растворяться в слабом растворе поваренной соли, называются глобулинами. Представителями глобулинов можно назвать белки крови и многие растительные белки. В клетках живых организмов содержатся также белки, растворимые в спиртах и слабых щелочных растворах
Сложные белки. В зависимости от характера соединений небелковой природы, входящих в состав белков, они делятся на нуклеопротеины, хромопротеины, липопротеины и др.
Характеристика отдельных представителей классов.
Липопротеиды, содержащие в качестве простетической части нековалентно связанные липиды. Липопротеиды, образованные белками-аполипопротеинами связывающимися с ними липидами и выполняют функцию транспорта липидов.
Металлопротеиды, содержащие негемовые координационно связанные ионы металлов. Среди металлопротеидов есть белки, выполняющие депонирующие и транспортные функции (например, железосодержащие ферритин итрансферрин) и ферменты (например, цинксодержащая карбоангидраза и различные супероксиддисмутазы, содержащие в качестве активных центров ионы меди, марганца, железа и других металлов)
Нуклеопротеиды, содержащие нековалентно связанные ДНК или РНК, в частности, хроматин, из которого состоятхромосомы, является нуклеопротеидом[2]
2)Ингибиторы ферментов. Конкурентный и неконкурентный механизмы ингибирования.
Ферментативный ингибитор — вещество, замедляющее протекание ферментативной реакции. Различают обратимые и необратимые ингибиторы
Конкурентное ингибирование
Конкурентный ингибитор обычно структурно схож с субстратом, однако фермент не способен катализировать реакцию в присутствии ингибитора из-за отсутствия у последнего необходимых функциональных групп.
Схема конкурентного ингибирования и уравнение Михаэлиса-Ментен для него выглядят следующим образом:
|
|
|
Видно, что при конкурентном ингибировании максимальная скорость реакции Vmax не меняется, а кажущаяся константа Михаэлиса увеличивается в (1 + [I]/Ki) раз. Поэтому в двойных обратных координатах Лайнуивера-Берка (зависимость 1/v0 от 1/[S]) при разных концентрациях ингибитора получают семейство прямых с различным наклоном, пересекающихся в одной точке на оси ординат.
Константу ингибирования Ki обычно определяют так: проводят ряд измерений кажущейся константы Михаэлиса при различных концентрациях ингибитора, затем строят зависимость этой величины от концентрации ингибитора. Тангенс угла наклона полученной прямой равен Km/Ki.
Неконкурентное ингибирование[править | править исходный текст]
![]()
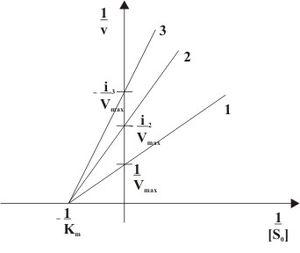
Рис. 3: Неконкурентное ингибирование в двойных обратных координатах при различных концентрациях ингибитора ( 1 ... [I]=0, 2 ... [I]>0, 3 ... [I]>[I]2)
Неконкурентный ингибитор не мешает связыванию субстрата с ферментом. Он способен присоединяться как к свободному ферменту, так и к фермент-субстратному комплексу с одинаковой эффективностью. Ингибитор вызывает такие конформационные изменения, которые не позволяют ферменту превращать субстрат в продукт, но не влияют на сродство фермента к субстрату.
Схема и уравнение Михаэлиса-Ментен в случае неконкурентного ингибирования:
|
|
|
При неконкурентном ингибировании константа Михаэлиса не изменяется, а максимальная скорость реакции уменьшается в (1 + [I]/Ki) раз. Поэтому в двойных обратных координатах семейство прямых, отвечающих разным концентрациям ингибитора, пересекается в одной точке на оси абсцисс.
ХАРАКТЕРИСТИКА ВИТАМИНА Д(кальциферола.), биологическая роль.
Витамин D — группа биологически активных веществ (в том числе холекальциферол и эргокальциферол). Холекальциферол (витамин D3) синтезируется под действием ультрафиолетовых лучей в коже и поступает в организм человека с пищей. Эргокальциферол (витамин D2) может поступать только с пищей.
Главной функцией как холекальциферола, так и эргокальциферола является обеспечение всасывания кальция ифосфора из продуктов питания в тонком кишечнике (преимущественно в двенадцатиперстной кишке). Также ряд клинических исследований заставляет предполагать следующие дополнительные функции витамина D: участие в регуляции размножения клеток, обменных процессов, стимуляция синтеза ряда гормонов.
Витамины группы D являются незаменимой частью пищевого рациона человека. Суточная потребность (RDA) в возрасте от 1 до 70 лет (включая беременных и кормящих матерей) составляет 15 мкг холекальциферола или 600 ME (международных единиц)[1].
Кальциферол растворим в жирах. Жиры также необходимы для адекватного всасывания этого витамина в кишечнике. Как и другие растворимые в жирах витамины, имеет свойство накапливаться в жировой ткани[2]. Запасы витамина D, накопленные организмом в течение лета, могут постепенно расходоваться в зимние месяцы[2].
Биологическая роль витамина D
Витамин D способствует правильному росту костей, предохраняет детей от развития рахита, ускоряет процессы заживления костной ткани при ее повреждениях. Витамин D регулирует в организме обмен кальция и фосфора.
Витамин D - это витамин, действующий и как витамин, и как гормон. Как витамин он поддерживает уровень неорганического Р и Са в плазме крови выше порогового значения и повышает всасывание Са в тонкой кишке. В качестве гормона действует активный метаболит витамина D - 1,25-диоксихолекациферол, образующийся в почках. Он оказывает влияние на клетки кишечника, почек и мышц: в кишечнике стимулирует выработку белка-носителя, необходимого для транспорта кальция, а в почках и мышцах усиливает реабсорбцию Ca++.
Витамин D является главным звеном гормональной регуляции обмена кальция и фосфора:
Увеличивает проницаемость плазматической мембраны энтероцитов для кальция и активный транспорт его в митохондрии.
Индуцирует синтез белка-переносчика для выкачивания кальция из энтероцитов в кровь.
Стимулирует абсорбцию фосфора в кишечнике.
Стимулирует отложение солей кальция во вновь сформированном остеоидном матриксе.
Способствует дифференцировке моноцитов и макрофагов в остеокласты.
Снижает синтез остеобластами коллагена I типа, способствуя резорбции избытка неминерализованного остеоида.
Усиливает реабсорбцию кальция в дистальных извитых канальцах почек.
4)Общий путь катаболизма. Окислительное декарбоксилирование пирувата. Его регуляция и биологическая роль .
Общий путь катаболизма - совокупность биохимических процессов, которая включает в себя:
окисление пирувата до ацетил-КоА;
окисление ацетил-КоА в цикле трикарбоновых кислот;
выделение и аккумулирование энергии при дегидрировании метаболитов общего пути катаболизма в митохондриальных цепях переноса электронов[1].