
- •Министерство образования и науки Российской Федерации
- •Тема 1. Параметры состояния термодинамической системы. Законы идеальных газов. Уравнение состояния идеального газа
- •Тема 2. Смеси газов. Теплоемкость.
- •Средняя массовая теплоемкость определяется по формуле
- •Тема 3. Первый закон термодинамики. Термодинамические процессы идеальных газов
- •Тема 4. Второй закон термодинамики
- •Тема 5. Циклы двигателей внутреннего сгорания
- •Тема 6. Циклы газотурбинных установок
- •Библиографический список
Тема 3. Первый закон термодинамики. Термодинамические процессы идеальных газов
Теоретические сведения
Уравнение первого закона термодинамики для 1 кг однородного вещества для элементарного процесса записывается в виде:
dq = du + pdv ;
откуда
![]() u
= q1-2
– l1-2,
u
= q1-2
– l1-2,
где
![]() u
– изменение внутренней энергии;
u
– изменение внутренней энергии;
q1-2 – количество теплоты;
l1-2 – работа процесса.
Внутренняя энергия идеального газа зависит только от его температуры, в этом случае для всех процессов идеального газа
du= cv dt,
∆u =
u2
– u1
=
![]() cv
dt
= =
cv
m
cv
dt
= =
cv
m
![]() t2
- cv
m
t2
- cv
m
![]() t1
t1
или при постоянной теплоемкости:
u2 – u1 = cv (t2 – t1) , кДж/кг,
где cv
m
![]() -
средняя в интервале температур изохорная
теплоемкость газа, кДж/кг град.
-
средняя в интервале температур изохорная
теплоемкость газа, кДж/кг град.
Количество тепла также может быть выражено через изменение температуры газа
q1-2
= ![]() cx
dt
= cx
m
cx
dt
= cx
m
![]() t2
– cx
m
t2
– cx
m
![]() t1
t1
или q1-2 = cx (t2 - t1), кДж/кг,
где cx – теплоемкость газа в рассматриваемом процессе, кДж/кг град.
Работа процесса может быть вычислена, если известна зависимость давления от объема в ходе процесса (уравнение процесса):
l
=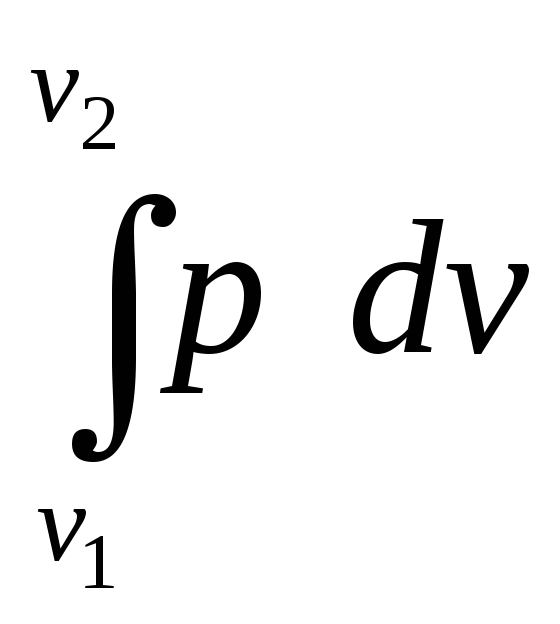 =
=![]() f(v)dv,
кДж/кг.
f(v)dv,
кДж/кг.
Вводя выражение для энтальпии i = u + pv в уравнение первого закона термодинамики, получим его в другом виде
dq = di
– vdp
или
q1-2
= i2
– i1
-
![]() ,
,
где – vdp = dl0 – располагаемая работа, кДж/кг.
Энтальпия идеального газа зависит также от его температуры
i2
– i1
= cp
m
![]() t2
– cp
m
t2
– cp
m
![]() t1,
t1,
или для постоянной теплоемкости:
i2 – i1 = cp (t2 – t1), кДж/кг,
где cp – средняя изобарная теплоемкость газа, кДж/кг град.
Используя уравнение dq = cvdT + pdv, заменим p на RT/v, получим
dq = cvdT + RTdv/v.
Разделив обе части последнего уравнения на Т, находим
dq/T = cvdT/T + Rdv/v.
Функция dq/T называется энтропией s и измеряется в Дж/град, удельная энтропия – в Дж/кг град, т.е.
ds=dq/T.
Изменение энтропии идеального газа вычисляют по формулам:
s2 – s1 = cv ln T2 /T1 + R ln v2/v1,
s2 – s1 = cp ln T2 /T1 + R ln p2/p1.
При исследовании термодинамических процессов находят соотношение между параметрами газа, значение параметров в характерных точках процесса, изменение внутренней энергии, энтальпии, работу процесса, количество тепла.
Изохорный процесс (v=const).
Уравнение процесса
p/T = R/v,
давления пропорциональны температурам:
p1/p2 = T1/T2.
Тепло, участвующее в процессе, идет на изменение внутренней энергии газа:
q
=
![]() u
= cv
(Т2-Т1).
u
= cv
(Т2-Т1).
Внешняя работа газа равна нулю, так как dv = 0, т.е.
l
=![]() = 0.
= 0.
Располагаемая работа
l0 = - v(p2 – p1).
Изменение энтропии при постоянной теплоёмкости равно
s2 – s1 = cv ln T2/T1 = cv ln p2/p1.
Изобарный процесс (р=const).
Уравнение процесса
v/T = R/p,
объемы пропорциональны температурам:
v2 /v1 = T2 /T1.
Работа процесса определяется из уравнения
l = p (v2 – v1) = R(T2 – T1).
Тепло процесса равно изменению энтальпии, поскольку располагаемая работа равна нулю:
dl0
= - vdp
= 0, q
=
![]() i
= cp
(T2
– T1).
i
= cp
(T2
– T1).
Так как при p=const ln p2/p1 = 0, поэтому
s2
– s1=
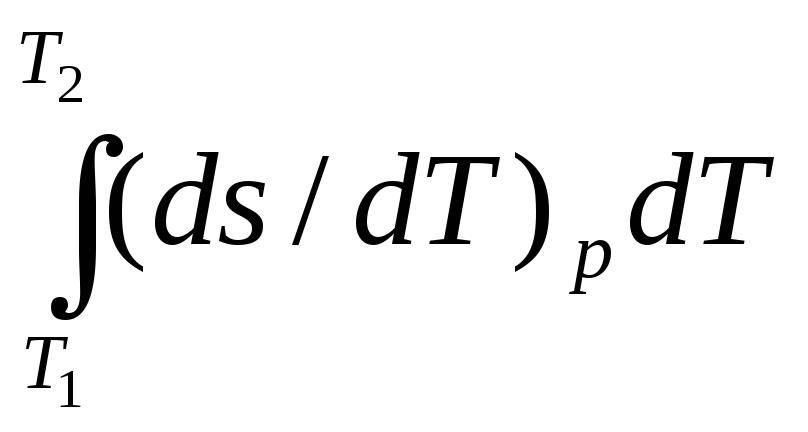 =
=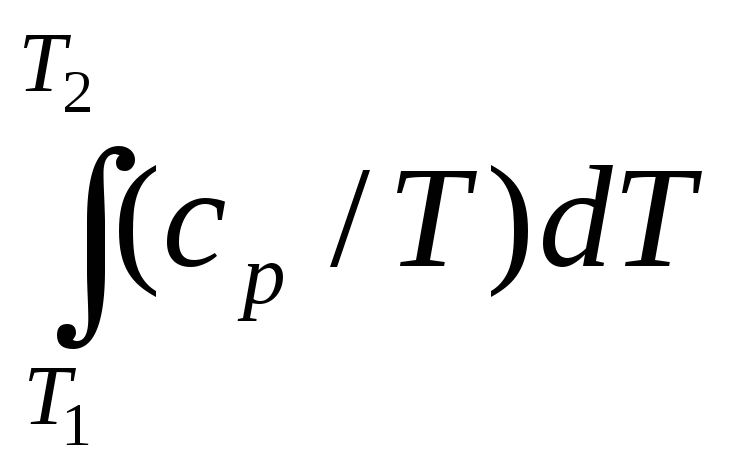 =cp
ln T2/T1
= cp
ln v2/v1
.
=cp
ln T2/T1
= cp
ln v2/v1
.
Изотермический процесс (Т= const).
Уравнение процесса
pv =RT = const ,
давления обратно пропорциональны объемам
p2/p1 =v1/v2.
Внутренняя энергия и энтальпия в процессе не изменяются:
![]() u=
0,
u=
0,
![]() i
= 0.
i
= 0.
Количество подведённой к рабочему телу теплоты численно равно работе изменения объёма
q
= l=
![]() =
p1
v1
1n
v2/v1
.
=
p1
v1
1n
v2/v1
.
При переходе к десятичным логарифмам имеем
q =l = 2,3 p1 v1 1g v2/v1 = 2,3 p1 v1 1g p1/p2 = 2,3 RT 1g v2/v1 =
2,3 RT 1g p1/p2 .
Располагаемая работа равна работе процесса
l0 = l.
Адиабатный процесс (dq = 0).
Уравнение процесса
pvk = const.
Соотношения между параметрами в адиабатном процессе
p1/p2 = (v2/v1)k ; v2/v1 = (p1/p2)1/ k; T1/T2 = (v2/v1)k-1=( p1/p2)k-1/ k.
Изменение внутренней энергии, взятой с обратным знаком, равно работе процесса:
-
![]() u=
l
=
u=
l
=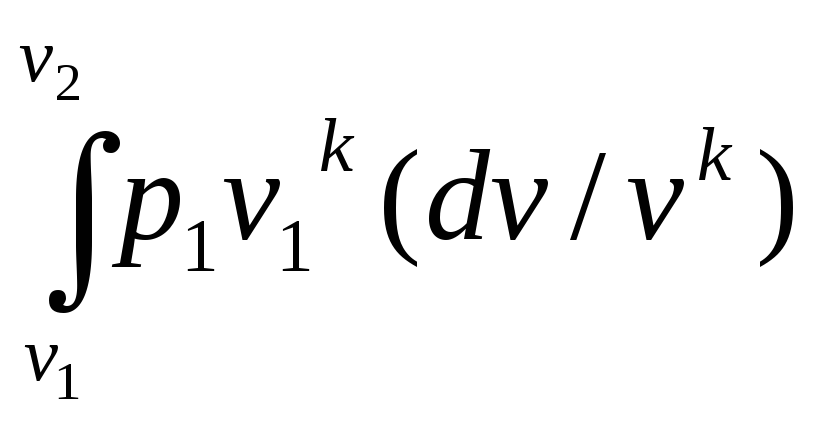 ,
,
-
![]() u=
l= cv
(Т1
-Т2)=(1/k-1)
(p1v1
– p2v2)
= (R
/ k -1)
(Т1
-Т2).
u=
l= cv
(Т1
-Т2)=(1/k-1)
(p1v1
– p2v2)
= (R
/ k -1)
(Т1
-Т2).
Располагаемая работа в к раз больше работы процесса:
l0 = кl.
Для обратимого адиабатного процесса dq=0, поэтому
ds=dq/T=0 и s2=s1=const.
Политропный процесс.
Уравнение процесса
pvn = const,
где n
– показатель политропы, который для
разных процессов может иметь любое
значение от -
![]() до +
до +![]() ,
но остается постоянным в данном процессе.
,
но остается постоянным в данном процессе.
Соотношения между параметрами в политропном процессе
p2/p1= (v1/v2)n ; T2/T1= (v1/v2)n-1 ; T2/T1= (p2/p1)n-1/n.
Работа процесса может быть вычислена по формуле:
l =(1/n-1) (p1v1 – p2v2)
или
l = [p1v1 / (n-1)] [1 – (v1/v2)n-1] = [p1v1 / (n-1)] [1 – (p2/p1)n-1/n].
Изменение внутренней энергии газа и теплота в политропном процессе определяются по формулам:
![]() u=
cv
(t2
– t1);
u=
cv
(t2
– t1);
q = cn (t2 – t1) = cv [(n - k) / (n-1)] (t2 – t1).
Располагаемая внешняя работа в политропном процессе по аналогии с адиабатным равна
l0
= -
![]() =
[n/(n-1)]
(p1v1
– p2v2)
=[n/(n-1)]
R(T1
– T2).
=
[n/(n-1)]
(p1v1
– p2v2)
=[n/(n-1)]
R(T1
– T2).
Изменение энтальпии в политропном процессе
i2 – i1 = cp (t2 – t1).
Изменение энтропии газа в политропном процессе определяется по формуле
ds = dq/T = cndT / T
или для конечного изменения состояния
s2 – s1 = cn ln T2/T1 = cv [(n - k) / (n - 1)] ln T2 / T1.
Показатель политропы n может быть определен по формулам:
n
= (cn
-
cp)
/ (cn
- cv),
n
=![]() .
.
Задачи
Воздух расширяется в процессе p = 0,5 МПа = const, при этом его объем
изменяется от 0,35 до 1,8 м3. Температура в конце расширения равна 1500° С. Определить температуру воздуха в начале процесса расширения, подведенное количество теплоты, работу, совершенную в этом процессе, изменения внутренней энергии и энтальпии воздуха.
2. В поршневом детандере (расширительной машине) установки глубокого охлаждения политропно расширяется воздух от начального давления р1 = 20 МПа и температуры Т1 = 20° С до конечного давления р2 = 1,6 МПа. Показатель политропы n = 1,25. Определить параметры воздуха в конце расширения, удельные значения изменения внутренней энергии и энтальпии, количества теплоты, работы процесса и располагаемой работы.
3. В политропном процессе, совершаемом количеством вещества гелия n = 2 кмоль, отводится количество теплоты 3000 кДж. Начальные параметры процесса: р1 = 0,15 МПа и Т1= 227° С; конечная температура 127° С. Молярная теплоемкость гелия μсv =12,5 кДж/ кмоль К. Определить показатель политропы, начальные и конечные параметры газа, изменение внутренней энергии и энтальпии, работу процесса и располагаемую работу, изменение энтропии.
4. Сколько теплоты нужно сообщить при постоянном объеме газовой смеси массой 1 кг, давлением 1,2 МПа и температурой 390° С, чтобы повысить давление до 4 МПа? Удельная теплоемкость смеси сv= 956 Дж/кг К.
5. Азот массой 0,5 кг расширяется по изобаре при давлении 0,3 МПа так, что температура его повышается от 100 до 300° С. Найти конечный объем азота и работу изменения объема.
6. Воздух объемом 3 м3 при температуре 10° С расширяется изобарно с увеличением объема в 1,5 раза вследствие подвода к нему 630 кДж теплоты. Найти давление, при котором происходит процесс расширения.
7. Объем воздуха массой 1 кг при температуре 20° С изотермически увеличен в 1,5 раза. Найти удельную работу изменения объема.
8. Воздух с начальным объемом 8 м3 при давлении 90 кПа и температуре 20° С изотермически сжимается до давления 0,8 МПа. Найти конечный объем и работу изменения объема.
9. Воздух массой 2 кг при давлении р1=1МПа и температуре Т1=300° С расширяется по адиабате так, что объем газа увеличивается в 5 раз. Найти его конечные объем, давление и температуру.
10. Воздух объемом 0,2 м3 и давлением 0,2 МПа подогревается в цилиндре диаметром 0,5 м от 18 до 182° С при постоянном давлении. Найти работу расширения воздуха и расстояние, на которое при этом передвинется поршень в цилиндре.
11. Построить политропу для воздуха в координатах Т,s по двум крайним и трем промежуточным точкам, выбрав масштабы температуры и энтропии. Начальные параметры воздуха р1=0,2 МПа и Т1= 30°С; конечные р2=1,2 МПа и v2=0,1 м3/ кг.
12.В компрессоре
сжимается воздух массой 2 кг при постоянной
температуре 200![]() С
отp1=0,1
МПа до p2=2,5
МПа. Найти работу сжатия.
С
отp1=0,1
МПа до p2=2,5
МПа. Найти работу сжатия.
13.Воздух с начальным
объемом 8 м3
и начальной температурой t1=20![]() С
сжимается по политропе с показателемn=1,2
от абсолютного давления p1=0,09
МПа до p2=0,81
МПа до достижения температуры t2=150
С
сжимается по политропе с показателемn=1,2
от абсолютного давления p1=0,09
МПа до p2=0,81
МПа до достижения температуры t2=150![]() C.
Найти конечный объем и совершенную
работу.
C.
Найти конечный объем и совершенную
работу.
