
английский для второй подгруппы.ОСНОВЫ ХИМИИ
.pdf10
Осадок сульфата стронция образуется, если ионное произведение С Sr2 С SO24 превышает произведение растворимости KSo SrSO4 . Согласно условию с учетом разбавления растворов при их смешивании (уменьшение исходной концентрации в два раза),
C Sr2 5 10 4 / 2 2,5 10 4 моль /дм3,
C SO24 5 10 4 / 2 2,5 10 4 моль /дм3.
Следовательно, ионное произведение
C Sr2 C SO24 2,5 10 4 2 0,625 10 7
меньше произведения растворимости (3,2 10 7):
C Sr2 C SO24 0,625 10 7 KSo SrSO4 3,2 10 7 ,
поэтому осадок сульфата стронция не образуется. Ответ: Осадок не образуется.
Задача 3.5. Как изменится молярная растворимость иодида серебра, если к его насыщенному раствору прибавить иодид ка-
лия до концентрации 1 моль дм3 ? Произведение растворимости иодида серебра KSo AgI 8,3 10 17.
Решение. Исходя из произведения растворимости иодида серебра KSo AgI [Ag ] [I ] 8,3 10 17, рассчитывают вначале, растворимость иодида серебра в чистой воде. Обозначив S [Ag ] [I ] C AgI , получают для растворимости S иодида серебра в чистой воде:
KSo AgI S2 8,3 10 17 ,
11
S C AgI 8,3 10 17 1/ 2 9,1 10 8 моль /дм3.
Далее рассчитывают растворимость S1 иодида серебра в присутствии одноименных иодид-ионов, исходя из произведения растворимости:
S1 [Ag ] KSo (Ag )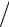 [I ].
[I ].
Равновесную концентрацию иодид-ионов [I ] можно принять равной концентрации иодида калия:
[I ] C KI 1,0 10 4 моль /дм3.
Тогда,
S1 8,3 10 17 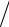 1,0 10 4 8,3 10 13 моль /дм3.
1,0 10 4 8,3 10 13 моль /дм3.
Таким образом, при введении в раствор иодида серебра добавок иодида калия растворимость иодида серебра уменьшается в S / S1 9,1 10 8 / 8,3 10 13 1,1 104 раз за счет влияния одноименных иодид-ионов.
Ответ: Уменьшается в 11000 раз.
Задача 3.6. Вычислить растворимость BaF2 в 0,01 М молярном растворе HCl. Во сколько раз эта растворимость больше чем в чистой воде? KSo BaF2 1,73 10 6 ; KSo HF 7,4 10 4.
Решение. Обозначив растворимость BaF2 через S, получают [Ba2 ] S и [F ] 2S a , где а – доля F от общей концентра-
ции F и HF. По уравнению находят: |
|
||||
a |
KSo HF |
|
7,4 10 4 |
0,069 , |
|
[H ] KSo HF |
|
0,01 7,4 10 4 |
|||

12
Ko |
BF [Ba2 |
] [F ]2 S 2S a 2 . |
|
S |
2 |
|
|
Откуда, S 1,73 10 6/ 4 0,0692 1/ 3 |
7,56 10 3, значит раствори- |
||
мость в HCl в 6 раз больше, чем в чистой воде. Ответ: Увеличится в 6 раз.
Задача 3.7. Вычислить молярную и нормальную концентрацию раствора H2SO4 по его массовой доле (30%) и плотности
(1,22 г см3 ).
Решение: M H2SO4 98,08 г моль; M 1/ 2H2SO4 49,04 г моль.
Молярная концентрация раствора H2SO4 равна:
C 1/ 2H2SO4 10 / M 1/ 2H2SO4
=30 1,22 10 7,5 моль /дм3, 49,04
где – массовая доля раствора H2SO4 , %; – плотность раствора H2SO4 , г см3.
Ответ: 3,7 моль /дм3 и 7,5 моль /дм3.
Задача 3.8. Сколько граммов KOH содержится в 250 см3
раствора, если на титрование 20 см3 этого раствора расходуется в среднем 18,40 см3 0,09234 М раствора HNO3 ?
Решение. Уравнение реакции при титровании:
KOH HNO3 KNO3 H2O.
Согласно принципу эквивалентности,
13
С KOH C HNO3 V HNO3 / V KOH =
= 0,09234 18,40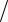 20 = 0,08495 моль /дм3.
20 = 0,08495 моль /дм3.
Находят массу KOH в 250 см3 (0,25 дм3 ) раствора:
m KOH C KOH M KOH V KOH
0,08495 56,1 0,25 1,19 г.
Ответ: 1,19 г.
Задача 3.9. Рассчитать количество иодата калия в растворе, если после замещения его действием избытка KI и кислоты, на
титрование заместителя I2 затрачено 21,45 см3 0,1010 М раство-
ра Na2S2O3.
Решение. Уравнение реакции при титровании:
I2 2Na2S2O3 2NaI Na2S4O6 ,
IO3 5I 6H 3I2 3H2O .
Согласно принципу эквивалентности,
n Na2S2O3 6n KIO3 ,
0,1010 21,45 6n KIO3 .
Отсюда,
n KIO3 0,1010 21,45 / 6 0,3610 ммоль,
m KIO3 n KIO3 M KIO3 0,3610 10 3 214,01 77 мг.
Ответ: Около 77 мг.
14
Задача 3.10. К 10 см3 анализируемого раствора KClO3 , подкисленного серной кислотой, добавили 20 см3 0,105 н. раствора FeSO4 , израсходовано 12,48 см3 0,076 н. раствора KMnO4. Сколько граммов KClO3 содержится в 250 см3 анализируемого раствора?
Решение. Уравнения реакций:
KClO3 6FeSO4 3H2SO4 KCl 3Fe2 (SO4 )3 3H2O,
в избытке
ClO3 6H 6e |
Cl 3H2O 1 |
Fe2 e Fe3 |
6 |
_____________________________________
ClO3 6Fe2 6H Cl 6Fe3 3H2O
остаток
10FeSO4 2KMnO4 |
8H2SO4 |
5Fe2 SO4 3 2MnSO4 |
K2SO4 H2O |
Fe2 e Fe3 |
1 |
MnO4 8H 5e Mn2 4H2O 6
________________________________________
2
5Fe MnO4 8H 5Fe3 Mn2 4H2O
(при записи этих уравнений в молекулярной форме все члены ионного уравнения нужно умножить на 2, так как в состав
Fe2 SO4 3 входят два иона Fe3 ).
M 1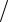 6ClO3 1
6ClO3 1 6M KClO3 1
6M KClO3 1 6 122,6 20,43 г/моль.
6 122,6 20,43 г/моль.

15
Принцип эквивалентности для данного случая обратного титрования:
n(FeSO4 ) n(KClO3 ) n(KMnO4 ) ,
С FeSO4 V FeSO4
= C(1/ 6KClO3 ) V(KClO3 ) C(1/ 5KMnO4 ) V(KMnO4 ).
Откуда молярная концентрация эквивалента анализируемого раствора KClO3 :
С 1 6KClO3 0,1050 20 0,076 12,48  10 0,1152 моль /дм3.
10 0,1152 моль /дм3.
Масса KClO3 в 250 см3 (0,25 дм3 ) раствора:
m KClO3 C 1 6 KClO3 M 1 6KClO3 V KClO3
6 KClO3 M 1 6KClO3 V KClO3
0,1152 20,43 0,25 0,5882 г.
Ответ: m KClO3 = 0,5882 г.
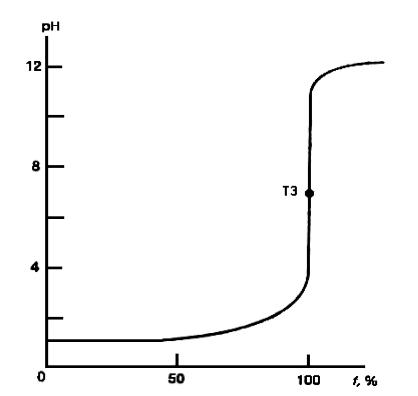
Задача 3.11. Построить кривую титрования 100 см3 0,10 М раствора хлороводородной кислоты 0,10 М раствором гидроксида натрия [5].
Решение. По условию Сo CT 0,10 M, Vo 100 см3 . До начала титрования:
[H ] Co 0,10 M , следовательно, pH 1,00 .
До точки эквивалентности:
[H ] Co Vo VT . Vo VT

16
Например, при добавлении 50 см3 раствора NaOH :
[H ] 0,10 100 50 3,3 10 2 M , следовательно, pH 1,48 . 100 50
В точке эквивалентности:
[H ] |
K |
|
1,0 10 14 |
1,0 10 7 |
M , pH 7,00 . |
За точкой эквивалентности:
[OH ] C |
o |
|
VT Vo |
, |
pH 14 pOH . |
|
|||||
|
|
V V |
|
||
|
|
|
T o |
|
|
Например, при добавлении 101 см3 раствора NaOH :
[OH ] 0,10 101 100 5 10 4 M , pH 14 3,3 10,70 . 101 100
Результаты вычислений приведены в табл. 2.
Таблица 2 Значения pH при титровании 0,10 М раствора хлороводородной
кислоты 0,10 М раствором гидроксида натрия
f, % |
Не оттитровано HCl , % |
Избыток NaOH , % |
pH |
0 |
100,0 |
- |
1,00 |
50,0 |
50,0 |
- |
1,48 |
90,0 |
10,0 |
- |
2,28 |
99,0 |
1,0 |
- |
3,30 |
99,9 |
0,1 |
|
4,30 |
100,0 |
- |
- |
7,00 |
100,1 |
- |
0,1 |
9,70 |
101,0 |
- |
1,0 |
10,70 |
110,0 |
- |
10,0 |
11,67 |
17
По данным табл. 2 строим кривую титрования.
Кривая титрования 0,10 М раствора хлороводородной кислоты 0,10 М раствором гидроксида натрия
4.ЗАДАЧИ
4.1.Гравиметрический анализ
Задача 4.1. Воздушно-сухая соль содержит 7,50% влаги. Вычислить массу начальной навески, если после высушивания она составила 0,3736 г.
Ответ: 0,4039 г.
Задача 4.2. Смесь содержит по массе 50% хлорид-ионов. Какую навеску смеси надо взять, чтобы получить 0,5 г AgCl ?
Ответ: 0,31 г.
Задача 4.3. Какую навеску карналлита MgCl2 KCl 6H2O надо взять для анализа, чтобы получить 0,12 г прокаленного осадка Mg2P2O7 ? Известно, что карналлит содержит по массе около 20% прочих примесей.
18
Ответ: 0,39 г.
Задача 4.4. Какую навеску смеси, содержащей по массе 40% MgSO4 и 60% CoSO4 , надо взять для получения 0,2500 г прокаленного осадка BaSO4 ?
Ответ: 0,15 г.
Задача 4.5. Для определения алюминия, осаждаемого в виде Al OH 3 , требуется, чтобы раствор перед осаждением содержал около 0,05 г алюминия. Вычислить, какую следует взять навеску Al2 SO4 3 18H2O для такого определения.
Ответ: Около 0,62 г.
Задача 4.6. Какую навеску Ca3 PO4 2 следует взять для анализа, чтобы получить не более 0,3 г прокаленного осадка CaO?
Ответ: Не более 0,55 г.
Задача 4.7. Какую навеску смеси, состоящей из 40% NaCl и 60% KCl, надо взять для анализа, если требуется, чтобы проба содержала 0,10-0,15 г хлора?
Ответ: 0,18-0,27 г.
Задача 4.8. Какую навеску смеси, состоящей из 30% Na2SO4
и 70% K2SO4 , следует взять для анализа на содержание SO24 , чтобы вес прокаленного осадка BaSO4 был не более 0,2 г?
Ответ: не более 0,15 г.
Задача 4.9. Какую навеску Al SO4 3 надо взять, чтобы получить 0,093 г сухого осадка оксихинолята алюминия Al C9H6ON 3 ?
Ответ: 0 ,0346 г.
Задача 4.10. Какую навеску руды, содержащей около 20% железа, надо взять для определения железа в виде оксида железа? Масса гравиметрической формы должна быть не менее 0,1 г.
Ответ: Около 0,3 г.
Задача 4.11. Какую навеску железного купороса FeSO4 3H2O нужно взять для определения в нем железа в виде Fe2O3 , считая, что оптимальная масса Fe2O3 равна 0,2 г?
Ответ: Около 0,7 г.
Задача 4.12. Какой объём 0,10 н. раствора AgNO3 требуется для осаждения всего хлора из навески NaCl в 0,05 г?
19
Ответ: 8,6 см3 .
Задача 4.13. Сколько см3 0,20 н. раствора BaCl2 требуется для осаждения серы в виде BaSO4 из навески 0,5 г FeS2 ?
Ответ: 16,7 см3 .
Задача 4.14. Сколько см3 H2SO4 1,060 г/см3 требуется для осаждения всего бария в виде BaSO4 из раствора, содержащего 0,55 г чистого BaCl2 2H2O ?
Ответ: 2,28 см3 .
Задача 4.15. Какой объём HCl плотностью 1,200 г см3 требуется для растворения 10 г известняка, содержащего 95,5% CaCO3 и не растворяющихся в HCl примесей?
Ответ: 14,8 см3 .
Задача 4.16. Какой объём HNO3 плотностью 1,420 г см3 требуется для окисления и растворения навески пирита FeS2 в 0,5188 г? Принять, что HNO3 восстанавливается здесь до NO2 . Написать уравнение реакции.
Ответ: 4,1 см3 .
Задача 4.17. Сколько см3 0,25 М раствора оксалата аммония потребуется для осаждения Ca 2 из раствора, полученного при растворении 0,7 г CaCO3 ?
Ответ: Около 28 см3 .
Задача 4.18. 0,4 г сплава, содержащего по массе 20% серебра, растворим, и ионы серебра осадили 0,30 М раствором KSCN. Какой объём осадителя затратили на эту операцию?
Ответ: 2,5 см3 .
Задача 4.19. Какой объём 4%-го раствора NH4 2C2O4 H2O требуется для осаждения кальция раствора хлорида кальция, в котором предполагается содержание 0,05 г Ca 2 ?
Ответ: 4,5 см3 . |
|
|
|
|
||
Задача 4.20. |
Магнезиальная |
смесь содержит 50 г |
||||
MgCl 6H |
2 |
O и 100 г NH |
4 |
Cl в 1 дм3 |
. Сколько следует взять маг- |
|
2 |
|
|
|
|
||
