
- •1 Молекула воды
- •2 Свойства воды
- •3 Вода как растворитель
- •4 Диаграмма состояния воды и правило фаз
- •1 Виды дисперсных систем
- •2 Коллоидные растворы
- •3 Свойства коллоидных растворов
- •4. Устойчивость и разрушение коллоидных растворов
- •Лекция 3. Морфологическая характеристика отдельных групп микроорганизмов
- •2 Распространение микроорганизмов в природе
- •3 Высшие протисты
- •3.1 Структура эукариотической клетки
- •3.2 Простейшие
- •3.3 Водоросли
- •1 ‒ Mucormucedo; 2 ‒ водный фикомицет; 3 ‒ дрожжи
- •7 ‒ Рибосомы; 8 ‒ полисахаридные гранулы; 9 ‒ нуклеоид;
- •10 ‒ Включения серы; 11 ‒ жировые капли; 12 ‒ гранулы полифосфатов; 13 ‒ жгутики; 14 ‒ газовые вакуоли; 15 ‒ вакуоль; 16 ‒ гранула поли-β-оксимасляной кислоты; 17 — цианофициновая гранула
- •1 ‒ Микрококки; 2 ‒ диплококки; 3 ‒ стрептококки; 4 ‒ тетракокки;
- •5 ‒ Сарционы; 6 ‒ стафилококки; 7 ‒ палочки; 8 ‒ вибрионы; 9 ‒ спириллы; 10 ‒ спирохеты
1 Виды дисперсных систем
Дисперсными называются системы, в которых одно вещество в виде очень мелких частиц распределено в среде другого вещества. Дисперсные системы гетерогенны. Совокупность мелких частиц составляет дисперсную фазу, а вещество, в котором они распределены, называется дисперсионной средой.
Дисперсные системы имеют много разновидностей, отличающихся агрегатным состоянием дисперсной фазы и дисперсионной среды. Если обозначить Г – газ, Ж – жидкость, Т– твердое агрегатное состояние, при этом индекс 1 отнести к среде, а 2 – к фазе, то возможно несколько комбинаций. Например,
Г1–Ж2 – это аэрозоль, более конкретно туман, когда в газообразной среде растворены капли воды;
Г1–Т2 – тоже аэрозоли (аэрозоль пыль представляет собой газообразную систему с растворенными в ней твердыми частичками, а аэрозоль дым – ту же систему с конденсированными летучими веществами);
Ж1–Г2 – это пена;
Ж1–Ж2 – эмульсия;
Ж1–Т2 с низкодисперсными частичками – суспензия, с тонкодиспергированными частичками – коллоидные растворы, или золи.
Свойства любой такой системы существенно зависят от размера частиц дисперсной фазы. Для количественной оценки дисперсности введено понятие степень дисперсности Д – величина, обратная поперечному размеру частицы.
Гетерогенные системы, в которых дисперсионной средой является жидкость, по степени дисперсности частиц подразделяются на взвеси (суспензии и эмульсии) с D < 105 см-1 и коллоидные растворы (107 > D > 105 см-1).
Дисперсные системы подразделяют также на лиофильные, частицы которых способны в большом количестве связывать молекулы дисперсионной среды, и лиофобные, в которых взаимодействие частиц с дисперсионной средой незначительно. Если дисперсионной средой в системе является вода, пользуются соответственно терминами гидрофильный и гидрофобный.
В гетерогенных дисперсных системах, например Ж1–Т2, жидкость и твердое вещество дисперсной фазы имеют поверхностную границу, где происходит их соприкосновение. Поверхность соприкосновения называется межфазовой. Состояние молекул в соприкасающихся слоях Ж1 и Т2 отличается от состояния их внутренних слоев. На межфазовой поверхности молекулы твердого вещества дисперсной фазы испытывают притяжение молекул жидкости меньшее, чем со стороны молекул внутренних слоев Т2.
Возникающая при этом напряженность межмолекулярных сил на границе раздела фаз определяет так называемую поверхностную энергию.
2 Коллоидные растворы
По степени дисперсности частиц коллоидные растворы располагаются между взвесями и истинными растворами. По внутренней структуре коллоидных частиц различают: суспензоиды и ассоциативные или мицеллярные коллоиды.
Суспензоиды. К ним относятся такие коллоиды, которые сохраняют структуру исходного вещества, но имеют при этом высокую степень дисперсности.
Представители суспензоидов – растворы оксидов и гидроксидов металлов, сульфидов и других неорганических солей – золи гидрофобные. Их концентрация обычно не превышает 0,1%. Осадок таких растворов, остающийся после выпаривания, при соприкосновении с водой не способен вновь образовать коллоидный раствор, поэтому суспензоиды называют необратимыми коллоидами.
Вследствие малого размера частиц межфазовая поверхность очень велика и может достигать сотен квадратных метров на 1 г дисперсной фазы. Соответственно и запас свободной поверхностной энергии оказывается огромным, поэтому коллоидные растворы – системы термодинамически неустойчивые с выраженным стремлением к уменьшению поверхностной энергии. Запас поверхностной энергии может быть снижен в результате укрупнения частиц дисперсной фазы либо при адсорбции на их поверхности ионов и молекул дисперсионной среды.
Сложная структура частицы суспензоида (рисунок 4) формируется вокруг ядра, состоящего из множества молекул не растворимого в дисперсионной среде вещества. Ядро избирательно адсорбирует на своей поверхности ионы, называемые потенциало-образующими, и приобретает заряд. Присутствующие в среде ионы с противоположным знаком заряда (противоионы) вследствие электрического притяжения группируются вокруг ядра, образуя коллоидную частицу. Часть противоионов электростатическими силами прочно связана с ядром и образует вместе с адсорбированными на ядре ионами адсорбционный слой. Ядро и адсорбционный слой ионов составляют частицу, несущую определенный заряд. Другая часть противоионов под влиянием диффузионных сил слабее связана с ядром и образует вокруг частицы ионную атмосферу – диффузионный слой, компенсирующий заряд частицы.
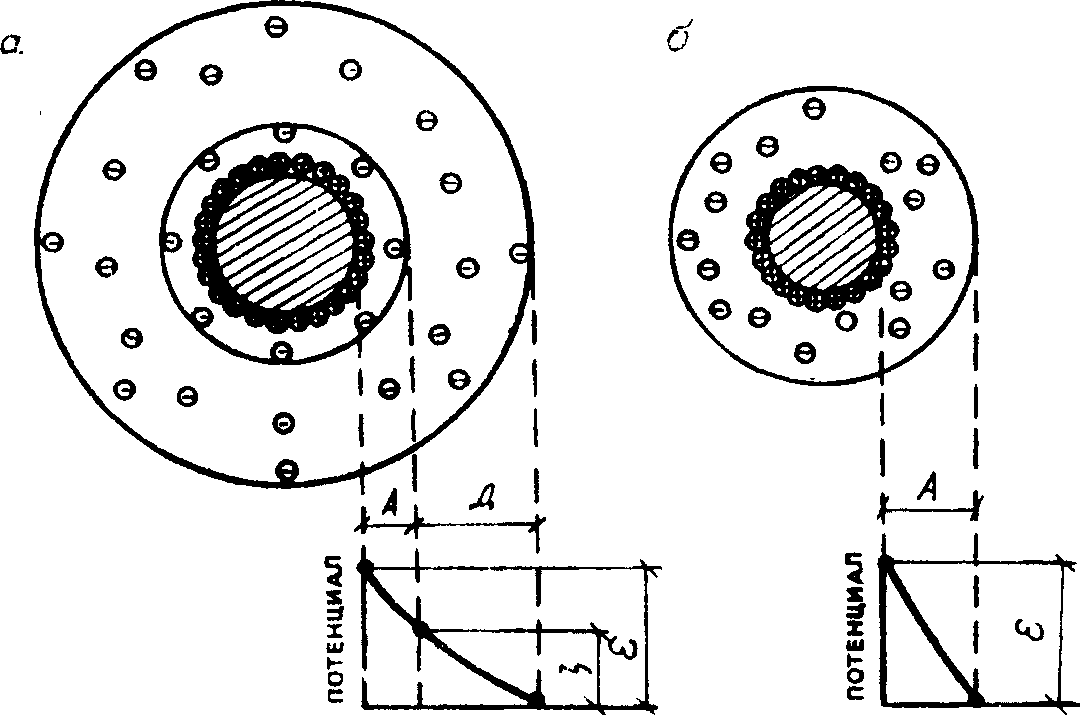
а – ξ > 0; б – ξ = 0 – изоэлектрическое состояние; А – адсорбционный слой; Д – диффузионный слой; ε – термодинамический потенциал; ζ – электрокинетический потенциал
Рисунок 4 – Строение мицеллы
Частица в совокупности с диффузионным слоем составляет мицеллу. Мицеллы электронейтральны.
Ассоциативные коллоиды. Ряд синтетических и природных веществ способен в зависимости от условий образовывать истинные и коллоидные растворы. К числу таких веществ относятся мыла, моющие средства, некоторые органические красители. Все они являются поверхностно-активными веществами.
Истинная растворимость этих веществ в воде невелика, но для них характерно образование ассоциатов молекул, достигающих размеров частиц коллоидной степени дисперсности, если концентрация раствора превышает некоторую критическую величину. Ассоциаты молекул, так же как в суспензоидах, называют мицеллами, а концентрацию, при которой начинается ассоциация молекул, называют критической концентрацией мицеллообразования (ККМ).
Все сказанное поясняет, почему растворы этих веществ называют ассоциативными или мицеллярными коллоидами.
Молекулы веществ, способных образовывать коллоидные растворы этого типа, обычно имеют в своем составе углеводородный радикал, сродство которого к воде ничтожно, и полярные группы типа –СООН, –ОН и т.п. с высоким сродством к воде. Ядро мицеллы образуют ассоциированные углеводородные радикалы, а полярные группы обращены к растворителю и образуют внешний слой ассоциата. Диффузный слой мицеллы в зависимости от структуры вещества формируется из катионов или анионов (противоионов) и компенсирует суммарный заряд мицеллы.
Поверхностно-активные вещества широко применяются в быту и промышленности, поэтому часто оказываются в сточных водах.
Высокомолекулярные соединения (ВМС). К ним относятся природные и синтетические полимеры с молекулярной массой от десятков тысяч до нескольких миллионов. Это белки, полисахариды, каучук, синтетические полимеры. Размер молекул ВМС соответствует частицам коллоидной степени дисперсности. Растворы этих веществ часто называют молекулярными коллоидами, однако на самом деле ВМС образуют истинные растворы, т.е. однофазные системы. От коллоидных растворы ВМС отличает большая устойчивость, связанная с наличием в их молекулах большого количества лиофильных групп, более высокая концентрация растворов, способность сухого вещества набухать и переходить в растворенное состояние. Тем не менее, растворы ВМС имеют и некоторые свойства коллоидов.
