
- •1 Молекула воды
- •2 Свойства воды
- •3 Вода как растворитель
- •4 Диаграмма состояния воды и правило фаз
- •1 Виды дисперсных систем
- •2 Коллоидные растворы
- •3 Свойства коллоидных растворов
- •4. Устойчивость и разрушение коллоидных растворов
- •Лекция 3. Морфологическая характеристика отдельных групп микроорганизмов
- •2 Распространение микроорганизмов в природе
- •3 Высшие протисты
- •3.1 Структура эукариотической клетки
- •3.2 Простейшие
- •3.3 Водоросли
- •1 ‒ Mucormucedo; 2 ‒ водный фикомицет; 3 ‒ дрожжи
- •7 ‒ Рибосомы; 8 ‒ полисахаридные гранулы; 9 ‒ нуклеоид;
- •10 ‒ Включения серы; 11 ‒ жировые капли; 12 ‒ гранулы полифосфатов; 13 ‒ жгутики; 14 ‒ газовые вакуоли; 15 ‒ вакуоль; 16 ‒ гранула поли-β-оксимасляной кислоты; 17 — цианофициновая гранула
- •1 ‒ Микрококки; 2 ‒ диплококки; 3 ‒ стрептококки; 4 ‒ тетракокки;
- •5 ‒ Сарционы; 6 ‒ стафилококки; 7 ‒ палочки; 8 ‒ вибрионы; 9 ‒ спириллы; 10 ‒ спирохеты
Лекция 1. ВОДА И ЕЕ СВОЙСТВА
1 Молекула воды
2 Свойства воды
3 Вода как растворитель
4 Диаграмма состояния воды и правило фаз
Вода – одно из самых распространенных веществ на нашей планете. Она имеет огромное значение в эволюции как живой, так и неживой природы. На земле происходит непрерывный круговорот воды. В результате испарения воды в поверхности океанов и суши и выделения влаги растениями и живыми существами атмосфера насыщается парами воды. Неравномерное нагревание атмосферы вызывает в ней крупномасштабные перемещения воздушных масс над поверхностью земного шара, а вследствие конденсации вода снова возвращается на землю в виде росы, дождя, града и снега.
Часть воды испаряется непосредственно с почвы и покрывающей ее растительности сразу же после выпадения на землю. Другая часть просачивается в почву, где она либо задерживается и используется растениями, либо проникает в подпочвенные горизонты, где соединяется с грунтовыми, а затем через них и с поверхностными водами. Наконец, некоторое количество воды остается на поверхности почвы, постепенно стекая в поверхностные водотоки.
Вследствие постоянного контакта с окружающей средой и включения в эту среду вода всегда содержит какие-либо вещества и практически никогда не бывает химически чистой. В то же время характер процессов, протекающих с участием воды, во многом определяется ее свойствами как индивидуального вещества.
1 Молекула воды
Вода, или оксид водорода Н2О, имеет молекулярную массу 18,016. На водород приходится 11,19 % массы, на кислород – 88,81 %.
В природе встречаются три изотопа водорода: 1Н – протий, 2Н – дейтерий и 3Н – тритий и три изотопа кислорода 16О, 17О и 18О, образующих 9 устойчивых изотопных модификаций молекул воды. В природной воде на долю 1Н216О по массе приходится 99,73%. на долю 1Н218О – 0,2%, на 1Н217О – 0,04% и на 1Н2Н16О – около 0,03 %. Остальные пять разновидностей содержатся в ничтожных количествах. Помня о многообразии состава воды, мы, тем не менее, пользуемся привычной формулой Н2О, так как она является символом основного компонента.
В молекуле воды ядра водорода и кислорода образуют равнобедренный треугольник, в основании которого находятся два мелких ядра водорода, в вершине – более крупное ядро кислорода. Валентный угол у центрального атома кислорода, образованный связями Н–О–Н, составляет 104o27' (рис. 1, а). Структура электронного облака молекулы схематично показана на рис. 1, б. Две внешние пары электронов, образующих связи О–Н, смещены к атому кислорода, поэтому вблизи ядер атомов водорода создается избыток положительного заряда. Две неподеленные пары электронов также смещены относительно ядра атома кислорода, и их отрицательные заряды остаются частично нескомпенсированными. Условно можно представить, что лепестки электронного облака направлены к вершинам частично искаженного тетраэдра, что иллюстрируется рис. 1, в. Ассиметричность распределения электрических зарядов обусловливает ярко выраженные полярные свойства молекулы воды, которая представляет собой диполь с очень высоким электрическим моментом.
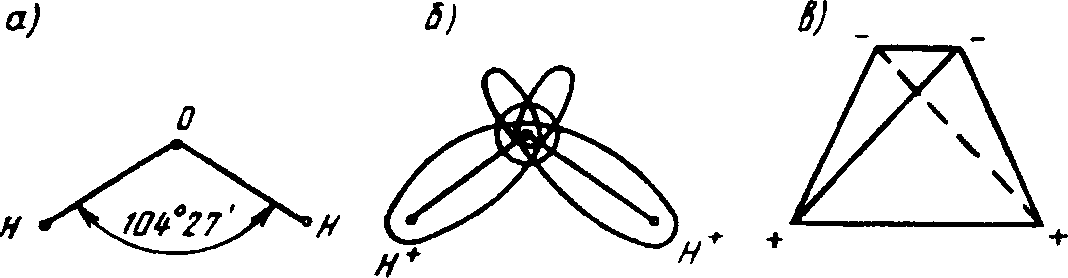
а – угол между валентными связями О–Н; б – структура электронного облака;
в – расположение зарядов
Рисунок 1 – Строение молекулы воды
Измерения молекулярной массы жидкой воды показали, что она выше молекулярной массы воды в парообразном состоянии; это свидетельствует об ассоциации молекул – объединении их в сложные агрегаты. Вследствие тетраэдрической направленности электронного облака каждая молекула воды может образовать четыре водородные связи, которые обусловливают ассоциацию молекул воды и способствуют возникновению ее упорядоченной внутренней структуры.
Водородные связи непрочны, легко разрушаются и образуются даже при обычных тепловых движениях молекул.
Полностью все четыре водородные связи реализуются при замерзании воды. В твердом состоянии каждая молекула тетраэдрически окружена четырьмя другими – тремя из того же слоя и одной их соседнего слоя молекул. Схема взаимодействия молекул воды в структуре льда показана на рисунке 2. Структура льда является наиболее упорядоченной и наименее плотной. Ее особенность заключается в наличии пустот, размеры которых превышают размеры молекул.
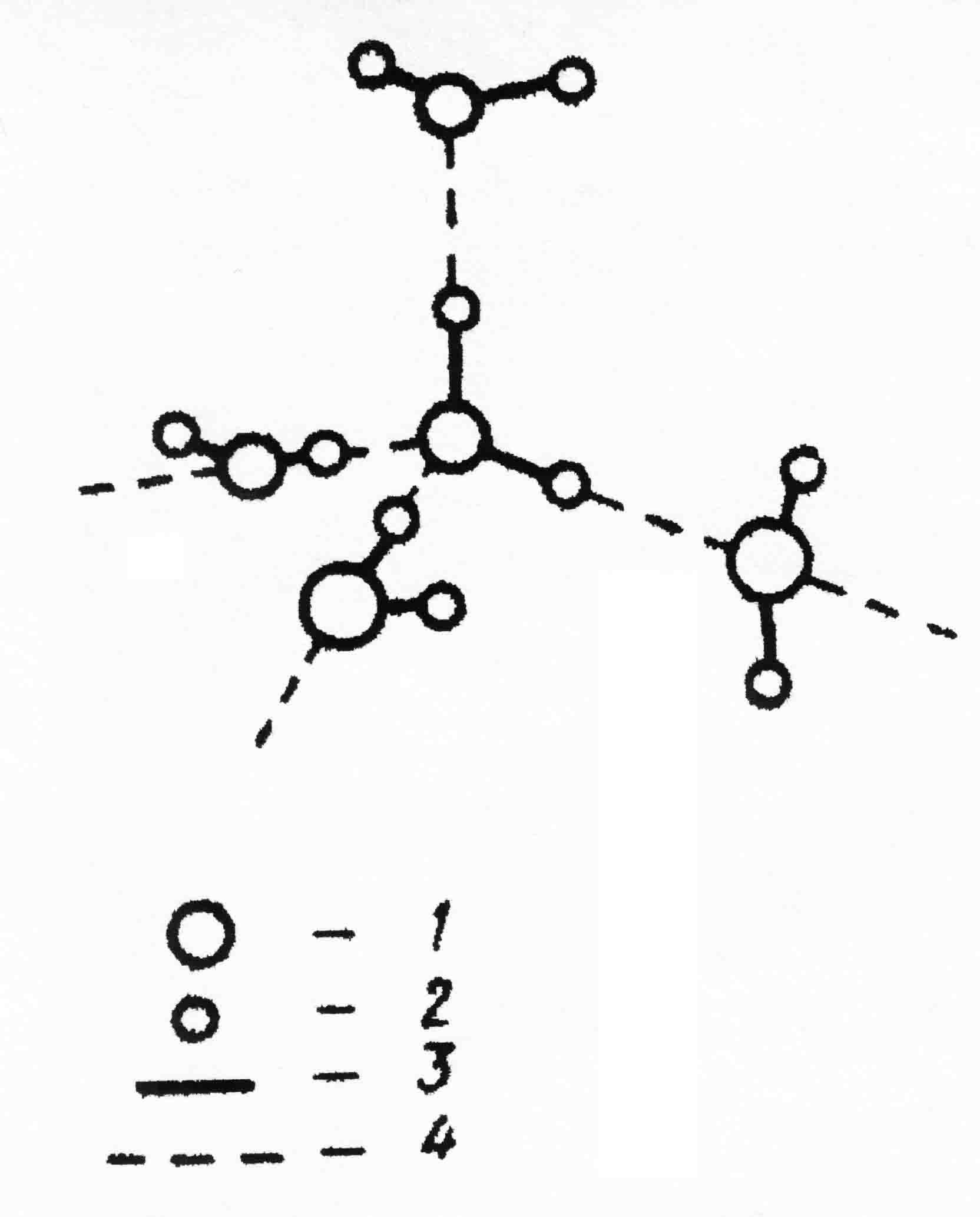
1 – кислород; 2 – водород; 3 – химические связи; 4 – водородные связи
Рисунок 2 – Схема взаимодействия молекул воды в структуре льда
2 Свойства воды
Чистая вода – жидкость без запаха, вкуса и цвета (лишь в слое толщиной более 2 м голубоватая). Основные физические характеристики воды (при давлении 0,1 МПа) представлены в таблице 1.
Таблица 1 – Основные физические характеристики воды
|
Показатель |
Значение |
|
Температура: | |
|
замерзания, плавления |
0 °С |
|
кипения |
100 °С |
|
Плотность при температуре, °С: | |
|
0 |
0,99984 г/см3 |
|
3,98 |
0,99997 г/см3 |
|
20 |
0,9982 г/см3 |
|
Удельная теплоемкость воды при t = 20°C |
4,178 Дж/(г.К) |
|
Вязкость при температуре, °С: | |
|
0 |
0,001793 Па·с |
|
25 |
0,000895 Па·с |
|
Удельная электрическая проводимость при t = 20°С |
4,2·10-6 см/м |
|
Относительная диэлектрическая постоянная воды при t = 20°С |
81 |
|
Поверхностное натяжение при t = 18 °С |
73·10-3 Н/м |
По сравнению с другими химическими соединениями вода обнаруживает необычные отклонения по ряду физических свойств — плотности, удельной теплоемкости и др. Эти аномалии воды в значительной степени связаны с ассоциацией ее молекул.
Уникальным свойством воды является ее способность при обычных температурах и давлении находиться в трех агрегатных состояниях: твердом (лед), жидком и газообразном (пар).
Повышение температуры воды действует двояко: вызывает нарушение регулярной структуры и приводит к тепловому расширению. В интервале температур от 0 до 4 °С (плавление льда) происходит разрушение части водородных связей, т.е. нарушается структура льда, достигается более плотная упаковка молекул в результате размещения отдельных молекул воды в пустотах оставшихся агрегатов. В этом интервале температур фактор нарушения структуры преобладает над тепловым расширением, и плотность воды повышается, достигая максимального значения при 3,98 °С. При 3,98 °С оба фактора взаимно уравновешиваются. Дальнейшее нагревание воды до 100 °С сопровождается нормальным снижением плотности, так как преобладает действие теплового расширения. Эта аномалия обусловливает возможность жизни в водоемах, замерзающих в зимнее время. Поскольку лед легче воды (его плотность меньше), то он располагается на поверхности и защищает лежащие ниже слои воды от промерзания. При дальнейшем понижении температуры увеличивается толщина слоя льда, но температура воды подо льдом остается на уровне 4 °С, что позволяет водным организмам сохранять жизнь.
Большое значение в жизни природы имеет также и тот факт, что вода обладает аномально высокой теплоемкостью – 4,18 Дж/(г·К). Высокая теплоемкость воды есть следствие расхода части теплоты на разрыв водородных связей. В природных условиях вода медленно остывает и медленно нагревается, являясь регулятором температуры на Земле.
Вязкость – способность жидкости оказывать сопротивление различным формам движения. Вязкость воды закономерно изменяется в зависимости от температуры: уменьшается с ее возрастанием. С повышением концентрации растворенных в воде солей вязкость увеличивается. В то же время действие давления на вязкость воды довольно специфично: с понижением температуры при умеренном давлении вязкость воды снижается, хотя логично было бы ожидать ее повышения, а если давление увеличить значительно, то поведение воды подчиняется общему правилу.
Относительная диэлектрическая постоянная воды равна 81 – это очень высокая величина, чем и объясняется такая большая ионизирующая сила воды.
Вода имеет максимальное для жидкостей (кроме ртути) поверхностное натяжение, благодаря чему обеспечивается возможность движения соков в растениях, крови в сосудах животных и человека. С повышением температуры поверхностное натяжение воды уменьшается.
Оптические свойства воды оцениваются по ее прозрачности, которая в свою очередь зависит от длины волны луча, проходящего через воду. Ультрафиолетовые лучи легко проходят через воду, поэтому растительные организмы способны развиваться в толще воды и на дне водоемов, инфракрасные лучи проникают только в поверхностный слой и в незначительной степени. Вследствие поглощения оранжевых и красных компонентов видимого света вода приобретает голубоватую окраску.
Химически чистая вода очень плохо проводит электрический ток, но, все же, обладает некоторой электропроводимостью, так как она способна в очень незначительной степени диссоциировать на ионы водорода и гидроксид-ионы
Н2О ↔ Н+ + ОН-
Вода – весьма реакционно-способное соединение. Она реагирует с оксидами многих металлов (Na20, CaO и др.) и неметаллов ClO2, CO2 и др.), образует кристаллогидраты с некоторыми солями [Al2(S04)3·18H20], вступает во взаимодействие с активными металлами (Na, К и др.).
Вода – катализатор многих химических реакций, и иногда для прохождения реакции необходимы хотя бы ее следы. Взаимодействуя с некоторыми солями, вода вызывает процесс обменного разложения их – гидролиз. Вода – участник и среда для протекания множества биохимических реакций в живых организмах. Жизнь человека, растений, животных и микроорганизмов связана с водными растворами. В частности, процессы питания включают перевод вещества в раствор.
