
Коллоквиум1
.pdf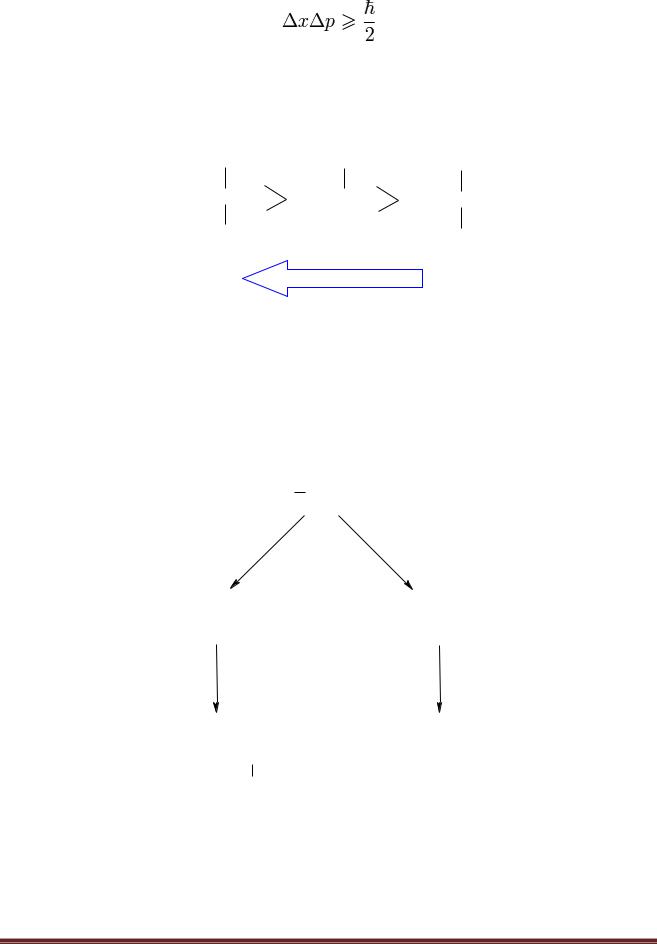
Почему делокализация уменьшает энергию? Это следует из принципа неопределѐнности Гейзенберга.
В итоге, стабильность третичного карбокатиона больше, чем вторичного, а у вторичного больше, чем у первичного.
|
|
R |
|
|
H |
|
|
H |
|
|
|
C+ |
|
|
C+ |
||||
R |
|
R |
|
H |
|
C+ |
|||
|
|
||||||||
|
|
|
|||||||
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
R |
||
Порядок стабильности карбокатионов
Чем больше стабильность образующегося промежуточного интермедиата (в данном случае карбокатиона) тем меньше энергия активации и, следовательно, больше скорость реакции. Таким образом, третичный карбокатион образуется предпочтительнее вторичного и тем более первичного.
Возьмѐм для примера присоединение HBr к пропену:
H3C CH  CH2
CH2
|
|
|
|
|
|
|
H+ |
||||||
+ |
+ |
|
|
|
|
||||||||
H3C |
|
CH |
|
|
CH2 |
H3C |
|
CH |
|
|
CH3 |
||
|
2 |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
Br |
||||
|
|
Br |
|
|
|||||||||
H3C |
|
CH |
|
CH2 |
H3C |
|
|
CH |
|
CH3 |
|
|
|||||||||
|
2 |
|
|
|
||||||
|
|
|
|
|
||||||
|
|
|
|
Br |
|
|
|
|
|
|
|
|
|
|
|
|
Br |
||||
1-бромпропан |
2-бромпропан |
|||||||||
В случае пропена возможно образование двух карбокатионов — первичного (слева) и вторичного (справа).
http://norgchem.professorjournal.ru |
Нижник Я.П. |
Страница 31 |

Вторичный более стабилен, т.к. у карбокатионного центра 2 донорных заместителя (CH3-), в отличие от первичного карбокатиона, у которого только 1 заместитель с донорными свойствами (CH3-CH2-).
Следовательно, вторичный карбокатион образуется в большем количестве. Присоединение Br- к двум карбокатионам даѐт 2 продукта; количество 2-бромпропана значительно больше количества 1-бромпропана, что соответствует правилу Марковникова.
Объясните влияние заместителей на реакционную способность двойной связи в реакциях AE.
В этом случае электронодонорные заместители (ЭД) увеличивают реакционную способность, электроноакцепторные (ЭА) уменьшают.
ЭД стабилизируют карбокатион, а ЭА его дестабилизируют за счѐт увеличения или уменьшения делокализации положительного заряда соответственно. Энергия карбокатиона с ЭД будет меньше, чем карбоктаиона с ЭА, следовательно, энергия активации в первом случае будет меньше, и, следовательно, скорость реакции больше (см. уравнение Аррениуса):
Какую пространственную направленность имеют реакции присоединения в ряду алкенов?
Реакции AE протекают как транс-присоединение (см. выше – пример с циклогексеном), а присоединение водорода на катализаторе проходит как цис-присоединение (это не
AE!).
D2
D D
Ni, t
H H H H
Напишите реакцию гидрирования алкенов.
В результате гидрирования образуются алканы. Покажем на примере пропена:
H3C |
|
CH |
|
CH2 |
Ni, t |
H3C |
|
CH |
|
CH3 |
|
|
+ H2 |
|
|
||||||
|
|
|
2 |
|||||||
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
http://norgchem.professorjournal.ru |
Нижник Я.П. |
|
|
|
|
Страница 32 |
||||

В случае бутадина-1,3 возможно сопряжѐнное присоединение:
H2C |
|
CH |
|
CH |
|
CH2 |
H2 |
H3C |
|
CH |
|
CH |
|
CH3 |
H2 |
H3C |
|
CH |
|
CH2 |
CH3 |
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
Ni |
|
|
|
Ni |
|
2 |
||||||||||||
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Вероятный механизм.
H |
H |
H |
|
||
H |
H |
H |
водород |
|
|
бутадиeн-1,3 |
пeрeходноe состояниe |
бутeн-2 |
7. Напишите реакцию бромирования циклопропана. Укажите особенности еѐ протекания, связанные с электронным строением цикла.
Циклопропан, как и циклобутан, является малым циклом. В этом случае проявляется значительное угловое (байеровское) и торсионное напряжение. В результате, энергия молекулы увеличена (по сравнению с молекулами без напряжений), и как следствие, такие системы обладают повышенной реакционной способностью.
Обычные циклы (циклопентан, циклогексан, циклогептан) по свойствам мало отличаются от алканов. Однако малые циклы благодаря наличию напряжений по свойствам напоминают алкены.
Циклопропан легко реагирует с галогенами и галогеноводородами с раскрытием цикла:
|
CH2 |
|
CH |
|
|
CH |
||
|
|
HBr |
2 |
Br2 |
2 |
|
||
|
|
|
|
|
|
|||
H3C |
CH2 |
H C |
|
CH |
H C |
CH |
||
|
||||||||
|
|
2 |
2 |
2 |
|
|
2 |
|
|
Br |
|
|
|
|
|
|
|
|
|
|
|
Br |
Br |
|||
Циклопентан, циклогексан реагируют с бромом в более жѐстких условиях. При этом не происходит разрыва связи C-C, а идѐт обычное радикальное замещение, характерное для алканов.
Электронное строение циклопропана.
Между атомами углерода в циклопропане осуществляется необычный вид -связи – «банановая» или -связь (тау-связь): максимум перекрывания орбиталей не находится на прямой, соединяющей ядра двух атомов:
http://norgchem.professorjournal.ru |
Нижник Я.П. |
Страница 33 |

H H
H2
C
600
H2C CH2
H
 H H H
H H H
Wiki Циклопропан — бесцветный горючий газ с характерным запахом, напоминающим запах петролейного эфира, едкого вкуса. Используется как ингаляционный анестетик. В концентрации 4 об. % вызывает аналгезию, 6 об. % — выключает сознание, 8 — 10 об. % — вызывает наркоз (III стадии), в концентрации 20 −30 об. % — глубокий наркоз.
8. Приведите электронное строение бензола.
H |
H |
H |
H |
H |
H |
У каждого атома углерода в молекуле бензола имеется p-орбиталь. На каждой p- орбитали находится 1 электрон. В результате перекрывания этих орбиталей и делокализации электронов образуется единое -электронное облако, которое можно изобразить в виде двух торов над и под плоскостью углеродного скелета.
Мы будем изображать на атомно-орбитальных моделях локализованные p-орбитали. Но надо иметь в виду, что на самом деле они делокализованы.
Системы подобные бензолу обладают рядом особенных свойств, которые известны как ароматичность. Какие это свойства?
1. Необычно высокая энергия сопряжения 37 ккал/моль (для сопряжѐнных диенов около 3 ккал/моль).
Энергия сопряжения – это выигрыш в энергии за счѐт сопряжения. Сопряжение
приводит к делокализации, а она обуславливает |
уменьшение энергии и, |
|
|
|
|
|
|
|
http://norgchem.professorjournal.ru |
Нижник Я.П. |
Страница 34 |

следовательно, увеличение стабильности и, как следствие, уменьшение реакционной способности.
37 ккал/моль – это эмпирическая энергия резонанса, определѐнная из теплот гидрирования. На самом деле, бензол является ещѐ более устойчивой структурой: при делокализации электронов в гипотетическом гиклогексатриене-1,3,5 выделилось бы 64 ккал/моль – эта величина называется вертикальной энергией резонанса.
2.Если бы в бензоле сопряжения не было, он был бы гораздо более реакционноспособным.
Например, этилен (1 двойная связь) легко реагирует с бромом при комнатной температуре — идѐт реакция присоединения.
Бензол (3 двойные связи) не реагирует с бромом в этих условиях. Бензол присоединяет бром только при высокой температуре или облучении УФ-светом.
3.Для ароматических соединений характерен т.н. «круговой ток», проявляющийся в спектрах ЯМР.
Критерии ароматичности
Что позволяет отнести соединение к ароматическим?
1.Структура должны быть циклической и плоской
2.Сопряжение охватывает весь цикл. В цикле нет разрывов сопряжения.
3.Число сопряжѐнных p-электронов должно удовлетворять правилу Хюккеля.
N = 4n + 2
N – чиcло p-электронов сопряжѐнных в цикле. n – целое число 0,1,2,3….∞
рассмотрим разные случаи.
n = 0, N = 2
|
H |
|
|
|
|
+ |
|
+ |
|
|
|
|
Циклопропенилий |
|
|
|
|
|
|
H |
|
H |
|
катион |
|
|
|
http://norgchem.professorjournal.ru |
Нижник Я.П. |
Страница 35 |

n = 1, N = 6.
H
H H
H
 H
H
H |
Бензол |
|
H H
H  -
-  H
H
H |
- |
Циклопентадиенил – анион |
|
||
|
|
-
|
Fe2+ |
Fe |
Ферроцен — сэндвичевое соединение, |
||
|
- |
|
содержащее ион железа и два |
||
|
|
|
|
|
|
|
|
|
циклопентадиенильных аниона |
||
H |
H |
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
H |
|
|
Циклогептатриенил-катион |
|
|
|
|
|
|
H |
+ |
|
|
|
(тропилий-катион) |
H |
H |
|
+ |
|
|
|
|
|
|
|
|
H |
|
H |
|
|
|
|
|
|
. |
|
|
H |
.. |
H |
N |
H |
Пиррол |
|
N |
|
|
|
|
H
http://norgchem.professorjournal.ru |
Нижник Я.П. |
Страница 36 |

H
|
N |
|
|
. |
|
|
|
|
|
H |
.. |
H |
N |
N H |
|
N |
|
|
|
|
H |
|
|
|
Имидазол
|
H |
|
|
.. |
|
|
|
|
|
. |
|
H |
|
H |
|
|
|
|
|
|
|
N |
|
H |
N |
H |
|
|
|
|
|
|
|
|
Пиридин |
|
H |
|
|
.. |
|
|
|
|
|
. |
|
|
N |
H |
|
|
|
|
|
. |
N |
|
|
|
|
|
Пиримидин |
||
|
|
H |
N |
|
|
H |
N |
|
|
H |
|
H |
|
|
|
|
|
. |
|
H |
.. |
H |
O |
Фуран |
|
O |
|
|
|
H |
|
H |
|
|
|
|
. |
H |
.. |
|
Тиофен |
H |
S |
||
|
S |
|
|
http://norgchem.professorjournal.ru |
Нижник Я.П. |
Страница 37 |

n = 2, N = 10
H |
H |
|
. |
. |
|
|
|
|
|
||
H |
|
H |
. |
. |
. |
|
|
|
. |
||
|
|
|
. |
. |
H |
. |
. |
Нафталин |
H |
|
|
|
H |
H |
|
|
H |
H |
H |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
. |
|
. |
H |
|
H |
|
|
. |
|
|
|
|
|
|
|
|
|
|
. |
. |
|
|
Азулен |
|
|
|
|
|
. |
|
H |
|
H |
|
|
|
|
H |
|
|
|
|
||
|
. |
|
|
. |
.. |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
. |
|
|
|
- |
|
+ |
|
|
|
|
H |
H |
. |
. |
|
|
|
|
|
|
||
H |
H |
. |
. |
. |
|
|
|
|
. |
||
|
|
. |
. |
|
|
H |
N H |
|
.. |
. |
Хинолин |
|
|
|
|
||
H |
|
|
N |
|
|
|
|
|
|
|
|
|
H |
|
|
. |
. |
|
|
|
|
|
|
|
|
. |
||
|
|
|
|
. |
N |
|
. |
|
|
|
|
N |
|
|
|||
|
|
|
|
|
|
|
||
|
N |
|
|
. |
. |
|
|
|
|
|
|
H |
|
|
N . |
||
|
|
|
|
|
... |
|||
|
|
|
|
|
|
|||
H |
|
|
N |
|
N |
|
|
|
|
N |
|
|
|
Пурин |
|||
|
|
|
|
|
|
|||
|
|
|
H |
|
|
|
N |
|
http://norgchem.professorjournal.ru |
Нижник Я.П. |
Страница 38 |

n= 3, N = 14
|
|
|
|
|
H |
H |
H |
H |
|
H H |
H |
H |
|
|
H |
H |
H |
|
|
|
|
|
|
H |
|
|
H |
H |
H |
H |
H |
H |
|
H |
H |
|
Антрацен |
|
Фенантрен |
||
NB! Атомы водорода на атомах углерода во всех приведѐнных примерах можно не писать:
Как найти число сопряжѐнных p-электронов в цикле?
Число двойных связей умножаем на 2.
Если есть пиррольные атомы азота, то каждый из них в систему сопряжения подаѐт одну пару электронов (это же касается атомов кислорода фурана и серы тиофена.)
Как определить какие атомы азота являются пиррольными, а какие пиридиновыми?
Если атом N имеет 1 связь N-R и 2 связи N-C, то он является пиррольным,
Если азот образует 1 одну двойную и одну одинарную связи с углеродом, то это пиридиновый атом азота.
N |
.. |
N |
|
.. |
|
|
H |
Пиридин |
пиррол |
NB! Неподелѐнная пара электронов на пиридиновом атоме азота не находится в сопряжении и отвечает за основность пиридина; неподелѐнная пара электронов на пиррольном атоме азота находится в сопряжении и участвует в образовании ароматической -системы.
http://norgchem.professorjournal.ru |
Нижник Я.П. |
Страница 39 |

.. |
. |
. |
|
N |
N H |
Рассмотрим имидазол, пиримидин и пурин. Определить пиридиновые и пиррольные атомы азота. Зелѐным показаны пиррольные атомы азота, синим - пиридиновые атомы азота.
..N |
.. |
. |
.. |
|
N |
N |
|||
|
|
. N |
|
|
N |
.. |
|
.. |
|
N |
N |
N |
||
.. |
||||
|
H |
.. |
H |
|
|
|
Почему порфин (основа порфиринов) обладает ароматическими свойствами?
..
N H ..N
.. H
N N..
Это циклическая сопряжѐнная система; единую -систему образуют 22 p- электрона двойных связей (11 двойных связей умножаем на 2) и 2 пары
электронов пиррольных атомов азота. Следовательно, всего в сопряжении участвуют 26 p-электронов.
26 = 4n + 2 ; n = 6
Число p-электронов удовлетворяет правилу Хюккеля.
Все атомы в цикле находятся в состоянии sp2-гибридизации, следовательно, молекула плоская.
Исключения, противоречащие критериям ароматичности (факультативно).
1.Иногда правило Хюккеля может не соблюдаться. Например, в молекуле бензопирена 20 p- электронов (10 двойных связей), n = 4.5:
http://norgchem.professorjournal.ru |
Нижник Я.П. |
Страница 40 |
