Химия. Лекция 3 Алкены БАК
.docАЛКЕНЫ (ОЛЕФИНЫ)
Алкенами называются ненасыщенные углеводороды с двойной «С-С» связью. Общая формула СпН2п.
Основные представители:
С2Н4 (СH2=CH2) – этилен
С3Н6 (СН3 – СН = СН2) – пропилен
Номенклатура (систематическая) – см. практику
Физические свойства
|
№ |
Название алкана |
Агрегатное состояние |
t пл, 0С |
t кип, 0С |
Относительная плотность, d420 |
|
1 |
этен |
газ |
-169 |
-102 |
0,570 |
|
2 |
пропен-1 |
газ |
-185 |
-48 |
0,609 |
|
3 |
бутен-1 |
газ |
-185 |
-6,5 |
0,740 |
|
4 |
бутен-2 (цис) |
газ |
-139 |
-4 |
0,724 |
|
5 |
бутен- 2 (транс) |
газ |
-106 |
1 |
0,604 |
|
6 |
пентен-1 |
жидкость |
-151 |
37 |
0,640 |
|
7 |
пентен-2 (цис) |
жидкость |
-160 |
28 |
- |
|
8 |
пентен – 2 (транс) |
жидкость |
-140 |
36 |
- |
|
9 |
гексен-1 |
жидкость |
-138 |
63,5 |
0,674 |
|
10 |
гептен-1 |
жидкость |
-119 |
93 |
0,697 |
|
11 |
октен-1 |
жидкость |
-104 |
122,5 |
0,715 |
Способы получения
-
Лабораторные способы
-
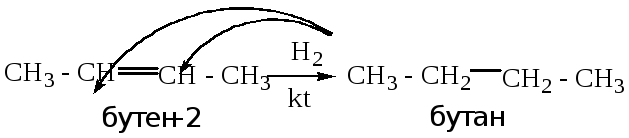
Гидрирование алкинов.
См. лекцию № 2
-
Реакции элиминирования (Е).
Данные реакции относятся к реакциям отщепления и протекают по правилу Зайцева.
Правило Зайцева
При отщеплении воды или галогеноводорода от несимметричных спиртов или галогеноалканов, водород отщепляется от соседнего наименее гидрогенизированного (гидрированного) атома углерода.
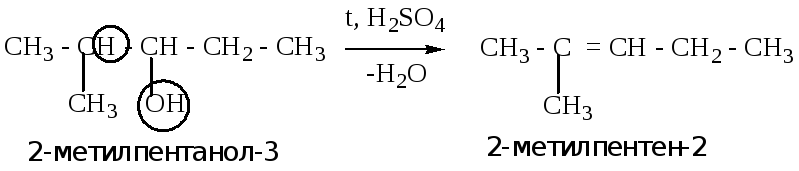
2.2.1. Дегидратация спиртов (отщепление воды от молекулы спирта). Реакция протекает при нагревании, в присутствии водоотнимающих соединений (H2SO4, Al2O3, H3PO4).
ВНИМАНИЕ!!!! Аналогичная реакция используется в лабораторной работе № 2.
Пример:
-
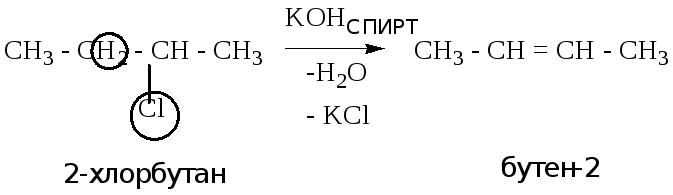
Дегидрогалогенирование гаогеноуглеводородов (отщепление молекулы галогеноводорода).
Реакция протекает в присутствии спиртовых растворов щелочей (КОН, NaOH). В молекуле происходит отщепление галогеноводорода, при дальнейшем взаимодействии со щелочью, побочными продуктами реакции являются соль и вода).
Пример:
-
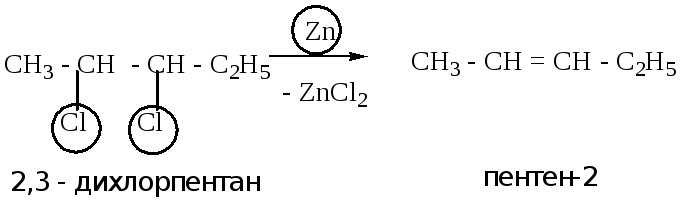
Дегалогенирование дигалогеноалканов.
Правило Зайцева не используется. Атомы галогена расположены у соседних атомов углерода (вицинальные) дигалогеноалканы. Происходит отщепление молекулы галогена, в присутствии цинка или магния, с выделением в качестве побочного продукта, соответствующей соли.
Пример:
-
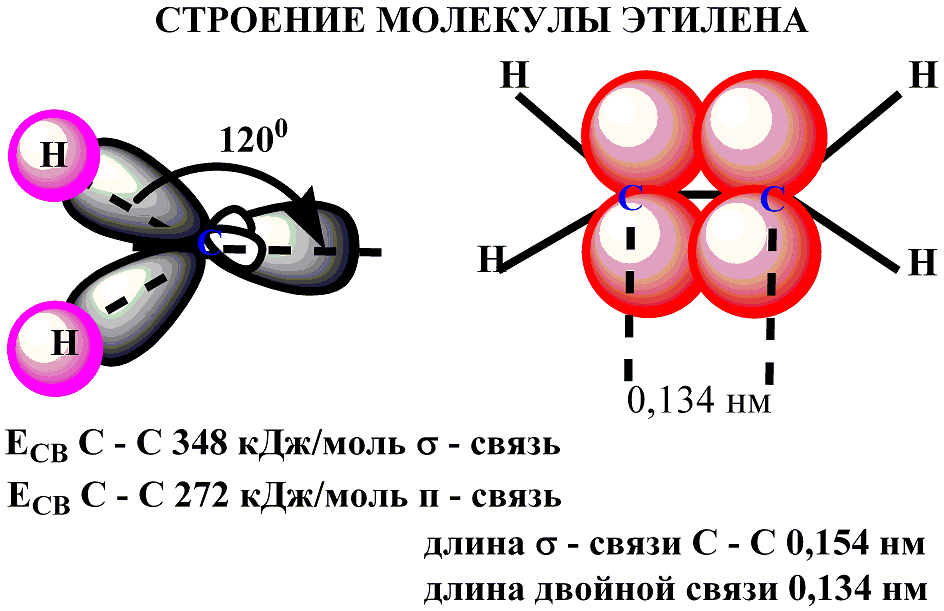
СТРОЕНИЕ МОЛЕКУЛЫ ЭТИЛЕНА. ГИБРИДИЗАЦИЯ
Рассмотрим строение
молекулы этилена. Атомы углерода,
соединенные двойной связью, находятся
в состоянии sp2-гибридизации,
т.е., каждый из указанных атомов углерода,
образует 3 sp2–гибридные
орбитали. Две из которых идут на
образование связей с соседними атомами
водорода, одна – на образование
![]() -связи
с соседним атомом углерода. (рис.1).
Оставшаяся негибридизованная орбиталь
(одна у каждого атома углерода), при
перекрывании образует
-связи
с соседним атомом углерода. (рис.1).
Оставшаяся негибридизованная орбиталь
(одна у каждого атома углерода), при
перекрывании образует
![]() -
связь. Р–орбитали располагаются
перпендикулярно плоскости молекулы. В
результате образования двойной связи,
атомы углерода сближаются. Т.е. двойная
связь короче
одинарной.
-
связь. Р–орбитали располагаются
перпендикулярно плоскости молекулы. В
результате образования двойной связи,
атомы углерода сближаются. Т.е. двойная
связь короче
одинарной.
Характеристика связей в молекуле алкена и алкана
|
тип связи |
энергия связи, кДж/моль |
длина связи, нм |
полярность, (дипольный момент), D
|
|
С-С (алкан) |
348 |
0,154 |
0 |
|
С=С (алкен) |
620 |
0,134 |
0 |
|
С-С ( |
348 |
0,134 |
0 |
|
С-С ( |
272 |
0,134 |
0 |
Исходя из данных
таблицы, мы видим, что общая энергия
двойной связи больше, но, в тоже время,
энергия
![]() -связи
значительно
меньше.
Следовательно:
-связи
значительно
меньше.
Следовательно:
-
В первую очередь происходит разрыв
 -связи,
как наименее
прочной, т.е. для алкенов характерны
реакции присоединения.
-связи,
как наименее
прочной, т.е. для алкенов характерны
реакции присоединения. -
Т.к.
 -связь
образована
электронами, которые притягивают
положительно
заряженную частицу, то присоединение
– электрофильное
(АE).
-связь
образована
электронами, которые притягивают
положительно
заряженную частицу, то присоединение
– электрофильное
(АE). -
Т.к.
 -связь
образована
электронами, которые могут притягивать
и радикалы
(электронодефицитные частицы), то
присоединение может быть радикальным
(АR).
-связь
образована
электронами, которые могут притягивать
и радикалы
(электронодефицитные частицы), то
присоединение может быть радикальным
(АR). -
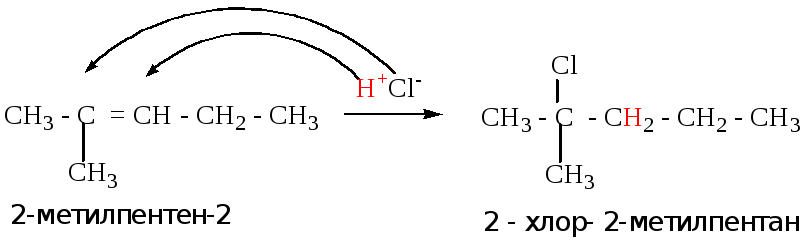
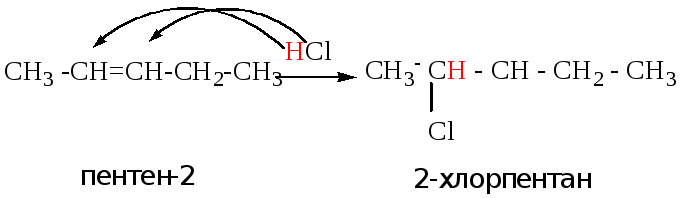
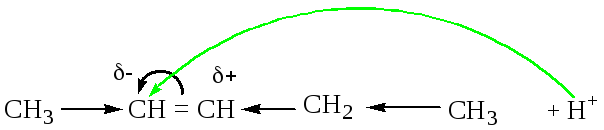
Т.к. электронная плотность в молекуле несимметричного алкена распределена неравномерно, реакции присоединения протекают по или против правила Марковникова.
Правило Марковникова
При присоединении воды или галогеноводородов и т.д. положительно заряженная частица (электрофил) направляется к наиболее гидрогенизированному (гидрированному) атому углерода.
Пример1 :
Пример 2:
Объяснение правила Марковникова
Пример1.
Алкильные радикалы
являются донорами, поэтому смещают
электронную плотность в сторону атомов
углерода двойной связи. Чем больше
радикалов у атома углерода двойной
связи, тем больше передаваемая суммарная
электронная плотность, соответственно,
по двойной связи, электронная плотность
смещается в сторону наиболее удаленного
атома углерода двойной связи. На нем
возникает избыток электронной плотности
и частично отрицательный заряд (![]() -).
К этому атому и стремится электрофильная
частица.
-).
К этому атому и стремится электрофильная
частица.
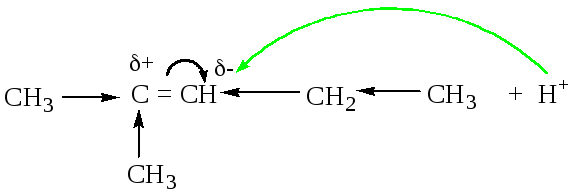
Пример 2
В примере 2 количество атомов водорода у атомов углерода двойной связи одинаково, поэтому правило Марковникова применить нельзя. Руководствуемся схемой перераспределения электронной плотности, рассмотренной в примере 1.
-
Химические свойства
Для алкенов характерны следующие типы реакций:
-
Электрофильное присоединение (AE).
-
Окисление.
-
Гидрирование.
4.1. Реакции электрофильного присоединения. Протекают по правилу Марковникова.
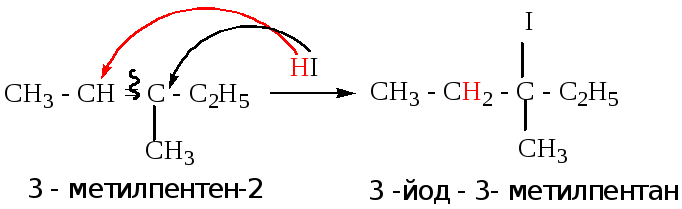
4.1.1. Гидрогалогенирование
Реакционная способность галогеноводородов возрастает в ряду – от HF к HI.
Пример:
4.1.2. Реакция галогенирования
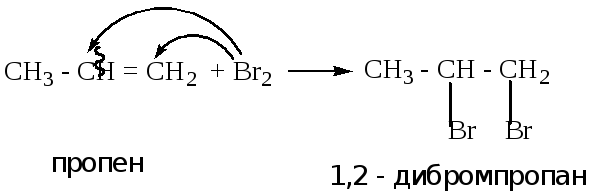
ВНИМАНИЕ!!! Реакция используется в лабораторной работе № 1.
Указанная реакция протекает аналогично реакции 4.1.1. В качестве реагента используется бромная вода, хлор. Реакция протекает при комнатной температуре. Происходит обесцвечивание бромной воды. Это качественная реакция на ненасыщенную связь.
ВНИМАНИЕ!!!! Аналогичная реакция используется в лабораторной работе № 2.
Пример:
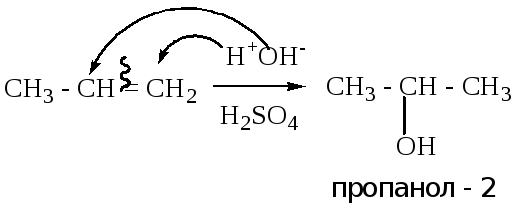
4.1.3. Реакция гидратации (взаимодействия с водой).
Реакция протекает аналогично реакции 4.1.1. В качестве катализатора используются минеральные кислоты (серная, азотная). Реакция протекает при нагревании. Конечными продуктами являются одноатомные спирты.
Пример:
4.2. Окисление
Алкены легко
окисляются различными окислителями. В
зависимости от характера окислителя и
условий реакций происходит разрыв
![]() связи
или полностью
связи
или полностью
![]() ,
,
![]() связей.
связей.
4.2.1. Окисление в мягких условиях (окисление по Вагнеру).
ВНИМАНИЕ!!! Реакция используется в лабораторной работе № 1.
В качестве окислителя
используется раствор перманганата
калия. Происходит разрыв
![]() связи,
с образованием двухатомного спирта,
щелочи и оксида марганца (IV).
В процессе данной реакции марганец
меняет степень окисления с +7 (перманганат
калия) до +4 (оксид марганца). Различные
катионы имеют различный цвет. Марганец
+7 (малиновое, розовое окрашивание); +4 -
бесцветная окраска. Следовательно
раствор
перманганата калия обесцвечивается.
Это качественная
реакция на ненасыщенную связь.
связи,
с образованием двухатомного спирта,
щелочи и оксида марганца (IV).
В процессе данной реакции марганец
меняет степень окисления с +7 (перманганат
калия) до +4 (оксид марганца). Различные
катионы имеют различный цвет. Марганец
+7 (малиновое, розовое окрашивание); +4 -
бесцветная окраска. Следовательно
раствор
перманганата калия обесцвечивается.
Это качественная
реакция на ненасыщенную связь.
ВНИМАНИЕ!!!! Аналогичная реакция используется в лабораторной работе № 1.
Пример:
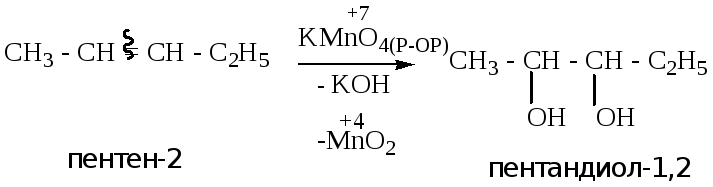
-
Гидрирование
Ненасыщенные углеводороды под действием водорода в присутствии катализатора (никель, палладий, платина) способны к разрыву двойных связей и образованию алканов.
Пример: