
Химия. Лекция № 5 Алкины ПАК
.docАЛКИНЫ
Алкинами называются ненасыщенные углеводороды с тройной «С-С» связью. Общая формула СпН2п-2.
Основные представители:
![]()
Номенклатура (систематическая) – см. практику
Физические свойства
|
№ |
Название алкана |
Агрегатное состояние |
t пл., 0С |
t кип., 0С |
Относительная плотность, d420 |
|
1 |
этин |
газ |
-80,8 |
-83,6 |
0,613 |
|
2 |
пропин |
газ |
-104,7 |
-23,3 |
0,690 |
|
3 |
бутин-1 |
газ |
-122,5 |
-8,6 |
0,668 |
|
4 |
бутин-2 |
жидкость |
-28 |
27,2 |
0,693 |
|
5 |
пентин-1 |
жидкость |
-98 |
39,7 |
0,695 |
|
6 |
пентин-2 |
жидкость |
-101 |
55,5 |
0,712 |
Способы получения
-
Промышленные
-
1.1. Пиролиз углеводородов.
-
Ацетилен получают из метана при высокой температуре (до 1500 °C).
-
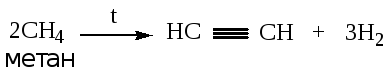
1.2. Получение ацетилена из карбида кальция.
Реакция используется в лабораторной работе «Углеводороды».

-
Лабораторные способы
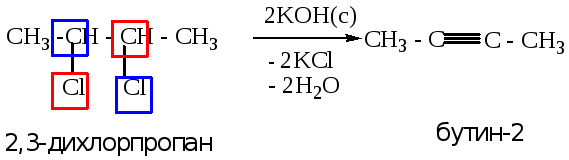
2.1. Получение алкинов из дигалогенопроизводных алканов.
Реакции протекают по правилу Зайцева (см. лекцию 3, п. 2.2).
2.1.1. из вицинальных дигалогенопроизводных (атомы галогена расположены у соседних атомов углерода).
Пример 1:

Пример 2:
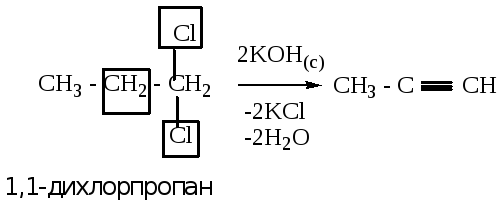
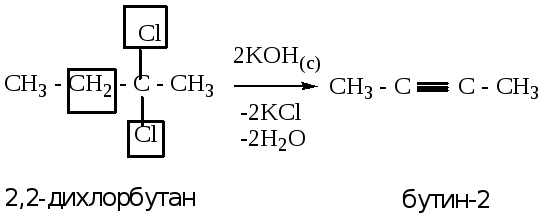
2.1.2. из геминальных дигалогенопроизводных (атомы галогена расположены у одного атома углерода).
Пример1:
Пример 2:
2.2.3. Получение из ацетилена с использованием амида натрия.
Если в качестве исходного продукта используется ацетилен, то на первой стадии синтеза происходит замещение водорода у атома углерода тройной связи на натрий, с образованием ацетиленида; при последующем алкилировании происходит образование алкина с «концевой» тройной связью (пример 1).
При получении алкина с тройной связью внутри молекулы, происходит дополнительное замещение атома водорода у соседнего атома углерода тройной связи, с последующим алкилированием (пример 2).
Пример 1:
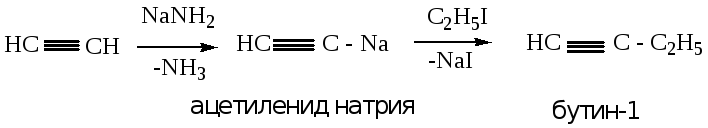
Пример 2:
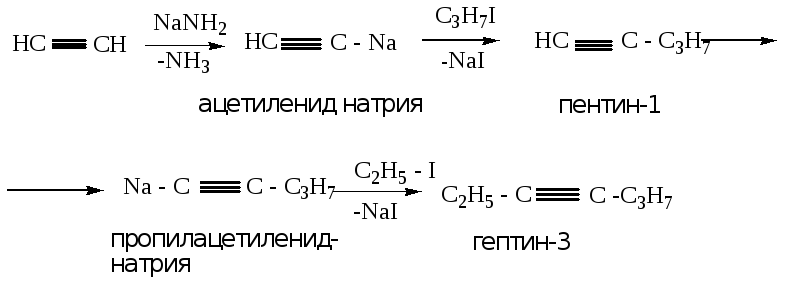
-
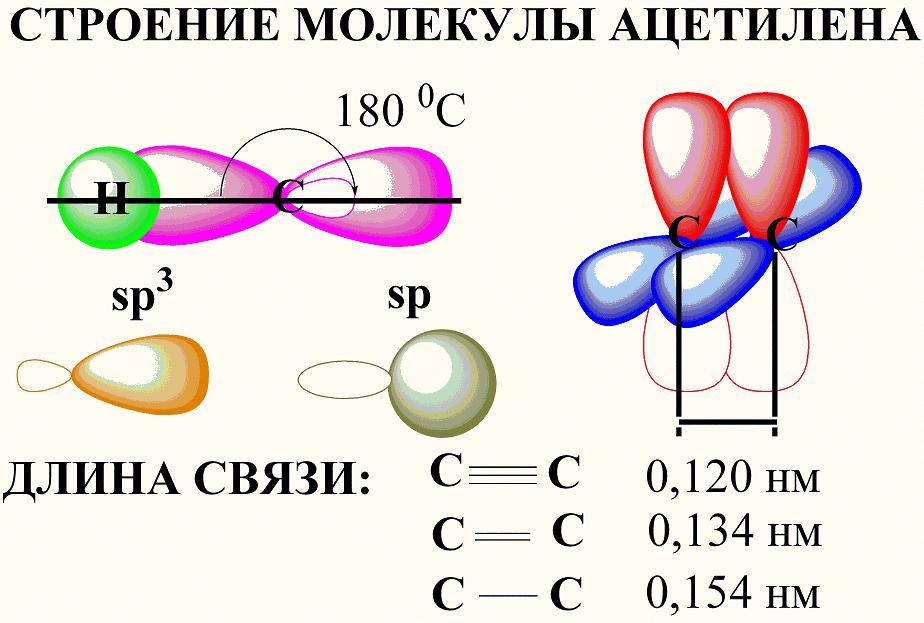
Строение молекулы ацетилена, гибридизация.
Рассмотрим строение
молекулы ацетилена. Атомы углерода,
соединенные тройной связью, находятся
в состоянии sp-гибридизации,
т.е., каждый из указанных атомов углерода,
- образует две sp2–гибридные
орбитали, - одна из которых идет на
образование связей с соседним атомом
водорода, другая – на образование
![]() -связи
с соседним атомом углерода. (рис.1).
Оставшиеся 4 негибридизованных орбитали
(по две у каждого атома углерода), при
перекрывании образуют две
-связи
с соседним атомом углерода. (рис.1).
Оставшиеся 4 негибридизованных орбитали
(по две у каждого атома углерода), при
перекрывании образуют две![]() -
связи. Р–орбитали располагаются
перпендикулярно плоскости молекулы. В
результате образования тройной связи,
атомы углерода сближаются. Т.е. тройная
связь короче
одинарной. π –электроны тройной связи
несколько втянуты внутрь связи, и,
соответственно, положительно заряженные
ядра атомов углерода становятся
доступнее.
-
связи. Р–орбитали располагаются
перпендикулярно плоскости молекулы. В
результате образования тройной связи,
атомы углерода сближаются. Т.е. тройная
связь короче
одинарной. π –электроны тройной связи
несколько втянуты внутрь связи, и,
соответственно, положительно заряженные
ядра атомов углерода становятся
доступнее.
Помимо этого, доля S-орбитали в sр-гибридной орбитали преобладает, следовательно, связь «С-Н» поляризуется, и электронная плотность смещается к атому углерода.
Характеристика связей в молекуле алкина, алкена и алкана
|
тип связи |
энергия связи, кДж/моль |
длина связи, нм |
полярность, (дипольный момент), D
|
|
С-С (алкан) |
348 |
0,154 |
0 |
|
С=С (алкен) |
620 |
0,134 |
0 |
|
С-С ( |
348 |
0,134 |
0 |
|
С-С ( |
272 |
0,134 |
0 |
|
С ≡ С |
814 |
0,120 |
0 |
Исходя из данных таблицы и строения молекулы алкина, мы видим, что общая энергия тройной связи больше, т.е. тройная связь прочнее. Следовательно:
-
В первую очередь, происходит разрыв
 -связи,
как наименее
прочной, т.е. для алкинов характерны
реакции присоединения.
-связи,
как наименее
прочной, т.е. для алкинов характерны
реакции присоединения. -
Т.к.
 -связь
образована
электронами, которые притягивают
положительно
заряженную частицу, присоединение –
электрофильное
(АE).
-связь
образована
электронами, которые притягивают
положительно
заряженную частицу, присоединение –
электрофильное
(АE). -
Т.к. положительно заряженные ядра атомов углерода тройной связи более доступны, они притягивают нуклеофильную (отрицательно заряженную частицу), присоединение - нуклеофильное (An).
-
Т.к. электронная плотность в молекуле несимметричного алкина распределена неравномерно, реакции присоединения протекают по правилу Марковникова: реакции Ае – с последовательным разрывом каждой π-связи, до одинарной связи; реакции Аn – с разрывом одной π-связи, до двойной связи. (пр.Марковникова см.лекцию 3, п……).
-
Т.к. π-электроны тройной связи втянуты внутрь молекулы, реакции электрофильного присоединения Ae протекают в алкинах медленнее, чем в алкенах.
-
Т.к. доля s-орбитали в sp-гибридной орбитали преобладает, одинарная связь С-Н поляризуется, т.е. электронная плотность смещается к углероду, водород приобретает подвижность и способен к отщеплению в виде протона. Следовательно, для алкинов с тройной связью на конце молекулы характерны реакции электрофильного замещения (Se).
-
Химические свойства.
Для алкинов характерны следующие типы реакций:
-
Электрофильное присоединение (AE).
-
Электрофильное замещение (SЕ).
-
Гидрирование.
4.1. Реакции электрофильного присоединения. Протекают по правилу Марковникова в две стадии, с последовательным разрывом тройной, а затем, - двойной связи.
Механизм реакций электрофильного присоединения аналогичен реакциям, протекающим в алкенах (в данном курсе не рассматривается).
4.1.1. Гидрогалогенирование.
На первой стадии процесса образуется непредельное моногалогенопроизводное, которое, при последующем действии галогеноводорода, образует предельное дигалогенопроизводное.
Пример:

4.1.2. Галогенирование.
На первой стадии процесса образуется непредельное дигалогенопроизводное, которое, при последующем действии галогена, образует предельное тетрагалогенопроизводное. Аналог реакции - в лабораторной работе № 1.
Пример:

4.1.3. Гидратация алкинов (реакция Кучерова).
В зависимости от того, какая частица в реакции является определяющей (нуклеофильная или электрофильная), данную реакцию можно отнести к реакциям присоединения как электрофильного, так и нуклеофильного. Условно отнесем данную реакцию к реакциям электрофильного присоединения.
При взаимодействии алкинов с водой происходит образование промежуточного продукта – енола (непредельного одноатомного спирта), который, путем последующей перегруппировки, образует кетон. Исключение составляет ацетилен, который в данной реакции образует уксусный альдегид. Реакция протекает в кислой среде, в присутствии солей ртути.
Пример 1:
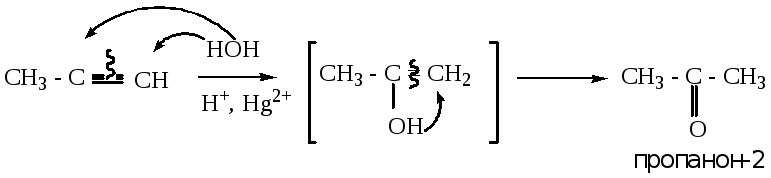
Пример 2:
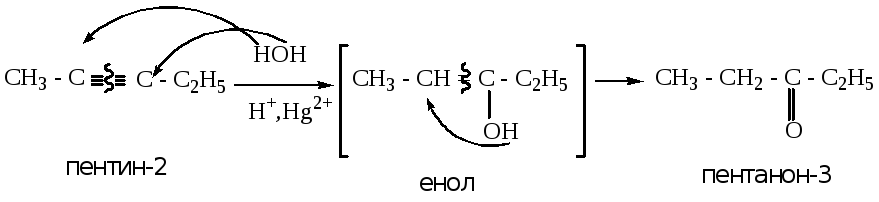
Пример 3 (для ацетилена):

4.3. Реакции электрофильного замещения. Данная группа реакций характерна для алкинов с тройной связью на конце молекулы и характеризует их кислотные свойства.
Пример:

Кислотные свойства алкинов.
Кислотность – это способность соединений к отщеплению водорода в виде протона. Из-за особенностей строения молекулы алкина (см. п…….), последние проявляют эти свойства. Кислотность алкинов достаточно низка (ниже, чем у воды, но выше, чем у аммиака).
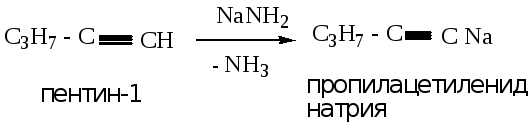
4.3.1. Реакция с амидом натрия
Происходит замещение протона на натрий с образованием солей алкинов – ацетиленидов.
Пример:
4.3.3. Реакция с аммиачным раствором оксида серебра (реактив Толленса) или хлорида меди.
Данная реакция приводит к образованию ацетиленида серебра (белый творожистый осадок, переходящий в серый) или меди (красно-бурый осадок). Аналог реакции – в лабораторной работе № 1.
Реакция является качественной на алкины с концевой тройной связью.
Пример 1:
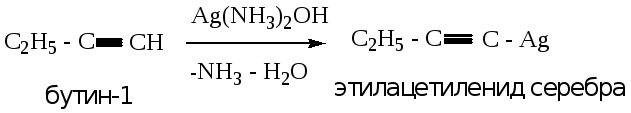
Пример 2:
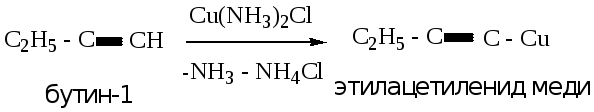
-
Гидрирование
При взаимодействии алкинов с водородом, в присутствии Ni, Pd, Pt , происходит последовательное насыщение тройной связи до двойной, затем,- до одинарной. Конечным продуктами реакции гидрирования являются алканы.
Пример 1:

Пример 2:

