
- •Для сплава, диаграмма которого приведена на рисунке, характерно(Образование интерметаллического соединения) Желез реагирует с азотнокислым серебром с образованием(Серебра и нитрата железа (II))
- •Золото устойчиво на воздухе ввиду того, что(Имеет большой стандартный электродный потенциал)
- •К сетчатым полимерам не относятся(Резина)
- •Карбоцепным является полимер:(-сf2-)n –тефлон
- •Лавсан (терилен) образуется при взаимодействии(Диметилтерефталата с этиленгликолем) Латунь это сплав(Меди и цинка)
- •Медь реагирует с концентрированной азотной кислотой с образованием(Нитрата меди ( II ) , воды и двуокиси азота )
- •Наиболее активный металл : k , Au , Pt , Fe , Pb(k) Наиболее устойчивым полимером является:Тефлон ( Фторпласт-4)
- •Натуральный каучук это:Цис-полиизопрен
- •Оксид хрома (VI ) проявляет(Кислотные свойства)
- •Органические вмс содержат в своем составе(Углерод, водород, азот, кислород и серу)
- •Пенополиуретаны это(Вспененные полиуретаны)
- •При взаимодействии бромистоводородной кислоы (нВr) с двуокисью марганца образуются(Бром, вода, бромид марганца)
- •При гидролизе капрона образуются(Капроновая кислота)
- •При реакции поликонденсации формальдегида с фенолом не образуется(Резина)
- •Природным полимером является(Желатин)
- •Разбавленная серная кислота не реагирует с(Медью)
- •С водой при комнатной температуре взаимодействует(Калий)
- •Силиконы это(Полисилоксаны)
- •Старательским способом добывают(Золото)
- •Степень полимеризации это(Отношение среднего молекулярного веса полимера к молекулярному весу мономера)
С водой при комнатной температуре взаимодействует(Калий)
С соляной кислотой ( НСl ) реагирует с выделением водорода(железо)
Самопроизвольный процесс в любом температурном интервале возможен при условии(Δ H < 0, Δ S > 0)
Силиконы это(Полисилоксаны)
Смесь железа, меди и алюминия обработали концентрированной азотной кислотой на холоду. При этом растворились следующие металлы: (Cu. )
Смесь оксидов меди (II) и железа (III) массой 95,5 г восстановили водородом. При действии на продукты избытка хлороводородной кислоты выделилось 4,48 л водорода (н.у.). Масса меди, образовавшейся при восстановлении: (64 г; )
Смешали 100 г 10%-ного раствора хлороводородной кислоты и 100 г 10%-ного раствора гидроксида натрия. Массовая доля хлорида натрия в образовавшемся растворе составляет (7,31%; )
Согласно второму закону термодинамики, в изолированных системах самопроизвольно идут процессы, которые сопровождаются возрастанием(энтропии)
Соединение, в котором азот имеет степень окисления + 3: (Ca(NO2)2.)
Соединение, в котором углерод имеет степень окисления - 4: (CH4; )
Сокращённому ионному уравнению : Н+ + ОН- = Н2О соответствует следующая реакция в молекулярном виде(NaOH + HNO3 = NaNO3 + H2O)
Соль, которой соответствует название "гидрокарбонат железа (II)": (Fe(HCO3)2; )
Соль, которой соответствует название "дигидроксосульфит алюминия": (Al(OH)2)2SO3.
Состав соли (NH4)2SO4 можно установить, используя два раствора, содержащие соответственно ионы (OH- и Ba2+; )
Сплав алюминия и меди обработали избытком раствора гидроксида щелочного металла. При этом выделилось 5,6 л (н.у.) газа. Нерастворившийся остаток отфильтровали, промыли и растворили в азотной кислоте. Раствор выпарили досуха, остаток прокалили. Масса полученного продукта составила 1,875 г. Массовая доля (%) меди в сплаве составляет (25%. )
Способность атомов притягивать к себе электронную плотность(электроотрицательность)
Сравните плотность воды в жидком состоянии (dжид.) и в твердом состоянии (dтв.): (dжид. > dтв.;)
Стандартные электродные потенциалы соответствуют концентрации иона Men+, (1 моль/л)
Старательским способом добывают(Золото)
Степень окисления свинца одинакова в ряду: (Pb(NO3)2, PbO, Na2[Pb(OH)4]; )
Степень полимеризации это(Отношение среднего молекулярного веса полимера к молекулярному весу мономера)
Строение внешней электронной оболочки (азот)
в устойчивом состоянии имеет(азот)
Тепловой эффект образования 1 моль вещества из простых веществ, устойчивых при температуре 298К и давлении 100 кПа, называетс(энтальпией образования)
Тепловой эффект реакции зависит от природы и состояния исходных веществ и конечных продуктов, но не зависит от пути реакции, то есть от числа и характера промежуточных стадий».(закон Гесса)
Тип гибридизации центрального атома и геометрическая форма молекулы аммиака: (sp3, тригональная пирамида; )
Трехцентровую связь имеет молекула(НNО3)
Тройную связь имеет молекула(C2Н2)
Угол 109028/ образуется между гибридными(sр3-орбиталями)
Угол 109028/ характерен для(тетраэдрической молекулы)
Угол 1200 характерен для (угловой молекулы)
Уравнение
Де-Бройля имеет вид(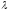 =h/mv)
=h/mv)
Уравнение окислительно-восстановительной реакции, в котором правильно подобраны коэффициенты: (H2SO4 + H2S = 2H2O + SO2 + S;)
Уравнение
Шредингера имеет вид(H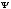 =E
=E )
)
Уравнение, отвечающее электрохимической коррозии металла: (2Zn + O2 + 2H2O = 2Zn(OH)2)
Флотационный метод обогащения руды основан на(различной смачиваемости минералов)
Форму атомной орбитали определяет(орбитальное квантовое число l)
Формулы соединений только с ковалентной связью представлены в ряду(H2O,СН3СООН)
Характер оксидов в ряду MnO - Mn2O3 - MnO2 - MnO3 - Mn2O7 изменяется (от основного к кислотному;)
Характеристическая функция H = U + p∙V называется (энтальпией)
Химическое равновесие всистемесместится в сторону исходных веществ при (понижении температуры;)
Чему равна молярная концентрация раствора, полученного разбавлением 250 мл 2М раствора до объёма 1 л?(0,5 М)
Число σ-связей в три раза больше числа π-связей(хлористой кислоты)
Число молей гидроксида калия, содержащихся в 500 мл 0,2 М раствора КОН, равно(0,1)
Чтобы ослабить или прекратить гидролиз раствора хлорида железа (III), необходимо немного добавить (соляной кислоты; )
Щелочной раствор получается при гидролизе соли(карбонат калия)
Э.д.с. гальванического элемента Zn / ZnSO4, 0,000001 M // ZnSO4, 0,01 M /Zn равна(0,12 В)
Экзотермическими являются реакции:C3H8 + 5O2 = 3CO2 + 4H2O ΔH0 реакции = -103,9 кДж/моль H2O2 = H2O + 1/2O2 ΔH0 реакции = -98,8 кДж/моль1/2Na2O + 1/2H2O = NaOHΔH0 реакции= -68,4 кДж/моль
Электродные потенциалы не зависят от(атомной массы металла)
Электролиз расплава хлорида натрия описывается суммарным уравнением:(2NaCl → 2Na + Cl2)
Электролизом растворов нельзя получить (Na и Mg)
Электроотрицательность возрастает в ряду: (Te, Se, S, O;)
Электроотрицательность элементов в таблице Д.И. Менделеева в периодах слева направо …., а в группах сверху вниз ….(увеличивается, уменьшается)
Электрохимическая коррозия железа в нейтральной водной среде описывается уравнением(4Fe + 3O2 + 6H2O = 4Fe(OH)3)
Энергию и размер орбитали характеризует(главное квантовое число n)
Энергия Гиббса рассчитывается по формуле(Δ G = Δ H – T Δ S)
Энергия, выделяющаяся при присоединении электрона к свободному атому(сродство атома к электрону)
Ядерную планетарную модель атома предложил(Резерфорд)
Ядовитый газ фосген имеет следующий элементный состав в массовых долях (%): C - 12,1; O - 16,2; Cl - 71,7. Его формула (COCl2)
Ядро атома состоит из (протонов и нейтронов )
