
Лек 4Т 06.04.09
.docИ.П Калинкин, Т.Э.Маметнабиев
Осадительное титрование. (Файл 3.2.4 12.03.08)
Общая характеристика и возможности метода. Осадительное титрование, или седиметрия, объединяет титриметрические методы анализа, основанные на реакциях осаждения. Малорастворимый электролит образуется при взаимодействии катионов M с анионами A:
![]() ( )
( )
(заряды ионов для упрощения опущены). Константа равновесия этой реакции:
![]() ( )
( )
поскольку концентрация (и активность)
малорастворимого вещества в твердой
фазе (где оно единственное) по определению
равна единице;
![]() ─ константа равновесия растворимости
малорастворимого электролита (произведение
растворимости). В осадительном титровании
в основном используют реакции образования
бинарных малорастворимых соединений,
в которых стехиометрические коэффициенты
p = q = 1. Тогда:
─ константа равновесия растворимости
малорастворимого электролита (произведение
растворимости). В осадительном титровании
в основном используют реакции образования
бинарных малорастворимых соединений,
в которых стехиометрические коэффициенты
p = q = 1. Тогда:
![]() ( )
( )
![]() ( )
( )
Для проведения осадительного титрования необходимо, чтобы реакция титрования (1) или (3) удовлетворяла следующим требованиям:
1) Осадок должен быть практически нерастворим;
2) Скорость реакции и достижение равновесия при осаждении должны быть быстрыми, чтобы можно было с большой точностью проследить за процессом титрования;
3) Реакция осаждения должна проходить количественно в соответствии с известной стехиометрией. Результаты анализа не должны искажаться побочными реакциями, адсорбцией и соосаждением посторонних примесей;
4) Должна иметься возможность фиксировать КТТ.
Совокупность перечисленных требований, особенно требований пункта 3, обусловливает весьма ограниченное применение реакций осаждения в титриметрии. Практически поставленным требованиям удовлетворяют лишь осадки галогенидов серебра, тиоцианата серебра (AgSCN), цианида серебра (AgCN), а также хлорида одновалентной ртути (Hg2Cl2).
Группу методов, основанных на титровании галоген ‑ и тиоцианат ‑ ионов стандартным раствором AgNO3 называют аргентометрией (аргентометрическим титрованием). Некоторое значение имеет меркуриметрия, основанная на реакции:
![]()
Расчет и построение кривых аргентометрического титрования.
Кривые титрования могут строиться в разных вариантах: pГ = f(VAgNO3) или pГ = f();
![]() или
или
![]() ,
где VAgNO3,
,
где VAgNO3,
![]() ,
,
![]() где V ─ объем
добавляемого титранта, а
где V ─ объем
добавляемого титранта, а
![]() ─ степень оттитрованности.
─ степень оттитрованности.
Классическим из всех осадительных титрований является определение хлорид ‑ ионов титрованием стандартным раствором AgNO3. Кривая титрования для данной системы в логарифмическом масштабе представляет собой зависимость отрицательного десятичного логарифма концентрации хлорид ‑ ионов pCl = – lg [Cl–] либо от объема прилитого титранта, либо от степени оттитрованности:
pCl = f(VAgNO3) или pCl = f()
При выводе расчетных уравнений в общем
виде формулы AgNO3
и NaCl (![]() )
следует заменить символами Т(титрант)
и А(аналит) соответственно.
)
следует заменить символами Т(титрант)
и А(аналит) соответственно.
1. В начальный момент времени, то есть до прибавления раствора AgNO3, в отсутствие конкурирующих реакций, концентрация хлорид ‑ ионов равна их концентрации в исходном растворе, например в растворе NaCl, следовательно:
![]() и pCl = ─lgсо,Cl─1.
и pCl = ─lgсо,Cl─1.
2. Как только к раствору будет добавлена первая порция AgNO3, начнет осаждаться AgCl по реакции:
![]()
Константа равновесия этой реакции
равна: К=![]() =
=![]() .
.
Так как константа велика, то можно считать, что аналит и титрант геагируют количественно. В интервале 0 < <100% (до точки эквивалентности) общая концентрация хлорид ‑ ионов равна сумме концентраций неоттитрованных хлорид ‑ ионов и хлорид ‑ ионов, образовавшихся в результате растворения AgCl:
![]()
Поскольку растворимость осадка
![]() в присутствии избытка одноименного
иона мала, то второй член является
значимым лишь вблизи точки эквивалентности
и при титровании очень разбавленных
(co,NaCl < 10–4 М)
растворов хлорида. В приближенных
расчетах им можно пренебречь. Концентрация
неоттитрованных хлорид ‑ ионов равна
разности между количеством хлорида
натрия в исходном растворе (моль) и
количеством добавленного нитрата
серебра деленной на общий объем раствора:
в присутствии избытка одноименного
иона мала, то второй член является
значимым лишь вблизи точки эквивалентности
и при титровании очень разбавленных
(co,NaCl < 10–4 М)
растворов хлорида. В приближенных
расчетах им можно пренебречь. Концентрация
неоттитрованных хлорид ‑ ионов равна
разности между количеством хлорида
натрия в исходном растворе (моль) и
количеством добавленного нитрата
серебра деленной на общий объем раствора:

При
![]()
 .
.
Пренебрегая изменением объема в процессе
титрования и, полагая
![]() ,
получаем
,
получаем
![]() ,
где степень оттитрованности
,
где степень оттитрованности![]() .
.
Концентрация титранта AgNO3
c концентрацией
титруемого иона произведением
растворимости
 и
и
![]() .
.
3. В точке эквивалентности ( = 100%) нет ни избытка титруемого иона Cl─ , ни избытка титранта (ионов Ag+ ). Поэтому равновесная концентрация хлорид ─ ионов определяется растворимостью осадка:
![]()
4. За точкой эквивалентности ( > 100%) в растворе имеется избыток титранта (ионов серебра). Общая концентрация [Ag+] в растворе складывается из концентрации ионов серебра в избытке титранта и концентрации, образовавшейся вследствие растворения осадка хлорида серебра:
![]()
Вторым членом в приближенных расчетах можно пренебречь. Тогда:

При
![]()
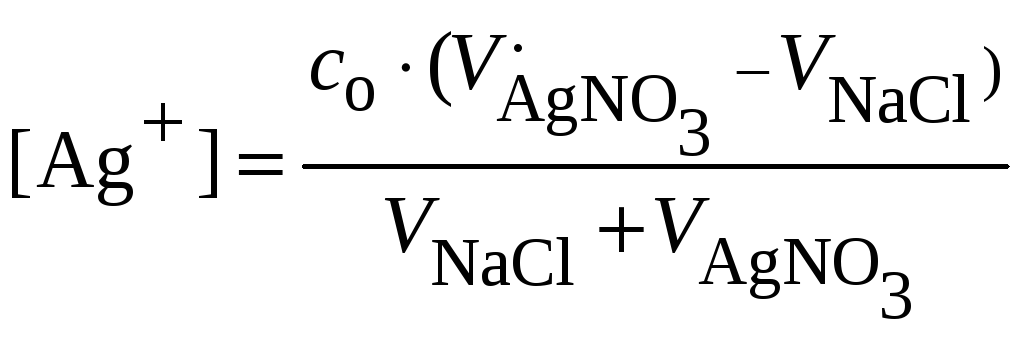 .
.
Пренебрегая изменением объема в процессе
титрования и, полагая
![]() ,
получают:
,
получают:
![]() ,
где
,
где
![]() .
.
Величины [Cl–] и pCl рассчитывают из произведения растворимости:
 и
и
![]()
По приведенной схеме проводится расчет
кривых титрования бромид (![]() )
и иодид (
)
и иодид (![]() )
ионов при титровании стандартным
раствором азотнокислого серебра, а
также кривых титрования раствора
азотнокислого серебра стандартными
растворами хлорида натрия или бромида
калия.
)
ионов при титровании стандартным
раствором азотнокислого серебра, а
также кривых титрования раствора
азотнокислого серебра стандартными
растворами хлорида натрия или бромида
калия.
В таблице приведены данные расчета
значений
![]() и
и
![]() по вышеприведенным формулам при
титровании 0,1000 М раствора хлорида натрия
0,1000 М раствором азотнокислого серебра
(в пренебрежении изменения объема в
процессе титрования), а на рис…соответствующие
им кривые титрования. Из рис. следует,
что кривые титрования имеют зеркальный
характер.
по вышеприведенным формулам при
титровании 0,1000 М раствора хлорида натрия
0,1000 М раствором азотнокислого серебра
(в пренебрежении изменения объема в
процессе титрования), а на рис…соответствующие
им кривые титрования. Из рис. следует,
что кривые титрования имеют зеркальный
характер.
Таблица Значения pCl и pAg при титровании 0,1000 М раствора хлорида натрия
0,1000 М раствором нитрата серебра.
|
τ, % |
Не оттитровано Cl─ ,% |
Избыток Ag+ ,% |
Формула расчета [Cl─ ] |
pCl |
|
Формула pасчета [Ag+ ] |
pAg |
|
0 |
100,0 |
─ |
[Cl─ ] = co |
1.0 |
|
|
|
|
50.0 |
50.0 |
─ |
[Cl─ ] = (100 ─ τ)∙10─3 |
1.3 |
|
|
8.5 |
|
90.0 |
10.0 |
─ |
То же |
2.0 |
|
|
7.8 |
|
99.0 |
1.0 |
─ |
То же |
3.0 |
|
|
6.8 |
|
99.9 |
0.1 |
─ |
То же |
4.0 |
|
|
5.8 |
|
100.0 |
─ |
─ |
|
4.9 |
|
|
4.9 |
|
100.1 |
─ |
0.1 |
|
5.8 |
|
|
4.0 |
|
101.0 |
─ |
1.0 |
То же |
6.8 |
|
|
3.0 |
|
110.0 |
─ |
10.0 |
То же |
7.8 |
|
|
2.0 |
Рисунков нет
Рис. Кривые титрования 0.1000 М раствора хлорида натрия 0.1000 М раствором азотнокислого серебра.
Влияние на величину скачка титрования концентраций титруемого аналита и титранта, а также величины произведения растворимости образующегося малорастворимого соединения иллюстрируют рис. и рис . (рисунков нет)
Рис. Кривые титрования 0.1000 М (а) и 0.0100 М (б) растворов хлорида натрия соответственно 0.1000 М и 0.0100 М растворами нитрата серебра.
Рис. Кривые титрования 0.1000 М растворов хлорида натрия, бромида и иодида калия
0.1000 М раствором нитрата серебра.
Важной особенностью осадительного титрования является также возможность титрования смеси веществ. Так, например, при титровании смеси галогенидов стандартным раствором AgNO3 теоретически будут наблюдаться три последовательных скачка на кривой титрования.
Методы регистрации КТТ. Для экспериментального нахождения КТТ, которая в идеальном случае должна соответствовать точке эквивалентности, в аргентометрии применяют три метода.
Метод Мора. Индикатором служит
хромат ─ ион, который образует красно
─ кирпичный осадок
![]() ,
более растворимый, чем галогениды
серебра (
,
более растворимый, чем галогениды
серебра (![]() ,
,
![]() ). По этому способу хлорид ‑ ион титруют
стандартным раствором нитрата серебра
в присутствии небольшого количества
хромат ‑ иона. Осадок
). По этому способу хлорид ‑ ион титруют
стандартным раствором нитрата серебра
в присутствии небольшого количества
хромат ‑ иона. Осадок
![]() не образуется, пока не будет оттитрован
галогенид ─ ион. В момент полного
осаждения хлорида серебра незначительный
избыток ионов серебра взаимодействует
с хромат ‑ ионами. КТТ фиксируется
по первому устойчивому появлению в
растворе кирпично ‑ красного осадка
хромата серебра:
не образуется, пока не будет оттитрован
галогенид ─ ион. В момент полного
осаждения хлорида серебра незначительный
избыток ионов серебра взаимодействует
с хромат ‑ ионами. КТТ фиксируется
по первому устойчивому появлению в
растворе кирпично ‑ красного осадка
хромата серебра:
![]() реакция титрования
реакция титрования
![]() реакция в КТТ
реакция в КТТ
Важно правильно выбрать концентрацию хромат ‑ иона. При слишком высокой концентрации его КТТ предшествует точке эквивалентности, а при слишком низкой – КТТ фиксируется позже точки эквивалентности. В идеальном случае хромат серебра должен начать осаждаться как раз в точке эквивалентности. При титровании хлорид ‑ иона нитратом серебра в этот момент
![]()
Тогда

В пределах погрешности титрования
![]() 0,1%
концентрацию
0,1%
концентрацию
![]() при титрованиихлорид ─ ионов (при
исходной концентрации
при титрованиихлорид ─ ионов (при
исходной концентрации
![]() )
можно изменять от 0,35 до 1,1∙10─4
М.
)
можно изменять от 0,35 до 1,1∙10─4
М.
При погрешности ─0,1%
![]() ,
следовательно,
,
следовательно,
![]() .
Отсюда
.
Отсюда
![]() .
При погрешности + 0,1%
.
При погрешности + 0,1%
![]() ,
следовательно,
,
следовательно,
![]() .
.
На практике обычно создают концентрацию
![]() поскольку при более высоких концентрациях
изменение цвета осадка маскируется
интенсивной собственной желтой окраской
хромат─ ионов.
поскольку при более высоких концентрациях
изменение цвета осадка маскируется
интенсивной собственной желтой окраской
хромат─ ионов.
Основным рабочим раствором рассматриваемого метода является 0,1М или 0,05М раствор AgNO3 (М=169,88). Его можно приготовить из точной навески азотнокислого серебра (х.ч.). Химически чистый препарат AgNO3 получают путем перекристаллизации его из слабого азотнокислого раствора и последующего высушивания соли при 150оС в сушильном шкафу до постоянного веса. 16,9888г перекристаллизованной соли растворяют в воде, переносят в мерную колбу на 1л и разбавляют водой до метки. Молярная концентрация полученного раствора точно равна 0,1 М AgNO3. Рабочий раствор AgNO3 проще готовить из продажной соли и проводить стандартизацию его по х.ч. NaCl в качестве стандартного вещества (подробно см.[8, 18]. При хранении концентрация раствора AgNO3 со временем изменяется. Поэтому ее необходимо время от времени проверять. Проверку концентрации раствора проводят по NaCl (х.ч.)..
Недостатки способа Мора:
1) Метод применим в узком интервале значений рН – от 7 до 10. В более кислых растворах идет протонирование и димеризация хромат ‑ иона:
![]() и
и
![]()
а в более щелочных выпадает оксид серебра:
![]()
-
Титровать можно хлорид ‑ и бромид ‑ ионы. Титрование иодид ‑ и тиоцианат ‑ ионов не дает удовлетворительных результатов, так как осадки AgI и AgSCN адсорбируют хромат ‑ ионы и КТТ становится неотчетливой.
-
В исследуемом растворе должны отсутствовать катионы, образующие с анионом
 малорастворимые осадки (Ba2+,
Pb2+,
Bi3+
и др.), а также некоторые анионы, образующие
с катионом
малорастворимые осадки (Ba2+,
Pb2+,
Bi3+
и др.), а также некоторые анионы, образующие
с катионом
 осадки
осадки
 и
др.)
и
др.)
Метод Фольгарда. Метод основан на
титровании раствора ионов
![]() рабочим
(стандартным) раствором NH4SCN
или KSCN в присутствии ионов
Fe(III) в
качестве индикатора:
рабочим
(стандартным) раствором NH4SCN
или KSCN в присутствии ионов
Fe(III) в
качестве индикатора:
![]() реакция титрования
реакция титрования
Титрование проводят в кислом растворе.
Пока не достигнута ТЭ, концентрация
остающихся в растворе ионов
![]() настолько
мала, что образование комплексов железа
настолько
мала, что образование комплексов железа
![]() ,
в частности
,
в частности
![]() ,
не происходит. В
КТТ малейший избыток раствора
,
не происходит. В
КТТ малейший избыток раствора
![]() (титранта)
повысит настолько концентрацию ионов
(титранта)
повысит настолько концентрацию ионов
![]() ,
что произойдет реакция:
,
что произойдет реакция:
![]() реакция в КТТ
реакция в КТТ
и раствор приобретет более или менее интенсивную оранжево ─ красную окраску.
Экспериментально установлено, что заметную окраску раствору придает концентрация FeSCN2+ ≈6,4·10–6 М. Поскольку в точке эквивалентности:
![]() ,
,
необходимую концентрацию ионов железа можно рассчитать из выражения для константы устойчивости комплексного иона:

Отсюда

Теоретические расчеты показывают, что при концентрации железа (III) в интервале
0,002 ─ 1,6
![]() ошибка титрования не будет превышать
0,1%. Однако при концентрации, превышающей
0,2
ошибка титрования не будет превышать
0,1%. Однако при концентрации, превышающей
0,2
![]() ,
собственная окраска индикатора затрудняет
обнаружение тиоцианатного комплекса.
Поэтому на практике используют
концентрацию железа (вводимого в виде
подкисленного раствора железо ‑
аммонийных квасцов) приблизительно
равную 0,01
,
собственная окраска индикатора затрудняет
обнаружение тиоцианатного комплекса.
Поэтому на практике используют
концентрацию железа (вводимого в виде
подкисленного раствора железо ‑
аммонийных квасцов) приблизительно
равную 0,01
![]() .
.
Особым преимуществом метода Фольгарда
является возможность титрования в
сильнокислой среде (при этом не мешают
такие ионы, как карбонат, оксалат и
арсенат, образующие с катионом
![]() осадки в нейтральной среде).
осадки в нейтральной среде).
Для определения анионов
![]() применяют обратное титрование.
применяют обратное титрование.
К раствору титруемого иона добавляют измеренный избыточный объем стандартного раствора нитрата серебра:
![]() реакция титрования
реакция титрования
После образования осадка избыток
![]() оттитровывают
стандартным раствором KSCN
в присутствии раствора хлорида железа
(III):
оттитровывают
стандартным раствором KSCN
в присутствии раствора хлорида железа
(III):
![]() реакция обратного титрования
реакция обратного титрования
![]() реакция в КТТ
реакция в КТТ
Расчетное уравнение в общем виде можно записать как:
![]() откуда:
откуда:
![]()
Хлорид серебра, в отличие от других галогенидов серебра, более растворим, чем тиоцианат серебра. Поэтому реакция:
![]()
затрудняет регистрацию КТТ по Фольгарду; в результате наблюдается перерасход тиоцианат ─ ионов и возникает ошибка титрования. Конец титрования можно сделать более отчетливым, прибавляя к титруемому раствору 1 ─ 2 мл нитробензола или четыреххлористого углерода, или хлороформа. Эти вещества, адсорбируясь на поверхности осадка AgCl, сильно замедляют вышеуказанную реакцию.
В отличие от метода Мора в методе
Фольгарда присутствие в исследуемых
растворах катионов (Ba2+,
Pb2+,
Bi3+
и др.) не мешает определению галогенидов
поскольку титрование ведется в кислой
среде. Титрованию мешают окислители,
которые способны окислять ионы
![]() и F─
─ ионы, связывающие
и F─
─ ионы, связывающие
![]() в
комплекс.
в
комплекс.
Обратным титрованием методом Фольгарда
возможно определение не только
галогенидов, но также следующих аналитов:
![]() .
.
Стандартизацию растворов NH4SCN или KSCN проводят по стандартному раствору AgNO3 Поскольку NH4SCN сильно гигроскопичен, то предварительно готовят раствор примерной ≈0,1М концентрации растворением 7,6 ─ 8,0г препарата (х.ч. или ч.д.а.) в воде и разбавлением до 1л в мерной колбе. Для приготовления 0,1М раствора KSCN 9,7185г перекристаллизованного и высушенного в сушильном шкафу при 120 ─ 150о С препарата растворяют в воде и доводят объем до 1л в мерной колбе. 0.02 или 0,01 М растворы готовят разбавлением 0,1 М раствора водою соответственно в 5 или 10 раз. Для стандартизации бюретку заполняют приготовленным раствором NH4SCN или KSCN и титруют точно измеренный объем стандартного подкисленного азотной кислотой раствора AgNO3. В качестве индикатора при используют раствор железо ─ аммонийных квасцов (примерно 1мл 40% раствора)(подробно см.[18].
Метод Фаянса (метод адсорбционных индикаторов). При определении галогенид ─ ионов методом адсорбционных индикаторов реакция, по которой устанавливают КТТ, протекает на поверхности осадка галогенида серебра. Галогенид серебра осаждается в процессе стехиометрической реакции титрования. В конечной точке титрования ион
Ag+взаимодействует
с окрашенным анионом индикатора, например
дихлорфлуоресцеина:
![]() реакция титрования
реакция титрования
![]() реакция в КТТ
реакция в КТТ
Чтобы лучше представить механизм действия адсорбционных индикаторов в КТТ, следует вспомнить правила адсорбции, рассмотренные в разделе «Гравиметрический анализ». В процессе титрования (до КТТ0 галогенид ─ ион находится в избытке и адсорбируется на поверхности осадка в качестве первично адсорбированного иона:
![]()
Анион индикатора отталкивается от отрицательно заряженного осадка. . По мере титрования концентрация галогенид ‑ ионов в растворе и на поверхности осадка уменьшаются. Одновременно в растворе увеличивается концентрация ионов серебра и, наряду с галогенид – ионами, на поверхности осадка адсорбируются также и эти ионы. В результате в ходе титрования заряд отдельных частиц твердой фазы уменьшается. В районе ТЭ наступает такой момент, когда количества адсорбированных галогенид ‑ ионов и ионов серебра одинаковы и частицы осадка становятся электронейтральными. Это состояние называют изоэлектронной точкой. Изоэлектронная точка обычно не совсем совпадает с точкой эквивалентности из ‑ за того, что адсорбируемость обоих ионов неодинакова.
За изоэлектронной точкой при добавлении первого же избытка титранта (стандартного раствора AgNO3) первично ‑ адсорбированным ионом становится Ag+ и поверхность осадка приобретает положительный заряд. В результате анион индикатора адсорбируется на поверхности осадка в качестве противоиона:
![]()
Адсорбция окрашенного индикатора поверхностью осадка приводит к изменению его цвета (на красный). Причина этого явления окончательно не установлена.
При титровании методом адсорбционных индикаторов необходимо учитывать ряд факторов:
-
Величина рН раствора не должна быть слишком низкой, иначе равновесие сдвинется в сторону образования слабо ионизированных молекул HInd. Поэтому при титровании в более кислой среде следует использовать краситель с более сильными кислотными свойствами, например, дихлорфлуоресцеин ( титрованиие возможно в слабокислой среде ─даже при рН ≈), вместо флуоресцеина, с которым следует проводить титрование в нейтральной или слабощелочной среде (рН от 7 до 10). Титрование бромидов, иодидов и тиоцианатов нитатом серебра с адсорбционным индикатором эозином (меняющим свою розовую окраску на красно ─ фиолетовую) возможно не только в нейтральной, но и в кислой среде (при рН ).
-
Анион индикатора Ind─ в процессе титрования не должен замещать первично адсорбированный ион Х─ , однако в КТТ должен адсорбироваться в качестве противоиона.
-
Интенсивность изменения окраски зависит от количества адсорбированных молекул индикатора и, следовательно, от площади осадка. Условия проведения реакции должны способствовать образованию большого количества частиц осадка и препятствовать их коагуляции.

