
Лекция 12
.doc
Лекция 12
5) Присоединение спиртов и фенолов
Эта реакция может катализироваться кислотами и основаниями.
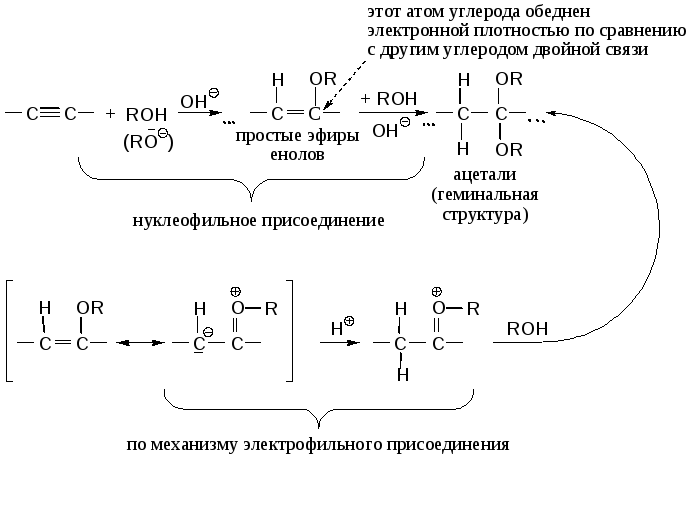
При кислотном катализе присоединение идет по электрофильному механизму:

Реакционная способность спиртов уменьшается в ряду:
первичные > вторичные > третичные.
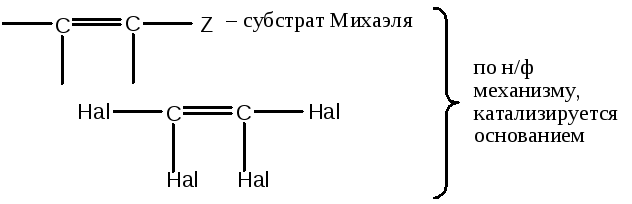
С субстратами, более подверженными атаке нуклеофилов, чем электрофилов (полигалогенолефины, субстраты Михаэля), реакцию лучше проводить в щелочном растворе:

Поскольку тройные связи более чувствительны к нуклеофильной атаке, чем двойные, то присоединение ROH к тройным связям катализируется основаниями особенно эффективно:
Реакционная способность спиртов уменьшается в ряду: первичные > вторичные > третичные.
Простые эфиры енолов более чувствительны к электрофильной атаке, чем тройные связи, поэтому присоединение спиртов к таким эфирам может также катализироваться кислотами. Как видно из приведенной схемы, и нуклеофильное, и электрофильное присоединение спирта к простому эфиру енола приводит к геминальной структуре – ацеталю. Действительно, из двух возможных промежуточных карбанионов более стабилен «геминальный» анион, поскольку в «вицинальном» анионе электронодонорный заместитель связан с отрицательно заряженным углеродом:

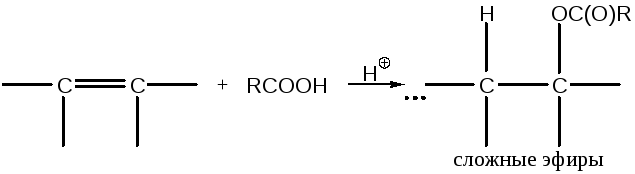
Спирты и фенолы присоединяются к кетенам, давая сложные эфиры:

δ'+ < δ+
Это – нуклеофильное присоединение. Аналогично присоединяются к кетенам и другие нуклеофилы:
H2O (OHˉ) с образованием кислот;
NH3 с образованием амидов;
RCOOH с образованием ангидридов кислот.

5) Присоединение кислот к кратным связям
По механизму –аналогично присоединению спиртов, т. е. электрофильное присоединение:
Своеобразной разновидностью этой реакции является реакция лактонизации непредельных кислот под действием минеральных кислот. При обработке карбоновой кислоты, содержащей двойную связь, сильной кислотой присоединение происходит внутримолекулярно, и независимо от положения двойной связи продуктом реакции является - и/или -лактон. Это происходит потому, что сильные кислоты катализируют перемещение двойных связей. Двойная связь всегда мигрирует в положение, удобное для реакции, независимо от того, приближение это или удаление от двойной связи. С этой реакцией конкурирует реакция образования производного циклопентенона или циклогексенона:

Протонные кислоты (H2SO4, HCOOH, HF) дают, в основном, лактоны (путь а), кислоты Льюиса (уксусный ангидрид, ZnCl2 в CH3COOH, P2O5 и т. д.) – преимущественно кетоны (путь б).
Присоединение карбоновых кислот к тройной связи в присутствии солей ртути – это электрофильное присоединение по Кучерову:
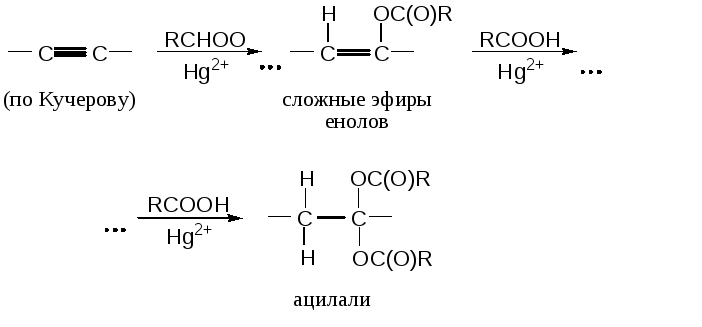
Но к кетенам карбоновые кислоты присоединяются по нуклеофильному механизму. Присоединение уксусной кислоты к кетену – промышленный метод синтеза уксусного ангидрида:

5) Присоединение к кратным связям сероводорода и тиолов
В отсутствии инициаторов свободнорадикальных процессов присоединение протекает по электрофильному механизму, и ориентация присоединения определяется правилом Марковникова, причем в отсутствие сильных кислот реакция идет очень медленно или вообще не идет.

В присутствии свободнорадикальных инициаторов реакция протекает по свободнорадикальному механизму против правила Марковникова.
Присоединение тиолов к субстратам, чувствительным к нуклеофильной атаке (полигалогенолефины, алкины, субстраты Михаэля), катализируется основаниями и идет по нуклеофильному механизму:

При любом механизме продуктом присоединения H2S может быть дисульфид.
6) Присоединение к кратным связям бисульфита натрия

7) Присоединение к кратным связям аммиака и аминов



Поскольку а) аммиак и амины являются значительно более слабыми кислотами, чем вода, спирты и тиолы, и поскольку б) кислоты не катализируют присоединение этих реагентов к двойным связям из-за образования аммониевых солей, присоединение аммиака и аминов к двойным связям не может идти по электрофильному механизму (мало кислоты – нет кислой среды из-за связывание кислоты аммиаком или амином, много кислоты – весь аммиак или амин превращается в аммониевый ион, и в реакционной массе нет свободного нуклеофила).
![]()
![]()
Механизм этих реакций почти всегда нуклеофильный. Поэтому реакции такого типа проводят с субстратами, чувствительными к нуклеофильной атаке (полигалогенолефины, субстраты Михаэля, алкины). Простые олефины в обычных условиях практически не присоединяют аммиак и амины, однако в очень жестких условиях такое присоединение возможно.


В случае субстратов Михаэля азот присоединяется к углероду, не соединенному с группой Z.
К олефинам можно присоединить и другие азотсодержащие нуклеофилы:

Реакция может катализироваться основаниями (в случае нуклеофилов выступают RNH или R2N), причем в случае амидов катализ основаниями обязателен, поскольку они – очень слабые нуклеофилы:

Присоединение третичных аминов также происходит по нуклеофильном механизму:

Атакующая частица – амин. Потом присоединяется протон. Анион хлора компенсирует образовавшийся положительный заряд.
Другие примеры присоединения аминов по кратным связям:


8) Реакция Михаэля

По механизму идет как катализируемое основанием нуклеофильное 1,4-присоединение.
Соединения с кислым водородом:
В реакции можно использовать малонаты, цианоацетаты, ацетоацетаты, сложные эфиры, кетоны, альдегиды, нитрилы, нитросоединения, сульфоны, и др. с относительно кислыми СН-водородами:
Z (Z’) = CHO,C(O)R, COOR, CONH2, CN, NO2, SOR, SO2R и т. д.
Механизм:

В случае, когда активирующая группировка Z’’ = CHO, CN, c 1,4-присоединением конкурирует 1,2 присоединение, причем иногда оно доминирует. В частности, для ,-ненасыщенных альдегидов (Z’’ = СHO) 1,4-присоединение наблюдается редко.
9) Присоединение к кратным связям алканов и алкенов

Известны два способа присоединения. В обоих образуется смесь продуктов, ни один из способов не пригоден для получения относительно чистых веществ с приемлемыми выходами, однако обе реакции находят промышленное применение.
-
Термическое присоединение (по свободно радикальному механизму) – используется для переработки топлива, в частности для повышения октанового числа моторных топлив.

![]()

![]()

-
При каталитическом присоединении используются протонные кислоты или кислоты Льюиса, температура от -30 до 100°C (это процесс Фриделя-Крафтса с карбокатионным механизмом):


Происходит отщепление-присоединение гидрид-иона Н.


Опять отщепление-присоединение гидрид-иона Н.
В процессах, в которых образуются карбокатионы, в том числе при повышенных температурах, карбокатионы могут изомеризоваться (перегруппировываться):

Олефин может присоединяться к олефину межмолекулярно, например:

или внутримолекулярно.
Присоединение такого рода возможно также под действием оснований (по карбанионному механизму), а также каталитических систем, состоящих из никелевых комплексов и алкил-алюминиевых соединений (катализаторы Циглера), а также катализаторов на основе хлорида родия.

Димеризация ацетилена:

10) Реакция гидрокарбоксилирования (реакция Коха)

Эту реакцию часто используют для получения ,-ненасыщенных кислот:

Механизм кислотного катализа в реакции Коха


Если вместо воды использовать спирты, тиоспирты (тиолы), амины, то как при катализе кислотами, так и карбонилом никеля образуются:

Осложняющий момент – до атаки СО может происходить перегруппировка карбокатиона и миграция двойной связи.
11) Реакция гидроформилирования («оксо-синтез»)

Во многих случаях газофазные реакцияи проводятся под давлением для увеличения концентраций реагирующих веществ и интенсификации процесса.
12) Аминометилирование алкенов

13) Присоединение циановодорода
Простые олефины не присоединяют циановодород (синильную кислоту), но был найден катализатор, с которым может осуществиться этот процесс:


Синильная кислота хорошо присоединяется к субстратам Михаэля или полигалогенолефинам с образованием нитрилов, следовательно, реакция идет по механизму нуклеофильного присоединения и катализируется основаниями:
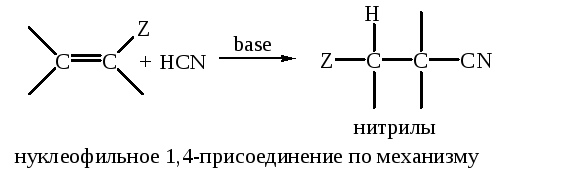
Если Z=С(O)R, C(O)H, то преобладает 1,2-присоединение (т. е. по карбонильной группе, а не по двойной связи).
В присутствии катализатора синильная кислота присоединяется и к тройной связи по механизму нуклеофильного присоединения. К тройной связи может присоединиться 1 или 2 моля HCN, поскольку первоначально образующийся продукт является субстратом Михаэля:

Промышленный синтез акрилонитрила:

Составы катализаторов:
– водный раствор Cu2Cl2, NH4Cl и HCl;
– соединения никеля;
– соединения палладия.
Ключевой стадией этой реакции является нуклеофильной присоединение цианид-аниона к тройной связи. Роль соли одновалентной меди не ясна.
