
химия
.docxЛабораторная работа 1
Определение теплового эффекта реакции нейтрализации
Теоретические основы. Совокупность тел, выделенная из пространства, называется системой. Если в ней возможен массо- и теплообмен, то такая система называется термодинамической. Химическая система, в которой возможно протекание реакции, представляет собой частный случай термодинамической системы.
Состояние системы определяется совокупностью ее свойств и характеризуется термодинамическими параметрами, к числу которых относятся температура, давление, объем. Одной их основных фундаментальных функций состояния является полная энергия, Е, представляющая собой сумму трех составляющих: кинетической энергии движущейся системы (К), потенциальной энергии, обусловленной воздействием на систему внешних силовых полей (П) и внутренней энергии системы (U). При термодинамическом описании предполагают, что система находится в относительном покое (К=0) и воздействие внешних полей пренебрежимо мало (П=0). В этом случае полная энергия системы определяется запасом ее внутренней системы (Е=U). В соответствии с законом сохранения энергии, выражающим первое начало термодинамики, общий запас внутренней энергии остается постоянным, если отсутствует тепловой обмен с окружающей средой.
Сообщенное системе тепло расходуется на приращение внутренней энергии и на совершение работы против внешних сил (работа по расширению или сжатию системы). Химические реакции чаще всего проходят в условиях постоянного давления (в изобарных условиях), Р=Const. Работа расширения (сжатия) в этом случае может быть записана в виде: А = РV. Прирост или потеря тепла системой в изобарных условиях носит название “изменение энтальпии системы”:
Н = H(конечных продуктов) - H(начальных продуктов) = U + РV.
В том случае, если все конечные продукты и начальные реагенты находятся в стандартных условиях (Р = 760 мм рт. ст. или 101,3 кПа, Т=298,15 К или 250С, концентрации растворенных веществ С=1моль/л), изменение энтальпии обозначают символом Н0 и называют стандартной энтальпией процесса.
Химические реакции сопровождаются выделением или поглощением теплоты. Реакции, в которых теплота выделяется, называются экзотермическими, а реакции, сопровождающиеся поглощением тепла, - эндотермическими. Уравнение химической реакции, включающее величину теплового эффекта (энтальпии), называется термохимическим уравнением. При этом выделяемая теплота записывается со знаком “ + ”, а поглощаемая - со знаком “ - ”. Выделение теплоты системой означает, что энергия конечных продуктов меньше, чем энергия исходных веществ, т.е.
Н = H(конечных продуктов) - H(начальных продуктов) < 0
Поглощение теплоты системой означает, что энергия конечных продуктов больше, чем энергия исходных веществ:
Н = H(конечных продуктов) - H(начальных продуктов) > 0
Условия экзотермической реакции: Q > 0; Н < 0.
Условия эндотермической реакции: Q < 0; Н > 0.
Например, 2H2 (г) + O2 (г) = 2Н2О (ж) + 571,6 кДж или 2H2 (г) + O2 (г) = 2Н2О (ж) ; Q = - 571,6/2 = 259,8 кДж
Теплотой образования соединения называется количество выделяемой или поглощаемой теплоты при образовании 1 моля соединения из простых веществ.
Вычисление теплоты реакции по теплотам образования участвующих в ней веществ проводится на основании закона Гесса: тепловой эффект химической реакции зависит только от состояния исходных и полученных веществ и не зависит от того, через какие стадии проходит реакция. Тепловой эффект процесса равен сумме тепловых эффектов отдельных стадий процесса.
Из закона Гесса следует, что теплота реакции равна разности между суммами стандартных теплот образования конечных продуктов и исходных веществ с учетом стехиометрических коэффициентов. Теплоты образования простых веществ принимаются равными нулю.
Цель работы. Экспериментальное определение теплового эффекта реакции нейтрализации.
Порядок работы.
Опыты по определению тепловых эффектов химических реакций проводятся в специальных приборах, называемых калориметрами. Простейший калориметр состоит из двух стаканов, вставленных один в другой и имеющих теплоизоляционную прокладку для уменьшения теплообмена со внешней средой. Сверху прибор закрывается крышкой с тремя отверстиями для химической воронки, мешалки и термометра.
1. Взвесьте на технохимических весах калориметрический стакан. Массу стакана ( m1) запишите в тетрадь.
2. Отмерьте цилиндром 75 мл 1М раствора серной кислоты и налейте ее в калориметрический стакан. Измерьте термометром температуру раствора кислоты ( tk ).
3. Отмерьте цилиндром 75 мл 1М раствора гидроксида натрия и вылейте его в стеклянный стакан. Измерьте термометром температуру раствора щелочи ( tщ ).
4. Соберите как показано на рисунке калориметрический прибор и через воронку быстро при постоянном перемешивании влейте раствор щелoчи в раствор серной кислоты.
5. По термометру отметьте самое высокое значение температуры в реакционном стакане ( t2 ).
Форма лабораторного отчета.
1. Название лабораторной работы.
2. Краткое описание, цель работы.
3. Уравнение реакции нейтрализации.
4. Экспериментальные данные:
а) масса калориметрического стакана m1 = ......
б) температура раствора кислоты tк = .....
в) температура раствора щелочи tщ = .....
г) самая высокая конечная температура t2 = ......
5. Расчеты:
а) исходная температура раствора в калориметре (t1)
t1 = ( tк + tщ ) / 2 = …
б) масса раствора в калориметре (m2)
m2 = 75 ( k + щ )
где k и щ - плотности 1,00 М растворов H2SO4 и NaOH
в)
количество теплоты, выделившейся в
процессе реакции: q
= ( t2 -
t1 ) (c1m1
+ c2m2)
= ...
(c1m1
+ c2m2)
= ...
где с1 -удельная теплоемкость алюминия с1 = 0,88 Дж/г град
с2 - удельная теплоемкость раствора с2 = 4,18 Дж/г град
г) экспериментальное значение (Qнейтр)
Qнейтр.= 1000q / 75
д) относительная ошибка эксперимента
K
=
6. Выводы.
Типовые задачи
-
При растворении 7,02 г алюминия в соляной кислоте выделилось 21,1 кДж теплоты. Определить тепловой эффект реакции (кДж/моль).
-
При соединении 2,1 г железа с серой выделилось 3,77 кДж теплоты. Рассчитать теплоту образования сульфида железа.
-
Исходя из теплот образования оксидов кальция и фосфора, равных Но(СаО)= – 635,5 кДж/моль и Но(Р2О5) = – 1492 кДж/моль, а также теплового эффекта реакции
3СаО + Р2О5 = Са3(РО4)2, Но = – 739 кДж,
определить теплоту образования ортофосфата кальция.
Вычислите тепловой эффект реакции PCl3 +Cl2 = PCl5 , если известны теплоты образования PCl3 и PСl5 , которые равны -317,6 и -454,8 кДж/моль соответственно
Лабораторная работа № 1
ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ ЭКВИВАЛЕНТА МЕТАЛЛА
Цель работы:
Установка для измерения молярной массы эквивалента металла (эвдиометр):
Основные понятия: химический эквивалент, молярная масса химического эквивалента.
Основные законы, используемые для определения молярной массы эквивалента металла:
Закон эквивалентов:
 ,
,
где mM
– масса металла;
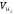 –
измеренный объем водорода;
–
измеренный объем водорода;
 –
молярный объем химического эквивалента
водорода при условиях опыта.
–
молярный объем химического эквивалента
водорода при условиях опыта.
Объединенный газовый закон:
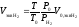 ,
,
где
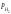 –
парциальное давление водорода в закрытой
бюретке; Т – температура, при которой
проводится эксперимент;
–
парциальное давление водорода в закрытой
бюретке; Т – температура, при которой
проводится эксперимент;
 –
молярный объем химического эквивалента
водорода при нормальных условиях (Т0=
273,15 К; Р0= 101,3 кПа = 760 мм рт. ст.).
Так как число эквивалентности водорода
zэкв = 2, то
–
молярный объем химического эквивалента
водорода при нормальных условиях (Т0=
273,15 К; Р0= 101,3 кПа = 760 мм рт. ст.).
Так как число эквивалентности водорода
zэкв = 2, то
 =
=
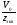 =
=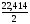 =
11,207 л/моль
=
11,207 л/моль
Закон Дальтона:
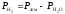 ,
,
где
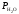 –
давления насыщенного водяного пара при
температуре опыта.
–
давления насыщенного водяного пара при
температуре опыта.
Расчетная формула молярной массы химического эквивалента металла:
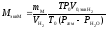 .
.
Относительная ошибка эксперимента:
=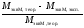 100%.
100%.
Таблица. Условия проведения опыта, результаты измерений и расчетов
|
№ |
Условия проведения опыта |
Результаты измерений |
|
|||||
|
опыта |
Т, К |
Ратм, мм рт.ст. |
мм рт.ст. |
mM, г |
hнач, мл |
hкон, мл |
||
|
1 |
|
|
|
|
|
|
||
|
2 |
|
|
|
|
|
|
||
|
№ |
|
Результаты |
расчетов |
|
|
|||
|
опыта |
мм рт.ст. |
мл |
МэквМ, эксп г/моль |
г/моль |
МэквМ, теор г/моль |
|
||
|
1 |
|
|
|
|
|
|
||
|
2 |
|
|
|
|
|
|
||
Расчеты:
Уравнение реакции:
Выводы: (указывают металл, его молярную массу эквивалентна, определенную в ходе опыта, и относительную ошибку эксперимента)

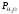 ,
,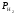 ,
,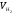 ,
,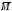 эквМ,
эксп
эквМ,
эксп