
- •Варианты контрольных заданий
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Вычислите реакции, протекающей по уравнению, используя значения стандартных теплот образования и абсолютных стандартных энтропий веществ: .
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Составьте молекулярные и ионные уравнения реакций, протекающих при смешивании растворов: а) и ; б) и ; в) и .
- •Составьте уравнения электролитической диссоциации следующих электролитов: . Запишите выражения констант равновесия для слабых электролитов.
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Составьте молекулярные уравнения по ионно-молекулярным: ;
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Вычислите реакции, протекающей по уравнению, используя значения стандартных теплот образования и абсолютных стандартных энтропий веществ: .
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Напишите ионно-молекулярные уравнения реакций:
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Составьте молекулярные уравнения по ионно-молекулярным: ;
- •Составьте уравнения электролитической диссоциации следующих электролитов: . Запишите выражения констант равновесия для слабых электролитов.
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Составьте уравнения электролитической диссоциации электролитов . Объясните, какой из них легче распадается на ионы и почему. Запишите выражение для константы равновесия слабых электролитов.
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
- •Составьте уравнения электролитической диссоциации следующих электролитов: . Запишите выражения констант равновесия для слабых электролитов.
- •Напишите ионно-молекулярные уравнения реакций:
- •Напишите ионно-молекулярные уравнения реакций:
- •Составьте уравнения электролитической диссоциации следующих электролитов: . Запишите выражения констант равновесия для слабых электролитов.
- •Термодинамические свойства некоторых соединений
-
Теплота сгорания метана равна – 890 кДж/моль. Вычислите теплоту его образования.
-
Вычислите реакции, протекающей по уравнению, используя значения стандартных теплот образования и абсолютных стандартных энтропий веществ: .
-
Вычислите γ реакции, если константа скорости ее при 120°С равна 6,7•10-2.
-
Константа равновесия гомогенной системы
 при некоторой температуре равна 0,2.
Равновесные концентрации водорода и
аммиака соответственно равны 0,4 и 0,15
при некоторой температуре равна 0,2.
Равновесные концентрации водорода и
аммиака соответственно равны 0,4 и 0,15
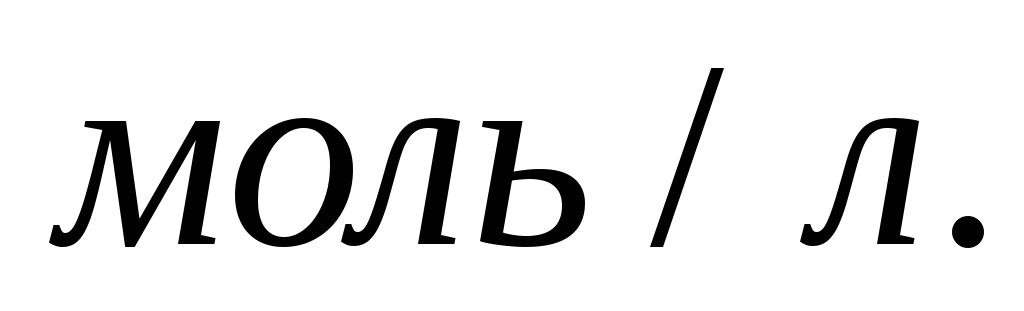 Вычислите исходную и равновесную
концентрации азота.
Вычислите исходную и равновесную
концентрации азота. -
Сколько граммов растворенного вещества и сколько граммов воды содержится в 350г 9%-ного раствора
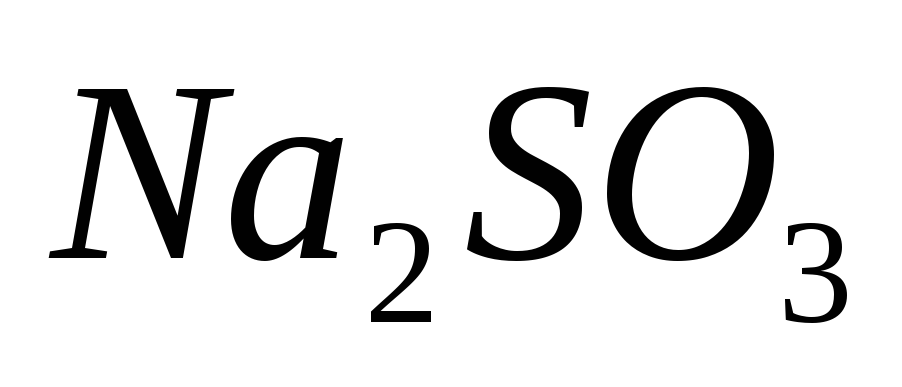 ?
? -
Составьте молекулярные уравнения реакций, представленных следующими ионными уравнениями:
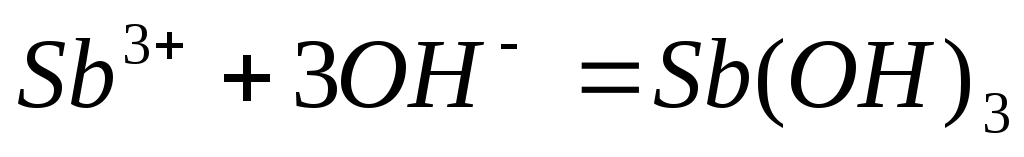 ;
;
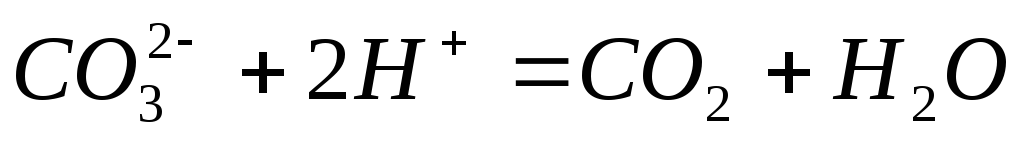 .
. -
Вычислите массовую долю сахара
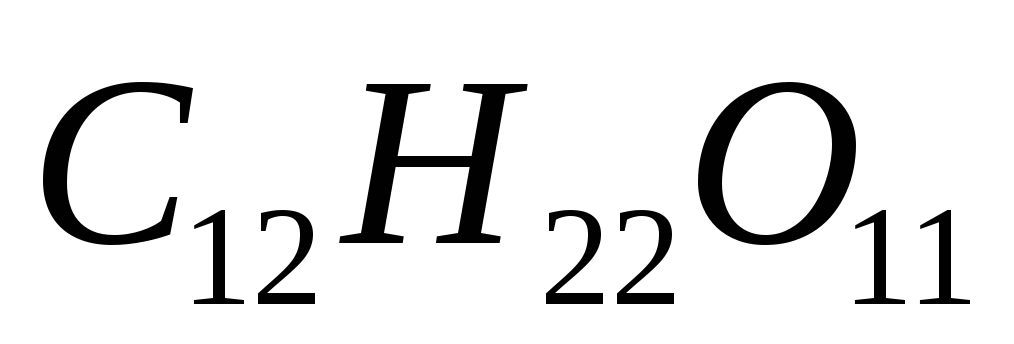 в растворе, температура кипения которого
100,24ºС. Эбуллиоскопическая константа
воды равна 0,52 0.
в растворе, температура кипения которого
100,24ºС. Эбуллиоскопическая константа
воды равна 0,52 0.
-
Составьте уравнения электролитической диссоциации для электролитов: серной кислоты, ортомышьяковой кислоты, азотистой кислоты, кремнистой кислоты. Запишите выражения для констант диссоциации слабых электролитов.
-
Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
Вариант 10.
-
Сколько теплоты выделится при сжигании 45 г сероуглерода?
-
Реакция горения сероуглерода идет по уравнению:
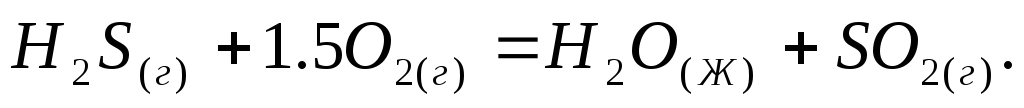 Вычислите
Вычислите
 ,
объясните уменьшение энтропии в
результате этой реакции.
,
объясните уменьшение энтропии в
результате этой реакции.
-
Реакция между веществами А и В выражается уравнением А + 2В =С. Начальные концентрации соответственно равны 0,3 и 0,5 моль/л. Константа скорости равна 0,4 л2/(моль2 ·с). Вычислите скорость реакции в начальный момент и в тот момент, когда концентрация вещества А уменьшилась на 0,1 моль/л.
-
Константа равновесия системы при постоянной температуре
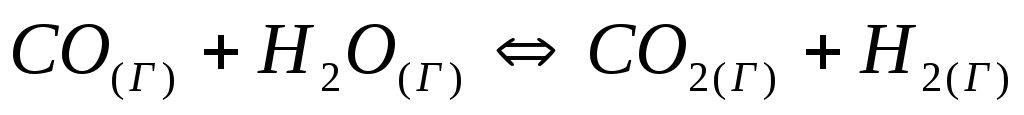 равна
1. Вычислите равновесные концентрации
всех реагентов, если исходные концентрации
составляют:
равна
1. Вычислите равновесные концентрации
всех реагентов, если исходные концентрации
составляют:
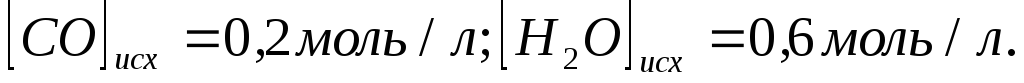
-
Вычислите массовую долю растворенных веществ в растворах, содержащих: а) 75 г
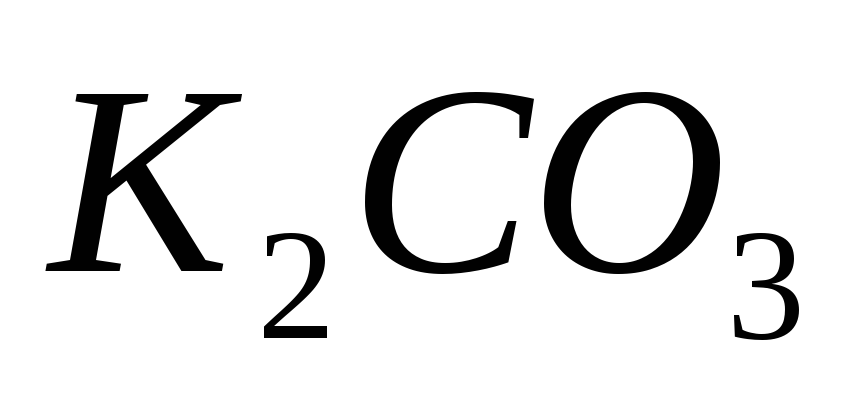 в 350 г воды; б) 40 г
в 350 г воды; б) 40 г
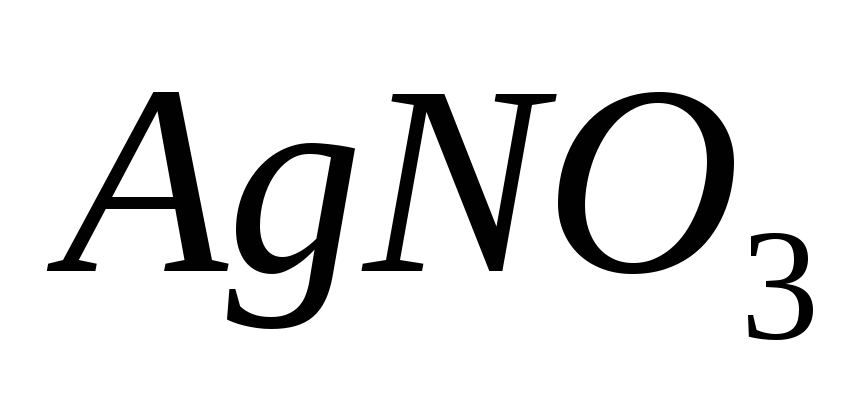 в 600 г воды.
в 600 г воды. -
Напишите ионно-молекулярные уравнения реакций:
![]() ;
;
![]() ;
;
![]() .
.
-
В каком количестве воды следует растворить 19 г глицерина
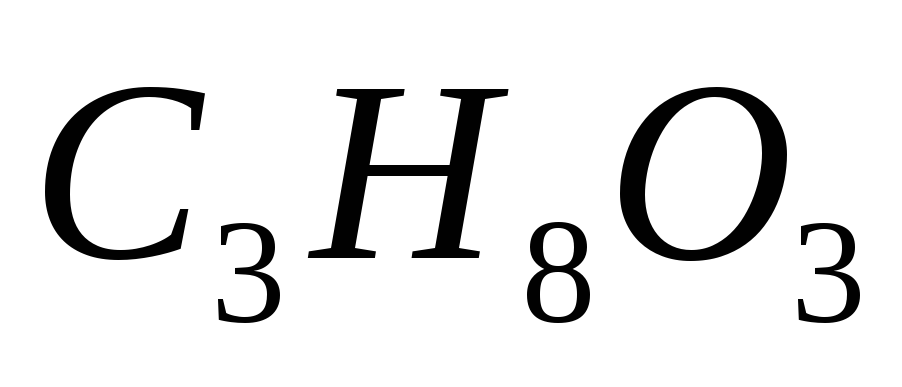 ,
чтобы получить раствор с температурой
кипения 100,099ºС? Эбуллиоскопическая
константа воды равна 0,52 0.
,
чтобы получить раствор с температурой
кипения 100,099ºС? Эбуллиоскопическая
константа воды равна 0,52 0. -
Константа диссоциации одноосновной кислоты равна 1,5·10-5. Определите степень ее диссоциации в 0,003 М растворе.
-
Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
Вариант 11.
-
Вычислите тепловой эффект реакции гашения 15 кг извести. Процесс протекает по уравнению
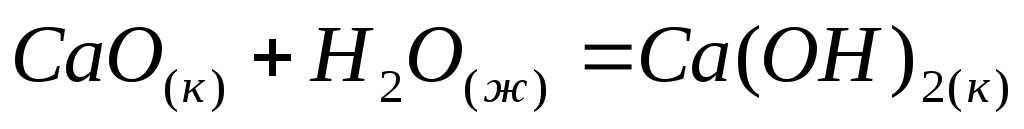 .
. -
Исходя из значений стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ, вычислите
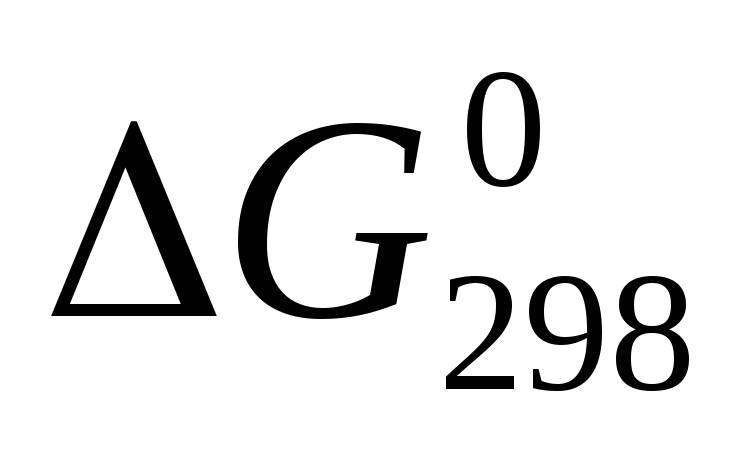 ,
протекающей по уравнению
,
протекающей по уравнению
 .
Возможен ли этот процесс при стандартных
условиях?
.
Возможен ли этот процесс при стандартных
условиях? -
Если температурный коэффициент реакции равен 3, то во сколько раз увеличится скорость реакции при увеличении температуры с 22 до 62°С?
-
Равновесие системы
 при постоянной температуре установилось
при следующих концентрациях:
при постоянной температуре установилось
при следующих концентрациях:

 .
Вычислите исходные концентрации
хлороводорода и кислорода.
.
Вычислите исходные концентрации
хлороводорода и кислорода. -
Какой объем 25%-ного раствора плотностью 1,15 г/см3 надо прибавить к ее 12%-ному раствору плотностью 1,05 г/см3 объемом 1 л, чтобы получить 14%-ный раствор карбоната натрия?
-
Закончите молекулярные и составьте ионно-молекулярные уравнения процессов, проходящих по схемам:
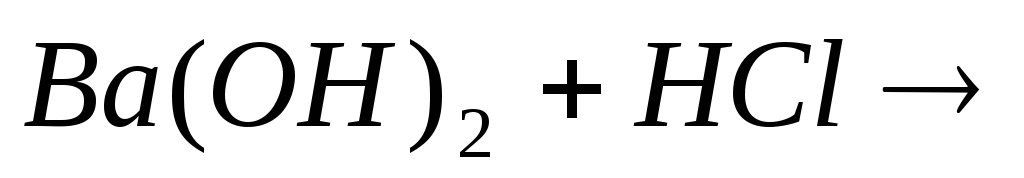 …;
…;
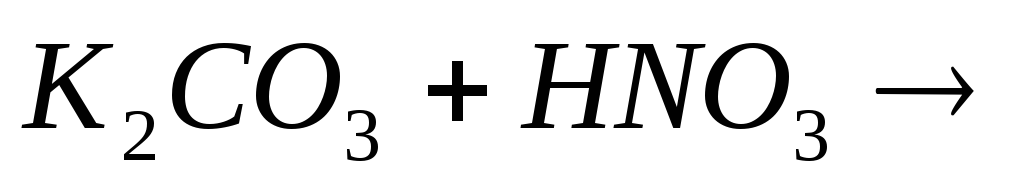 ….
…. -
Чему равно при температуре 8ºС осмотическое давление раствора, в 1,6 л которого содержится 256 мг глицерина
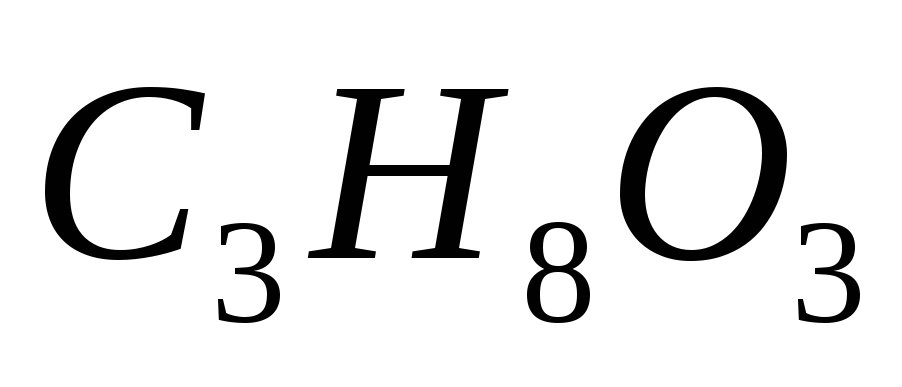 ?
? -
Приведите по три примера сильных и слабых электролитов, составьте уравнения их диссоциации.
-
Составьте уравнения гидролиза в ионно-молекулярной и молекулярной форме для следующих солей: и . Укажите рН среды.
Вариант 12.
-
Вычислите величину изменения энтальпии реакций:
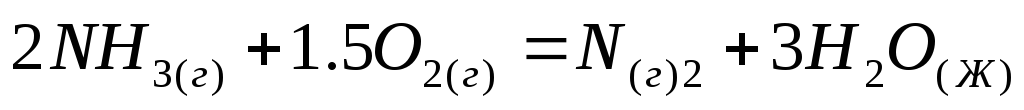 ;
;
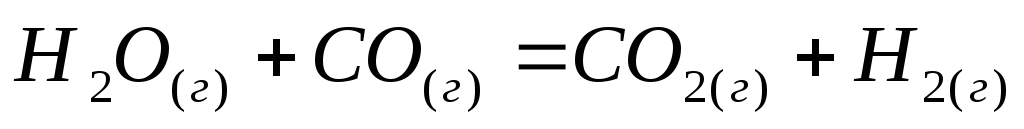 .
. -
Прямая или обратная реакция будет протекать при стандартных условиях в системе
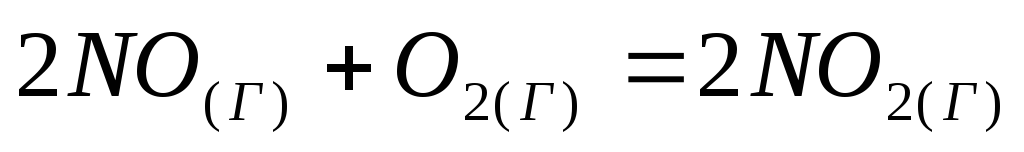 .
Ответ мотивируйте, вычислив
.
Ответ мотивируйте, вычислив
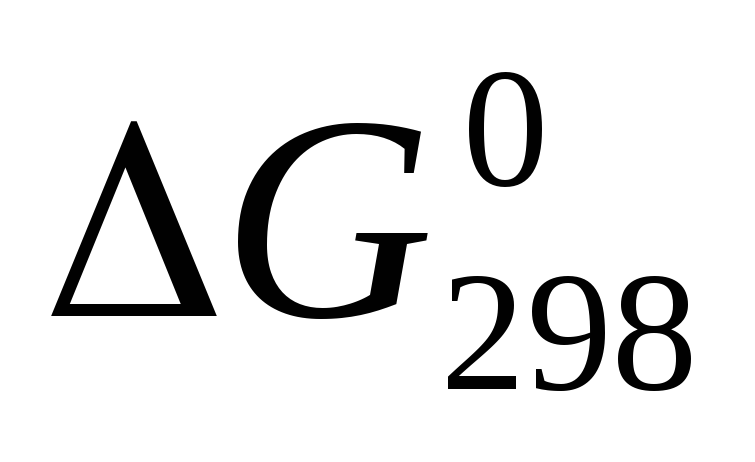 прямой реакции.
прямой реакции. -
Напишите математические выражения для определения скоростей следующих химических реакций, протекающих в гомогенной системе: a) CO + Cl2 → COCl2; б) 2NO + O2 → 2NO2;
в) 4HCl + O2 → 2H2O + 2Cl2.
