
- •Макроструктурный анализ
- •Влияние термической обработки на структуру и свойства углеродистой стали 40
- •Основы термической обработки
- •Анализ диаграмм состояния двойных сплавов
- •Изучение структуры чугунов
- •Анализ диаграммы состояния железо-цементит, изучение микроструктуры и свойств углеродистых сталей
Анализ диаграмм состояния двойных сплавов
Цель работы: установить связь между диаграммами состояния, структурой и свойствами сплавов.
План работы
1. Выполнить анализ диаграмм состояния сплавов Рb - Sb и Сu-Ni.
2. Построить кривые охлаждения заданных сплавов.
3. Исследовать микроструктуры сплавов.
Пояснении к работе
Диаграмма состояния системы сплавов представляет собой графическое изображение состояния сплава в зависимости от температуры и концентрации.
Диаграммы состояния строятся экспериментальным путем в координатах состав сплава - температура, Для их построения используется ряд анализов, основные из которых: термический, химический, микроструктурный, рентгеноструктурный. При термическом анализе получают кривые охлаждения в координатах температура - время (рис. 1). Если при охлаждении в исследуемой системе не происходит изменений в строении, то кривая получается плавной, без перегибов (рис. 1,а). В случае охлаждения чистого металла (рис. 1,б) происходящая кристаллизация сопровождается выделением скрытой теплоты, которая полностью компенсирует теплоотвод в окружающее пространство, и температура остается постоянной в течение времени кристаллизации, т. е. чистый металл кристаллизуется при постоянной температуре. Такой же вид имеет кривая охлаждения сплава—смеси эвтектического состава. После завершения кристаллизации температура понижается.
Двойные сплавы в отличие от чистых металлов кристаллизуются в интервале температур. При кристаллизации твердого раствора на кривой охлаждения имеются точки перегиба (рис. 1,в).
Кривая охлаждения сплава—механическая смесь (рис. 1,г) имеет горизонтальный участок,
что соответствует кристаллизации эвтектики.

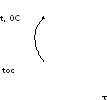
а) б)

в) г)
Рис. 1 Кривые охлаждения
Точки перегиба на кривых охлаждения соответствуют критическим точкам. Критическая точка - это температура, соответствующая структурным превращениям и сплаве. В обоих случаях верхние критические точки соответствуют началу кристаллизации, а нижние — концу.
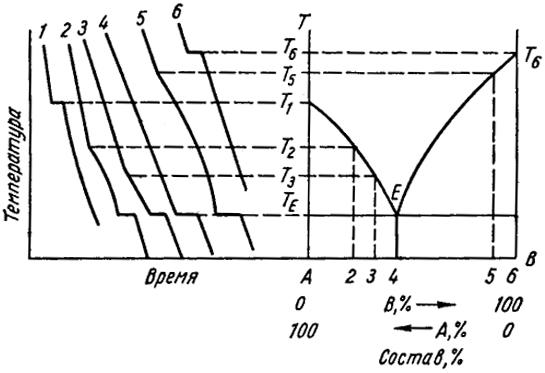
Пример построения диаграммы состояния приведен на рис. 2. На кривых охлаждения (рис. 2, а), построенных для сплавов с различной концентрацией компонентов, отмечают критические точки. Эти точки переносят на координатную сетку диаграммы состояния (рис. 5,б). Соединив точки начала и конца кристаллизации, получают линии ликвидус и солидус.
Таким образом, линия ликвидус - геометрическое место точек начала кристаллизации при охлаждении и конца плавления при нагреве.
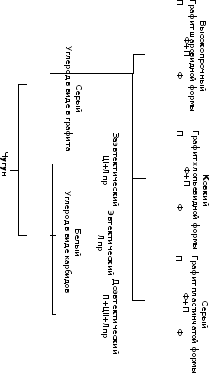
- высокопрочный, в нем большая часть углерода находится в свободном состоянии в виде графита, имеющего шаровидную форму.
Серый, ковкий и высокопрочные чугуны содержат графит, их излом поэтому получается серого цвета и по цвету и излома все перечисленные чугуны можно называть серыми. Структура серого, ковкого и высокопрочного чугунов состоит графитовых включений и металлической основы, которая может быть ферритной, ферритоперлитной и перлитной.
Рассмотрение
процесса кристаллизации чугунов с
учетом термодинамических факторов и
кинетики образования цементита
и графита объясняет появление пунктирных
линий на диаграмме системы Fe
– Fe3C
и характер их расположения (рис.2).
Рис. 2 Диаграмма состояния системы железо—графит
Линия Е'С'F' (1153°С)—линия фазового равновесия Ж↔А, здесь образуется графитная эвтектика.
Линия Р'S'К' (7380С)— линия фазового равновесия А↔Ф+Г, здесь образуется графитовый эвтектоид.
Меньшая способность феррита, аустенита и жидкости растворять графит, чем цементит, приводит к тому, что линии Q'Р', S'Е' и С'D' располагаются левее соответствующих линий QР, SE и СD.



![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Рис. 1 Классификация чугунов по виду изломов
Линия солидус—геометрическое место точек конца кристаллизации при охлаждении и начала плавления при нагреве.
Выше линии ликвидус сплав находится в жидком состоянии Ж, ниже линии солидус—в твердом (αтв). Между линиями ликвидус и солидус сплав находится в полужидком состоянии (имеются жидкая и твердая фазы).
Анализ диаграммы состояния сплава проводится с помощью правил фаз и отрезков. Для проведения анализа необходимо изучить седующие понятия и определения.
Сплав — сложное вещество, полученное в результате сплавления двух или более компонентов.
а) б)
Рис. 2. Построение диаграммы состояния по кривым охлаждениям
Компонент—составляющая сплава, им могут быть химические элементы или устойчивые химические соединения.
Система — совокупность веществ в твердом, жидком и газообразном состояниях, при известных условиях (температура, давление), занимающая определенный объем. Системы, состоящие из одного химического элемента или соединения. называют простыми, а из нескольких — сложными.
Эвтектика — мелкозернистая смесь, состоящая из двух или более фаз, кристаллизующихся одновременно при постоянной температуре из жидкой фазы, имеющая определенный состав и наименьшую для данного сплава температуру плавления.
Фаза — однородная внутри тебя часть системы, отделенная от других частей (фаз) поверхностью раздела, при переходе через которую строение и свойства меняются скачками.
Число степеней свободы (вариантность) системы — число внешних (температура, давление) и внутренних (концентрация) факторов, которое можно изменять без изменения числа равновесных фаз в системе.
Правило фаз (закон Гиббса) дает количественную связь между степенью слободы системы и количеством фаз и компонентов для получения равновесного состояния. Правило фаз можно выразить уравнением С=К - Ф+2, где С — число степеней свободы; К — число компонентов; Ф — число фаз; 2 — внешние факторы равновесия (температура, давление). Если принять, что превращения в сплавах практически происходят при постоянном давлении, тогда правило фаз принимает вид
С=К - Ф+1
Если число степеней свободы С=0 — система безвариантна, при этом нельзя изменить внешний (температуру) или внутренний (концентрацию) факторы без того, чтобы это не вызвало изменения числа фаз. Кристаллизация в данном случае происходит при постоянной температуре.
Если число степеней свободы С=1 — система одновариантна, при этом изменение одного из факторов равновесия не вызывает изменения числа фаз. Процесс кристаллизации протекает при понижающейся температуре.
Если число степеней свободы С=2 — система двухвариантна, возможно изменение обоих факторов равновесия без изменения числа фаз.
Правило отрезков применяется в двух случаях: для нахождения состава фаз и для определения их количественного соотношения.
ЛАБОРАТОРНАЯ РАБОТА № 5
