
biokhimia_ekz
.pdf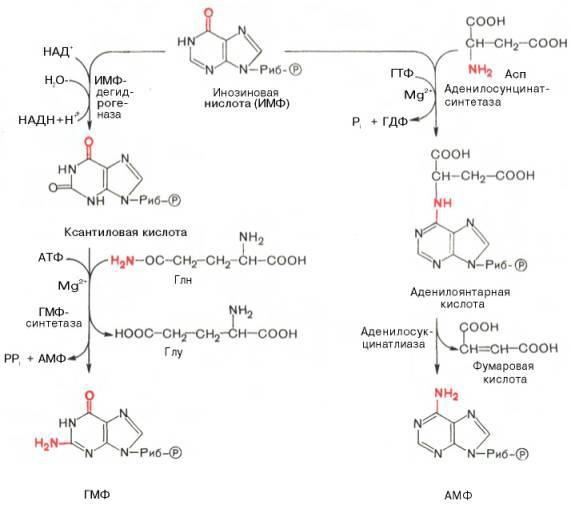
Конечный результат синтеза – не свободное пуриновое основание, а рибонуклеотид инозиновая кислота
(ИМФ).
Синтез ИМФ начинается с D-рибозо-5-фосфата, являющегося продуктом пентозофосфатного цикла. На D- рибозо-5-фосфат переносится фосфогруппа с АТФ. Образуется 5-фосфорибозил-1-пирофосфат, который взаимодействует с глутамином с образованием β-5-фосфорибозиламина. Это ключевая стадия в синтезе пуринов. На следующей стадии к свободной NH2-группе β-5-фосфорибозиламина присоединяется молекула глицина, и образуется глицинамидрибонуклеотид. На следующей стадии присоединяется формильная группа N5,N10-метенил-ТГФК, и образуется формилглицинамидрибонуклеотид.
На формильную группу формилглицинамидрибонуклеотида переносится амидная группа глутамина, и образуется формилглицинамидинрибонуклеотид. Затем пятичленное имидазольное кольцо замыкается с образованием 5-аминоимидазолрибонуклеотида, способного акцептировать СО2 с образованием 5- аминоимидазол-4-карбоновой кислоты.
В последующем двухступенчатом процессе, в котором участвуют аспарагиновая кислота и АТФ, образуется 5- аминоимидазол-4-карбоксамид-рибонуклеотид с освобождением фумаровой кислоты. Азот аспарагиновой кислоты становится в 1-е положение будущего пуринового ядра. Последний углеродный атом пиримидинового кольца пурина вводится в виде формильного остатка, присоединяющегося к 5-NH2-группе. Наконец, отщепляется молекула воды, и образуется ИМФ.
АМФ и ГМФ образуются из ИМФ, причем в синтезе обоих мононуклеотидов участвуют по два фермента. Образование ГМФ катализируют ИМФ-дегидрогеназа и ГМФ-синтетаза, образование АМФ – аденилосукцинатсинтетаза и аденилосукцинатлиаза.
В ферментативном синтезе АМФ из ИМФ в качестве донора NH2-группы участвует аспарагиновая кислота. Источником энергии служит ГТФ. Промежуточный продукт – янтарная кислота.
Биосинтез ГМФ начинается с превращения ИМФ в ксантозиловую кислоту (реакция контролируется ИМФдегидрогеназой), которая аминируется с участием амидного азота глутамина.
Превращение АМФ и ГМФ в соответствующие нуклеозидди- и нуклео-зидтрифосфаты также протекает в 2 стадии при участии специфических нуклеозидмонофосфат- и нуклеозиддифосфаткиназ :
ГМФ + АТФ <=> ГДФ + АДФ ГДФ + АТФ <=> ГТФ + АДФ
Синтез пуриновых нуклеотидов тормозится конечными продуктами по принципу обратной связи, т.е. ингибированием переноса аминогруппы глутамина на 5-фосфорибозил-1-пирофосфат.
Кроме того, избыток ГМФ в клетках оказывает аллостерическое торможение только на свой собственный синтез, не влияя на синтез АМФ; накопление АМФ подавляет свой синтез, не ингибируя синтез ГМФ.
31.Биосинтез пиримидиновых нуклеотидов.
А. Образование пиримидиновых нуклеотидов
В отличие от синтеза пуринов, где формирование гетероциклического основания осуществляется на остатке рибозо-5-фосфата, пиримидиновое кольцо синтезируется из простых предшественников: глутамина, СО2 и аспарагиновой кислоты и затем связывается с рибозо-5-фосфатом, полученным от ФРДФ.
Процесс протекает в цитозоле клеток. Синтез ключевого пиримидинового нуклеотида - УМФ идѐт с участием 3 ферментов, 2 из которых полифункциональны.
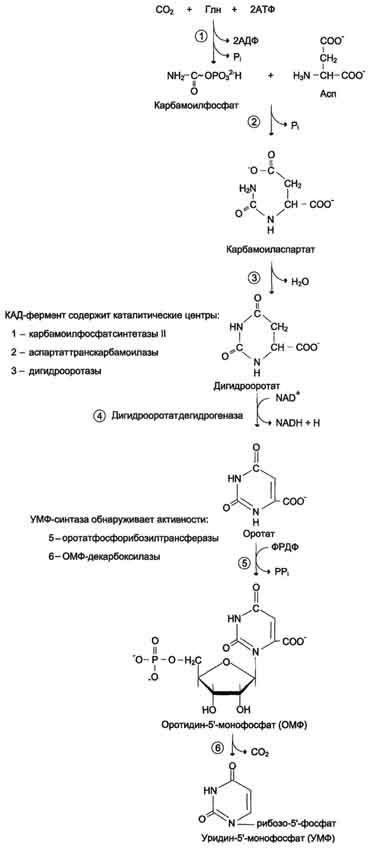
Образование дигидрооротата
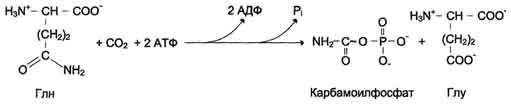
У млекопитающих ключевой, регуляторной реакцией в синтезе пирймидиновых нуклеотидов является синтез карбамоилфосфата из глутамина, СО2 и АТФ, в реакции катализируемой карбамоилфосфатсинтетазой II (КФС II), которая протекает в цитозоле клеток (рис. 10-12). В реакции NH2-гpyппa карбамоилфосфата образуется за счѐт амидной группы глутамина, что отличает эту реакцию от реакции синтеза карбамоилфосфата в митохондриях в процессе синтеза мочевины из СО2, NH3 и АТФ с участием КФС I.
Карбамоилфосфат, использующийся на образование пиримидиновых нуклеотидов, является продуктом полифункционального фермента, который наряду с активностью КФС II содержит
533
Рис. 10-12. Синтез карбамоилфосфата.
каталитические центры аспартаттранскарбамоилазы и дигидрооротазы. Этот фермент назвали "КАД-фермент" - по начальным буквам ферментативных активностей, которыми обладают отдельные каталитические домены этого белка. Объединение первых трѐх ферментов метаболического пути в единый полифункциональный комплекс позволяет использовать почти весь синтезированный в первой реакции карбамоилфосфат на взаимодействие с аспартатом и образование карбамоиласпартата, от которого отщепляется вода и образуется циклический продукт - дигидрооротат (рис. 10-13).
Отщепляясь от КАД-фермента, дигидрооротат подвергается дегидрированию NADзависимой дигидрооротатдегидрогеназой и превращается в свободное пиримидиновое основание - оротовую кислоту, или оротат.
Образование УМФ
В цитозоле оротат становится субстратом бифункционального фермента - УМФсинтазы, которая обнаруживает оротатфосфорибозилтрансферазную и ОМФдекарбоксилазную активности. Первоначально фосфорибозильный остаток от ФРДФ переносится на оротат и образуется нуклеотид - оротидин-5'-монофосфат (ОМФ), декарбоксилирование которого даѐт уридин-5-монофосфат (УМФ).
Таким образом, шесть последовательных реакций синтеза пиримидиновых нуклеотидов осуществляются тремя ферментами, которые кодируются в геноме человека тремя различными структурными генами.
Биосинтез УДФ, УТФ и иитидиловых нуклеотидов
УМФ под действием специфических нуклеозидмонофосфат (НМФ) и нуклеозиддифосфат (НДФ) киназ превращается в УДФ и УТФ в результате переноса
γ-фосфатного остатка АТФ на соответствующий субстрат.
НМФ-киназа катализирует следующую реакцию:
УМФ + АТФ → УДФ + АДФ,
а НДФ-киназа:
УДФ + АТФ → УТФ + АДФ.
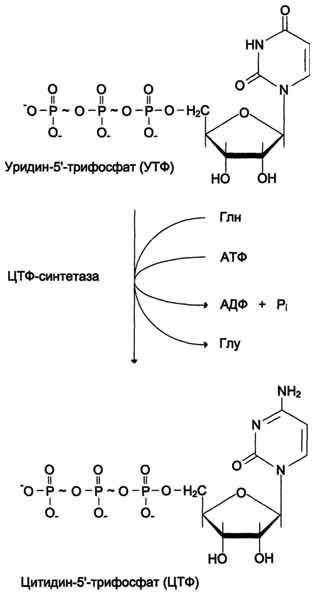
ЦТФ синтетаза катализирует амидирование УТФ (рис, 10-14), осуществляя АТФзависимое замещение кетогругшы урацила на амидную группу глутамина с образованием цитидин-5'-трифосфата (ЦТФ).
Б. "Запасные" пути синтеза пиримидиновых нуклеотидов
Использование пиримидиновых оснований и нуклеозидов в реакциях реутилизации препятствует катаболизму этих соединений до конечных продуктов с расщеплением пиримидинового кольца. В ресинтезе пиримидинов участвуют некоторые ферменты катаболизма нуклеотидов. Так, уридинфосфорилаза в обратимой реакции может рибозилироватъ урацил с образованием уридина.
Урацил + Рибозо-1-фосфат → Уридин + Н3РО4.
Превращение нуклеозидов в нуклеотиды катализирует уридин-цитидинкиназа.
Часть ЦМФ может превращаться в УМФ под действием цитидиндезаминазы и пополнять запасы уридиловых нуклеотидов.
ЦМФ + Н2О → УМФ + NH3.
В. Регуляция синтеза пиримидиновых НУКЛЕОТИДОВ
Регуляторным ферментом в синтезе пиримидиновых нуклеотидов является полифункциональный
534
Рис. 10-13. Биосинтез УМФ de novo.
535
Рис. 10-14. Синтез ЦТФ из УТФ.
КАД-фермент. УМФ и пуриновые нуклеотиды аллостерически ингибируют, а ФРДФ активирует его карбамоилсинтетазную активность, тогда как активность аспартаттранскарбамоилазного домена ингибирует ЦТФ, но активирует АТФ (рис. 10-15).
Этот способ регуляции позволяет предотвратить избыточный синтез не только УМФ, но и всех других пиримидиновых нуклеотидов и обеспечить сбалансированное образование всех четырѐх основных пуриновых и пиримидиновых нуклеотидов, необходимых для синтеза РНК.
32.Распад хромопротеинов.
Старые эритроциты поступают в селезенку, где перекисным окислением высвобождается гемоглобин, который попадает в плазму крови и там он встречается с белком гаптоглобином. Образуется гемоглобин-гаптоглобиновый комплекс, он поступает в ретикулоэндотелиальную систему, гаптоглобин отсоединяется и гемоглобин поступает в клетку. Превращения гемоглобина протекает: 1) в клетках РЕС – купферовские клетки печени. 2) в гепатоцитах печени. 3) в ЖКТ – кишечник. 1) Под действием гемоксигеназной дециклизующей системы происходит разрыв метиленовых мостиков гемоглобина между первым и вторым пирольными кольцами и молекула разворачивается превращаясь в вердоглобин. Происходит отсоединение белка глобина, который
под действием катепсинов расщепляется на а/к. Также отсоединяется эндогенный СО – угарный газ, который обладает большим сродством к гемоглобину и образуется карбоксигемоглобин HbCO. Отсоединяется железо (идет в депо в форме ферритина), оставшийся линейный тетраферон – биливердин – 1 желчный пигмент, нетоксичен, хорошо растворим в воде, зеленого цвета, он восстанавливается при участии НАДФ-зависимой редуктазы он превращается в билирубин – красно-коричневый пигмент, токсичен, плохо растворим в воде. Из клеток РЕС билирубин поступает в кровь и взаимодействует с альбуминами, образуя альбумин-билирубиновый комплекс (непрямой). Если концентрация билирубина в крови очень высока, тогда он поступает в ткани и они приобретают желтое окрашивание. Ядерная желтуха – билирубин не полностью адсорбируется на альбуминах и поражает ядра ЦНС. Непрямой (не дает прямую реакцию с диазореактивом Эрлиха, сначала надо адсорбировать альбумины с помощью спиртов) несвязанный (химически несвязан) неконъюгированный (не конъюгированный с кислотой) билирубин. 2) Превращение билирубина в гепатоцитах: транспорт билирубина из плазмы крови в ЭПС гепатоцитов – билирубин конъюгирует с активной формой глюкуроновой кислоты под действием фермента УДФ-глюкоронилтрансферазы, образуется билирубиндиглюкоронид (БДГ) – прямой билирубин, происходит конъюгация, изменяются свойства и соединение становитсянетоксичным, хорошо растворимым в воде. БДГ – 75% идет в ЖКТ, это энергозависимый процесс. До 25% из гепатоцитов поступает в кровь – прямой конъюгированный связанный билирубин, он сразу реагирует с деазореактивом Эрлиха. 3) БДГ поступает в ЖКТ, в кишечник и при участии глюкоронидаз отсоединяется глюкуроновая кислота от БДГ и образуется мезобилирубин, который восстанавливается под действием редуктаз в уробилиноген (мезобилиноген) – большая часть всасывается в вену портэ и поступает в печень, там он разрушается до моно и дипироллов (поступают в желчь; при патологии мезобилиноген не разрушается, он поступает в кровь и выводится с мочой, оказывает токсическое действие на органы и ткани ЦНС). Малая часть уробилиногена выводится с мочой и в отдельных порциях не обнаруживается. Мезобилиноген восстанавливается в стеркобилиноген – пигмент кала, небольшая часть всасывается через вены и выводится с мочой – цвет мочи соломенно-желтый, основная часть выводится через кишечник. У новорожденных стул зеленый – миконий – потому, что билирубин не восстанавливается микрофлорой кишечника (т.к. ее еще нет) и он окисляется в биливердин. Общее содержание билирубина определяется суммой прямого и непрямого билирубина. Общий билирубин 8,5-20,5 ммоль/литр. Прямой билирубин меньше 5 ммоль/литр. Непрямой билирубин расчетная величина – общий билирубин минус прямой билирубин. У новорожденных общий билирубин 20,5-200 ммоль/литр.
33.Синтез гемоглобина. Обмен железа.
Нb является хромопротеидом и относится к подгруппе неэнзимных (неферментных) хромопротеидов. Гемоглобин состоит из белковой части – глобин и небелковой части – гем. Нb состоит из 4 субъединиц, каждая из них состоит из гема, который соединен с глобином (состоит из 2х альфа и 2х бета цепей). Глобин синтезируется из а/к на рибосомах. Связь гема и глобина. Железо имеет валентность +2, имеет 6 координационных связей, 2 из них идут к атомам азота пиррольных колец, 5ая к азоту имидозольного кольца гистидина. 6ая соединяется с кислородом и образуется оксигемоглобин, который отдает кислород и образуется связь с имидозольным кольцом гистидина. Часть а/к вблизи окружения гема называются инвариантными - они не изменяются, замена а/к невозможна, если этого не происходит развиваются аномалии.
Синтез гема. В 1948 году Давид Ротенберг и Паул Фишер изучали синтез гема, они выделили основные ферменты, которые участвуют в синтезе гема, их место расположение (костный мозг, печень, почки, слизистая кишечника).
Исходные продукты синтеза гема – сукцинилКоА, глицин. В начале синтез происходит в митохондриях и под действием фермента синтетазы дельта-аминолевуленовой кислоты кофермент - В1, В6, липолевая кислота, и образуется альфа-амино-бета-кетоадипиновая кислота, затем дельта-аминолевуленовая кислота, она из митохондрий выходит в цитоплазму клетки и там происходит конденсация 2х молекул дельта-аминолевуленовой кислоты под действием дегидротазы дельта-аминолевуленовой кислоты и образуется одно циклическое соединение – порфобилиноген.
Далее происходит конденсация четырех молекул порфобилиногена по принципу «голова к хвосту», под действием уропорфириногена-1-синтетазы и уропорфириногена-3-косинтазы образуется уропорфириноген 3. Затем уропорфириноген 3 под действием декарбоксилазы превращается в копропорфириноген 3, который возвращается в митохондрии и все оставшиеся реакции происходят там. Из копропорфириногена 3 под действием копропорфириногеноксидазы образуется пропорфириноген 9. Далее происходит восстановление пропорфириногена 9 в протопорфирин 9 и внедряется железо (гемоксидаза), в результате чего образуется гем.
Регуляция синтеза гема происходит по принципу обратной связи, т.е. гем ингибирует первый фермент синтеза (синтетазу дельта-аминолевуленовой кислоты), а также может ингибироваться и второй фермент (дегидротаза дельта-аминолевуленовой кислоты). Если отмечается снижение концентрации глобина в клетке, то происходит самопроизвольное окисление протопорфирина 9 в пропорфериноген 9, т.о. железо не внедряется и накапливается в клетке, концентрация железа увеличивается и происходит активация процесса синтеза глобина.
Обмен железа. В организме железо находится в 2х видах – клеточное железо и внеклеточное железо. Клеточное железо – входит в состав ферментных гемопротеидов (гемоглобин, миоглобин). Внеклеточное железо – это белки, которые связывают железо и транспортируют его (трансферин, лактоферин). Железо в организме совершает постоянный кругооборот. При распаде клеточных структур железо освобождается и 9/10 используется повторно, а 1/10 выводится из организма. Замена железа происходит с пищей, с продуктами содержащими железо (мясо, печень, почки, салат, сухофрукты, абрикос, укроп). 25 мг железа в сутки поступает в желудок, где железо высвобождается и только 1 мг подвергается всасыванию с помощью аскорбиновой кислоты в желудке, основная масса железа всасывается в 12перстной кишке. Способствуют всасыванию - белки, продукты содержащие аскорбиновую кислоту, чай и кофе ингибирует этот процесс; алкоголь улучшает всасывание железа.
Железо поступает в кровь, соединяется с трансферрином, который относится к бета-глобулиновой фракции, и в результате образуется комплекс и железо транспортируется к органам депо – печень, костный мозг, селезенка, плацента. Т.О. трансферин (15 типов – С) транспортирует железо в депо, где оно высвобождается и поступает в клетку.
Железо поступает в клетку и откладывается в форме ферритина – это не токсичное, хорошо растворимое в воде соединение, одна молекула феритина может соединять до 4,5 тысяч атомов железа. В феритине Fe3+.
Гемосидерин содержит гранулы железа – это белок, он является токсичным, т.к. содержит очень много железа и т.к. в организме человека нет путей экскреции железа из клетки развивается гемосидероз. Ему подвергается печень вследствие осложнения таких заболеваний, как гемолитическая и апластическая анемия. Лечение – переливание крови.
34.Производные моносахаридов – фосфорные эфиры, уроновые кислоты,
аминосахара.Фосфорные эфиры: 1) глюкозо6фосфат – активная форма глюкозы, с нее начинается превращения углеводов. Глюкоза + АТФ под действием гексокиназы превращается в глюкозо6фосфат, глюкозо1фосфат. Глю6ф идет на синтез гликогена. При распаде гликогена образуется глюкозо1фосфат и из нее глкозо6фосфат. Глюкозо6фосфат участвует в гликолизе, в результате чего образуется ПВК. С глюкозо6фосфата начинается ПФЦ, в результате чего образуется рибозо5фосфат. 2) Рибозо5фосфат – образуется в пирофосфатном цикле, входит в структуру мононуклеотидов – НАД, ФАД, АТФ, ДНК, РНК. Рибозо5фосфат + АТФ образуется фосфорибозилпирофосфат, который идет на синтез пуриновых азотистых оснований. Уроновая кислота – глюкуроновая кислота, в 6 положении СООН группа. Аминосахар – глюкоозамин, фруктозамин, галактозамин. Уроновые кислоты и аминосахара являются структурными компонентами ГАГ – высокомолекулярные соединения, мономером является дисахаридная единица, которая представлена уроновой кислотой, которая соединена альфа-1,3 гликозидной связью с аминосахаром.
35.Гомополисахариды.
К ним относятся крахмал и гликоген. Общая формула [С6Н10О5]n. Гликоген – главный резервный полисахарид, построенный из остатков альфа-D-глюкозы, запасается в тканях печени и мышцах. Представляет собой амилозную цепь, в которых остатки глюкозы связаны альфа-1,4-гликозидной связью. Цепь амилопектина имеет ветвления. В точках ветвления имеются альфа-1,6- гликозидные связи. Чем больше точек ветвления тем лучше растворяется гликоген. В ЖКТ гликоген под действием амилолитических ферментов, а в тканях фосфорилазы распадается на декстрины. Они под действием альфа-амилазы в 12-перстной кишке распадаются на олигосахариды, в толстом кишечнике под действием специфических олигосахаридаз расщепляются до мальтодекстринов, лактоза под действием бета-галактозидазы распадается на глюкозу и галактозу. Лактоза (бета-галактозидаза) глюкоза + галактоза, сахароза (сахараза) глюкоза + фруктоза, мальтоза (мальтаза) 2 глюкозы.
36.Гетерополисахариды– ГАГ всегда связаны с белком. В их состав входят остатки мономера либо гликозамина, либо галактозамина, а также D-глюкуроновая или L-идуроновая кислоты.
ГАГ – высокомолекулярные соединения, мономером является дисахаридная единица, которая представлена уроновой кислотой, которая соединена альфа-1,3 гликозидной связью с аминосахаром.

Различают 7 классов ГАГ: 1) гиалуроновая кислота – распространена в почках, стекловидном теле, синавиальной жидкости, пупочном канатике, смазка в суставах, барьер против проникновения микроорганизмов; с возрастом количество уменьшается; 2, 3) хондроэтин4сульфат и хондроэтин6сульфаты - состоят из уроновых кислот, соединенных с галактозамином; они находятся в костной ткани, с возрастом количество уменьшается; 4) дерматансульфаты – состоят из итуроновой кислоты и аминосахара ацетилированного и сульфированного;5) керотансульфаты – не содержат уроновых кислот, в состав входит Д- галактоза с ацетилированным и сульфированным сахаром, сиаловые кислоты, обуславливают прозрачность роговицы; 6) гепарин – находятся на поверхности многих клеток, в тучных клетках внутренний элемент, содержит несколько остатков серной кислоты; выполняет роль антикоагулянта в комплексе с липопротеидами плазмы, соединяются с липопротеинлипазой, становится активнои и расщепляет липиды в составе хилоникронов; 7) гепарансульфаты – по структуре похож на гепарин, но содерж ит меньше сульфатных групп, синтезируется при участии гликозилтрансфераз – переносят ост Угле в с активных форм. Каждый раз увеличивается на 1ну молекулу углевода.
37.Переваривание и всасывание углеводов в ЖКТ. Судьба всосавшихся моносахаридов.
Переваривание углеводов в желудочно-кишечном тракте - это часть метаболизма углеводов, совокупность управляемыхпроцессов, осуществляемых в системе пищеварения, которые представляют собой химическую переработку углеводов, поступающих в организм с пищей, для последующего их всасывания в кровь и в лимфу.
Пищевые вещества содержат крупномолекулярные белки, углеводы и липиды, которые не способны к всасыванию в кровь и лимфу из-за больших размеров своих молекул. Химическая переработка пищи в желудочно-кишечном трактепредставляет собой последовательное ступенчатое ферментативное гидролитическое расщепление крупномолекулярных белков, углеводов и липидов до простых веществ, способных к всасыванию.
В числе углеводов потребляемой пищи содержатся полисахариды крахмал и гликоген. Расщепление этих углеводов начинается в полости рта и продолжается в желудке. Катализатором гидролиза является фермент α-амилаза слюны. При
расщеплении из крахмала и гликогена образуются декстрины и в небольшом количестве - мальтоза. Пережеванная и смешанная со слюной пища проглатывается и попадает в желудок. Проглоченные пищевые массы со стороны поверхности полости желудка постепенно перемешиваются с желудочным соком, содержащим соляную кислоту. Содержимое желудка с периферии приобретает значительную кислотность (pH =
1,5 ÷ 2,5). Такая кислотность дезактивирует амилазу слюны. В то же время в толще массы желудочного содержимого амилаза слюны некоторое время продолжает
действовать и происходит расщепление полисахаридов с образованием декстринов и мальтозы. Желудочный сок не содержит ферментов, расщепляющих сложные углеводы. Поэтому гидролиз углеводов с увеличением кислотности в желудке прерывается и возобновляется в двенадцатиперстной кишке.
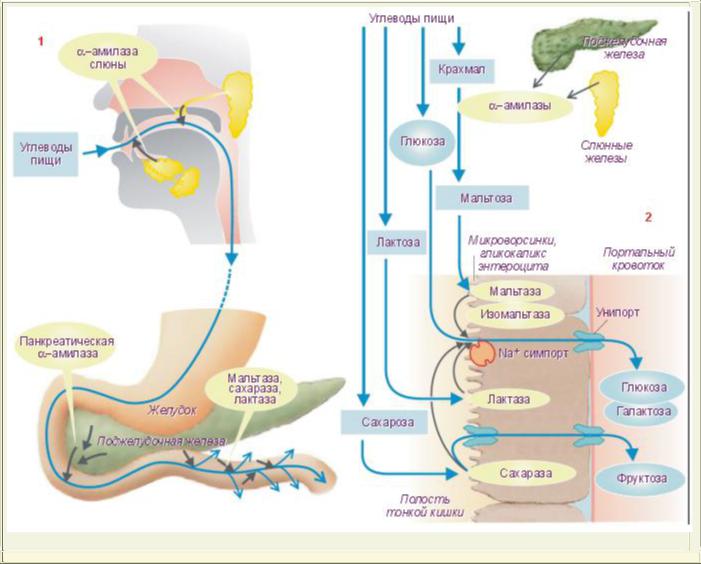
В двенадцатиперстной кишке происходит наиболее интенсивное переваривание крахмала и гликогена с участием α-амилазы сока поджелудочной железы. В двенадцатиперстной кишке кислотность значительно снижается. Среда становится практически нейтральной, оптимальной для максимальной активности α-амилазы панкреатического сока. Поэтому гидролиз крахмала и гликогена с образованием мальтозы, который начинался в полости рта и в желудке с участием α-амилазы слюны, в тонкой кишке завершается. Процессу гидролиза с участием α-амилазы панкреатического сока дополнительно способствуют еще два фермента: амило-1,6-глюкозидаза и олиго- 1,6-глюкозидаза (терминальная декстриназа).
Образовавшаяся в результате начальных стадий гидролиза углеводов мальтоза, гидролизуется с участием ферментамальтазы (α-глюкозидазы) с образованием двух молекул глюкозы.
Пищевые продукты могут содержать углевод сахарозу. Сахароза расщепляется при участии сахаразы - фермента кишечного сока. При этом образуются глюкоза и фруктоза.
Пищевые продукты (молоко) могут содержать углевод лактозу. Лактоза гидролизуется с участием фермента кишечного сокалактазы. В результате гидролиза лактозы образуются глюкоза и галактоза.
Таким образом углеводы, содержащиеся в пищевых продуктах, расщепляются на составляющие их моносахариды: глюкозу, фруктозу и галактозу. Конечные стадии гидролиза углеводов осуществляются непосредственно
на мембране микроворсинокэнтероцитов в их гликокаликсе. Благодаря такой последовательности процессов, завершающие стадии гидролиза и всасывание тесно сопряжены (мембранное пищеварение).
Моносахариды и небольшое количество дисахаридов и всасываются энтероцитами тонкой кишки и попадают в кровь.Интенсивность всасывания моносахаридов различна. Всасывание маннозы, ксилозы и арабинозы осуществляется преимущественно путем простой диффузии. Всасывание же большинства других моносахаридов происходит за счет активного транспорта. Легче других моносахаридов всасываются глюкоза и галактоза. Мембраны микроворсинок энтероцитов содержатсистемы переносчиков, способных связывать глюкозу и Na+ и переносить их через цитоплазматическую мембрану энтероцита в его цитозоль. Энергия, необходимая для такого активного транспорта, образуется при гидролизе АТФ.
Большая часть моносахаридов, всосавшихся в микрогемациркуляторное русло кишечных ворсинок, попадают с потоком крови через воротную вену в печень. Небольшое количество (~10%) моносахаридов поступает по лимфатическим сосудам в венозную систему. В печени значительная часть всосавшейся глюкозы
превращается в гликоген. Гликоген резервируется в клетках печени (гепатоциты) в виде гранул
38.Анаэробный распад глюкозы. Синтез и распад гликогена, регуляция активности фосфорилазы и гликогенсинтетазы. Синтез гликогена.
Анаэробный распад глюкозы – гликолиз это сложный ферментативный процесс превращения глюкозы до молочной кислоты без потребления кислорода. Гликолиз протекает в гиалоплазме клетки. Суммарное уравнение: С6Н12О6 + 2АДФ + 2Фн 2 CH3CH(OH)COOH + 2АТФ + 2Н2О. Глюкоза под действием гексокиназы превращается в глюкозо-6-фосфат,под действием глюкозо-6- фосфат-изомеразы превращается в фруктозо-6-фосфат,под дейст.6-фосфофруктокиназы в фруктозо-1,6-бифосфат, под действ.альдолазы в диоксиацетонфосфат и глицеральдегид-3- фосфат, из диоксиацетон-фосфата под действ.триозофосфатизоизомеразы в глицеральдегид-3- фосфат,под дейст глицеральдегид-фосфат-дегидрогеназы в 1,3-бифосфоглицерат,под действ.фосфоглицераткиназы в 3-фосфоглицерат,под действ.фосфоглицеромутазы в 2- фосфоглицерат, под действ енолазы в фосфоенолпируват, под действ. пируваткиназы в пируват, под действ.лактатдегидрогеназы в лактат.
Для синтеза гликогена необходима затравка (С6Н10О5) n >= 4 + УДФ-глюкоза под действием гликогенсинтетазы до (С6Н10О5) n + 1 + УДФ. Активность гликогеОнсинтетазы регулируется гормонами: инсулином, глюкогоном, адреналином. Регуляция активности гликогенсинтетазы происходит путем ковалентной модификации (фосфорилирование/дефосфорилирование). Инсулин активирует гликогенсинтетазу, уровень глюкозы в крови снижается. Адреналин ингибирует гликогенсинтетазу, уровень глюкозы в крови увеличивается. Синтез гликогена происходит в печени, в лимфе, лейкоцитах. Синтез амилопектина происходит под действием гликозилтрансферазы. Она берет участок линейной цепи амилазы, переносит его с образованием ветвления. Распад гликогена – фосфоролиз под действием фосфорилазы. (С6Н10О5)n + Н3РО4 под действием фосфорилазы образуется (С6Н10О5)n–1 + глюкоза1фосфат, которая под действием фосфоглюкомутазы в глюкоза6фосфат и под действием глюкоза6фосфатазы в глюкозу. Фосфорилаза активна в фосфорилированной форме (а- актавная форма – 4 субъединицы; В – неактивная форма – 2 субъединицы). 2фосфорилаза-В + 4АТФ под действием киназафосфорилаза образуется фосфорилаза-А + 4АДФ Адреналин активирует фосфорилазу путем присоединения Н3РО4, а инсулин оказывает противоположное действие
.
