
Ado_A_D_Patologicheskaya_fiziologia
.pdf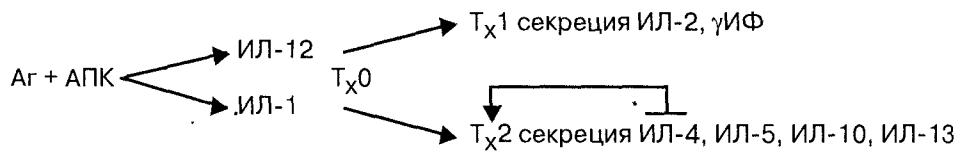
дифференцировки нулевых Т-хелперных клеток (Тх -0). При обычном от вете на антиген Тх 0 дифференцируется главным образом в Т х 1 , которые секретируют ИЛ-2 (интерлейкин-2), у-интерферон (у-ИФ) и ряд других медиаторов, что активирует развитие клеточного механизма иммунитета (схема 5.1).
Схема 5.1. Пути дифференцировки ТхО-клеток и роль некоторых интерлейкинов. Аг — антиген; АПК — Аг-представляющая клетка, ИЛ — интерлейкин, Тх — Т-хелперная клетка.
У людей, предрасположенных к развитию атонических реакций, име ется сдвиг дифференцировки Тх 0 в сторону преимущественного образо вания Тх 2-клеток. Последние секретируют главным образом ИЛ-4, ИЛ-5, ИЛ-3, ИЛ-10 и ряд других медиаторов. Эти медиаторы, особенно ИЛ-4, переключают в В-лимфоцитах синтез антител с в-класса на Е-класс. Меж ду Т х 1 - и Тх 2-зависимыми ответами имеется конкуренция. При преобла дании Тх 2-зависимого ответа угнетается Тх 1-зависимый ответ и наобо рот. В связи с этим при атопических заболеваниях выявляют угнетение клеточного и в определенной степени гуморального звеньев иммунитета, что в далеко зашедших случаях приводит к развитию инфекционных про цессов в виде пиодермии, хронического отита, гайморита, бронхита и др.
У здоровых людей содержание общего 1дЕ в плазме крови варьиру ет от 0 до 40—60 ед/мл (1 Международная единица = 2,4 нг). Оно наи меньшее при рождении, затем увеличивается и к 10—12-летнему возра сту стабилизируется. При атопических заболеваниях в 80—85 % случаев концентрация общего 1дЕ повышается до 100—120 ед/мл и более и мо жет достигать нескольких тысяч единиц. Общим он называется потому, что в его состав входят как 1дЕ-антитела к определенному аллергену, так
имолекулы 1дЕ, которые неспецифичны к данному аллергену. Одновре менно с увеличением общего 1дЕ возрастает, как правило, и специфичес кий 1дЕ. Однако в ряде случаев при атопических заболеваниях вместе с повышением уровня общего 1дЕ или без такового в сыворотке крови об наруживали 1д04, который, как и 1дЕ, может фиксироваться набазофилах
ивыполнять роль реагинов.
Образовавшиеся под влиянием аллергена 1дЕ-антитела и мо лекулы неспецифического 1дЕ фиксируются на клетках через Гс-
рецепторы. Различают два вида этих рецепторов. Первый вид — клас сические высокоаффинные рецепторы (Рс8Я1), которые находятся на тучных клетках и базофилах. Считают, что на одном базофиле может фик-
148
сироваться от 30x103 до 400x103 молекул IgE. Большая их часть приходит ся на молекулы неспецифического IgE; концентрация специфического IgE, как правило, меньше. Второй тип рецепторов — низкоаффинные (FceRII). Они находятся на макрофагах, эозинофилах и тромбоцитах и не имеют перекрестной специфичности с первым видом рецепторов. Афинность этих рецепторов, как и число несущих их клеток, может возрастать. Это ведет к тому, что начальный механизм развития аллергической реак ции немедленного типа (ранняя фаза в первые 15—20 мин) может иметь продолжение в виде отсроченной фазы (через 4—8 ч), характеризую щейся развитием воспаления; В развитии отсроченной фазы большую роль играет накопление в месте начальной реакции клеток, участвующих в воспалении. Это главным образом эозинофилы, а также нейтрофилы, макрофаги и лимфоциты. На их поверхности через рецепторы второго типа фиксируется специфический IgE. С ним соединяется соответствую щий аллерген, в результате эти клетки высвобождают ряд медиаторов, обладающих провоспалительной активностью (катионные белки, актив ные формы кислорода и др.)- Поздняя фаза аллергических реакций немедленного типа у больных бронхиальной астмой проявляется повы шением чувствительности и реактивности бронхов к различным неспе цифическим раздражителям (холодный воздух, острые и резкие запахи и др.) и сопровождается бронхиальной обструкцией. У лиц, перенесших анафилактический шок, он может повториться (через несколько часов после того, как пациент был выведен из этого состояния). У15—20 % боль ных атопией общий IgE находится в пределах нормы или ее верхней гра ницы. Кроме атопических заболеваний, уровень IgE может повышаться при респираторных вирусных заболеваниях, некоторых первичных иммунодефицитах, заболеваниях печени.
Патохимическая стадия реакции I типа начинается после связыва ния аллергена с lgE-антителами, как циркулирующими, так и фиксиро1 ванными на клетках (аллерген образует мостики между фиксированными на клетках lgE-антителами).
Активация тучных и базофильных клеток приводит к высвобождению различных медиаторов, что морфологически определяется как их дегрануляция. Процесс высвобождения медиаторов требует энергетического обеспечения, поэтому блокада энергообразования блокирует и выброс медиаторов.
Из тучных клеток и базофильных лейкоцитов выделены различные медиаторы, причем некоторые из них находятся в клетках в готовом виде. Одни из них легко секретируются из имеющегося «запаса» (гистамин, серотонин, различные эозинофильные хемотаксические факторы), дру гие труднее высвобождаются из клетки, так как входят в состав матрикса гранул (гепарин, арилсульфатаза А, галактозидаза, хемотрипсин, супероксиддисмутаза и др.). Ряд медиаторов предварительно не депониру ется. Они образуются после стимуляции клетки (лейкотриены, тромбоцитактивирующие факторы и др.). Эти медиаторы, обозначаемые как первичные, действуют на сосуды и клетки-мишени опосредованно, вклю-
149
чая в развитие аллергической реакции эозинофилы, тромбоциты и дру гие клетки. В результате к месту активации тучных клеток мигрируют эозинофильные и нейтрофильные гранулоциты, которые в свою очередь также начинают выделять медиаторы, обозначаемые как вторичные — фосфолипаза Д, арилсульфатаза В, гистаминаза (диаминооксидаза), лейкотриены и др.
Накапливающиеся медиаторы оказывают патогенное действие на клетки, что приводит к развитию патофизиологической стадии.
Неспецифические механизмы:
1)нарушения равновесия влияний симпатической и парасимпатичес кой иннервации систем организма, менее выраженные при рините и наи более резко — при атопическом дерматите.
При всех трех классических атопических заболеваниях увеличена холинергическая реактивность, что проявляется более резким сужением зрачка на закапывание в глаза холиномиметиков по сравнению с тако вым у здоровых лиц. При сочетании астмы с дерматитом усилено спон танное и стимулированное холиномиметиками потоотделение. При атопической астме, кроме того, повышен холинергический тонус бронхов, что проявляется либо приступом астмы, либо повышением реактивности и чувствительности бронхов при проведении провокационных тестов с хо линомиметиками.
При атопии р-2-адренергическая реактивность снижена. А. Эгеп1маИу! (1968) выдвинул даже Р-адренергическую теорию атопических на рушений при бронхиальной астме и развития атопии вообще. Сниженная Р2 -адренореактивность проявляется меньшей степенью гликогенолиза, липолиза, повышения пульсового давления и образования цАМФ в лей коцитах при добавлении адреналина или изопротеринола по сравнению с таковой у здоровых лиц.
Одновременно усиливается а-адренореактивность, что не выявля ют при ринитах; ее можно обнаружить при астме и особенно резкое уве личение при атопическом дерматите. У последних отмечается выражен ная вазоконстрикция в виде белого дермографизма, бледного цвета кожи лица и снижения температуры кожи пальцев; 2) повышенная способность тучных клеток и базофилов высвобождать
медиаторы как спонтанно, так и в ответ на различные неиммунологичес кие стимулы. Установлено, что базофилы больных атопическим ринитом и/или астмой, атопическим дерматитом более легко, чем лейкоциты здо ровых людей, высвобождают гистамин в ответ на различные неиммуно логические (неспецифические) стимулы (метахолин, Кон-А, кальциевые ионофоры, полимиксин-В и др.). Более того, у этих больных возможно спонтанное выделение гистамина базофилами. Аналогичными свойства ми обладают тучные клетки из бронхоальвеолярного смыва у больных атопической астмой. Этот эффект связывают с повышенной активностью в клетках фосфодиэстеразы цАМФ и снижением концентрации последне го. Угнетение фосфодиэстеразы в этих клетках приводило к повышению уровня цАМФ и нормализации высвобождения гистамина;
150
3) известно, что атопия сопровождается различной степенью эозинофилии и инфильтрацией слизистых оболочек и секретов дыхательных пу тей и желудочно-кишечного тракта.
В то же время, факт расположения на разных хромосомах генов, от ветственных за формирование атопического генотипа, приводит к неза висимости и случайности передачи ряда генов потомству и, следователь но, к различной совокупности этих генов у каждого индивидуума. В связи с этим у одних окажется более или менее полный атопический генотип, у других определяется набор генов, кодирующих развитие преимуществен но специфических или неспецифических механизмов, и у третьих — только неспецифических механизмов. Отсюда и возможность различных фенотипических проявлений атопии: от ее полной картины до единичных при знаков из атопического фенотипа, причем эти признаки могут относить ся как к специфическим, так и неспецифическим компонентам атопии. В связи с этим по отношению к атопии всех людей можно разделить на сле дующие 3 конституциональных типа: атопический, псевдоатопический и неатопический. К последнему относятся люди, не имеющие в своем ге нотипе генов, кодирующих специфические и неспецифические механиз мы. Особенности реактивности каждого из этих типов представлены в табл. 5.4.
|
|
|
Таблица 5.4 |
Особенности реактивности людей трех конституциональных типов |
|||
|
|
|
|
Признаки |
|
Тип конституции |
|
|
|
|
|
|
атопический |
псевдоатопический |
неатопический |
|
|
|
|
Механизмы |
Специфические и |
Только или |
Нет |
развития атопии |
неспецифические |
главным образом |
|
|
|
неспецифические |
|
Преобладание |
Нет |
Есть |
Есть |
Тх 1-зависимой |
|
|
|
реакции |
|
|
|
Преобладание |
Есть |
Нет |
Нет |
Тх 2-зависимой |
|
|
|
реакции |
|
|
|
Исходно сущест |
Есть |
Есть |
Нет |
вующая неспеци |
|
|
|
фическая гиперре |
|
|
|
активность тканей |
|
|
|
|
|
|
|
У лиц атопической конституции поступление аллергена сопровож дается развитием типичных атопических заболеваний (поллиноз, кругло годичный атопический ринит, атопический вариант бронхиальной астмы и др.). Лица с псевдоатопической конституцией, имеющие главным об разом неспецифические механизмы из атопического генотипа, не реаги руют на аллергены; причинными факторами у них становятся ирританты (раздражающие вещества) и псевдоаллергены (например, нестероидные
151
противовоспалительные препараты, физическая нагрузка и др.)- Прояв ления псевдоатопических заболеваний сходны с таковыми при истинных атопических заболеваниях, хотя они не имеют в своем патогенезе 1дЕопосредованных иммунных механизмов, поэтому общий 1дЕ у таких лиц в норме и не удается найти аллергена.
Объектом атопической альтерации может быть любая система орга низма. Развитие повреждения той или иной системы организма опре деляется не только его общими свойствами, или конституцией, но и осо бенностями реактивности того или иного «шокового» органа (системы организма). Именно это, наряду с природой аллергена и путями его по ступления и, определяет локализацию процесса и появление определен ного атопического заболевания.
Особенности реактивности «шокового» органа определяются мно гими влияниями на его функционирование. Из них наибольшую роль иг рает сдвиг в Оалансе влияний парасимпатического и симпатического от делов нервной системы на данный орган. Обычно это проявляется в какой-либо одной системе организма. Так, белый дермографизм выяв ляют только при атопическом дерматите, но его, как правило, не бывает при атопическом рините или астме. При астме повышена холинореактивность дыхательных путей, но она не проявляется при атопическом дерма тите, сопровождающемся поражением только кожи.
5.4.2. Механизмы обратимой обструкции дыхательных путей
Обратимая обструкция дыхательных путей — важнейшее проявле ние бронхиальной астмы.
Собственно бронхиальная астма — синдром, объединяющий группу заболеваний, которые развиваются под влиянием аллергенов, возбудителей инфекционных заболеваний рес пираторного тракта или ирритантов (псевдоаллергенов) у предрасположенных людей и характеризующийся гипер реактивностью бронхов, обратимой их обструкцией с клини ческими проявлениями приступов удушья и эозинофилией.
Таким образом, для развития этого синдрома должна быть предрас положенность, для которой характерны особенности регуляции дыхатель ных путей, создающие состояние их гиперреактивности, что выражается в повышении чувствительности дыхательных путей к различным раздра жителям эндогенного или экзогенного происхождения. Основой регуля ции являются неспецифические механизмы из атопического фенотипа.
Известно, что по отношению к атопии можно выделить 3 конститу циональных типа людей (см. табл. 5.4). Имеются и три группы причин, вызывающих развитие обратимой обструкции дыхательных путей. В свя зи с этим в зависимости от конституционального типа действие причин ных факторов будет реализовываться через различные механизмы (схе ма 5.2). У лиц с атопической конституцией аллергены и возбудители инфекции как аллергены включают иммунный 1дЕ-опосредованный и не-
152
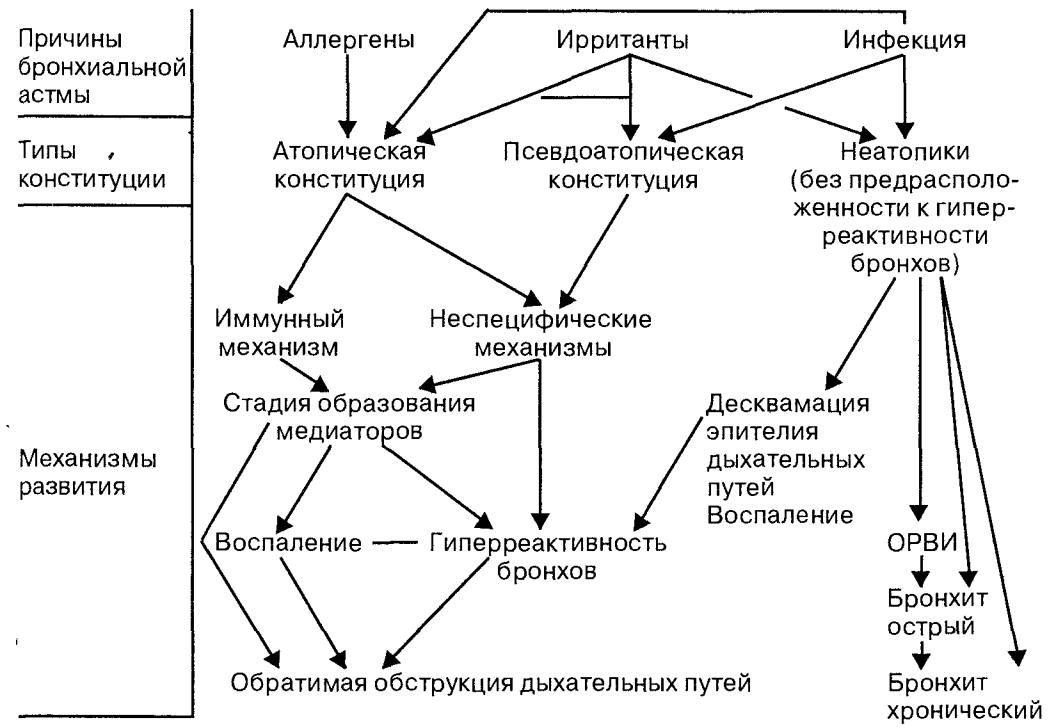
специфический механизмы. Через специфический механизм стимулиру ется образование медиаторов тучными клетками слизистой оболочки бронхов. Одни из них, обладающие бронхоконстрикторным свойством (лейкотриены С4, Д4, Е4, тромбоцитактивирующий фактор, гистамин и др.), вызывают бронхоспазм в течение 10—15 мин после контакта с аллерге ном. Группа провоспалительпых медиаторов (хемотаксические факторы, способствующие хемотаксису эозинофилов, нейтрофилов и их медиато ры, особенно эозинофильные катионные белки, молекулы адгезии, актив ные формы кислорода и др.) приводит к воспалению в слизистой оболоч ке бронхиальных путей, что в свою очередь усиливает гиперреактивность бронхов. Одновременно через неспецифические механизмы усиливают ся холинергические и а-адренергические влияния и снижается (3-адре- нореактивность, что может усилить не только высвобождение медиато ров тучными, эозинофильными и другими клетками, но и образование слизи и прямое бронхоконстрикторное действие. Играет роль и повышен ная способность тучных клеток, базофилов и др. отвечать высвобожде нием медиаторов на неспецифические раздражители. Развивающееся в результате действия медиаторов воспаление имеет характер эозинофильного десквамативного бронхита.
Схема 5.2. Взаимосвязь причинных факторов и конституциональных типов пациентов с механизмами развития обструкции дыхательных путей.
Лица с псевдоатопической конституцией либо не отвечают на ал лергены, либо иммунный ответ на них не опосредован 1дЕ-механизмами. Ирританты же действуют через неспецифические механизмы, оказывая
153
прямое влияние на тучные клетки слизистой оболочки, стимулируя осво бождение медиаторов, а также на чувствительные нервные окончания, вызывая рефлекторный бронхоспазм. Возбудители инфекции способству ют развитию воспаления в стенках дыхательных путей, что также ведет к усилению гиперреактивности бронхов. Однако характер воспаления от личается от такового у лиц с атопической конституцией. Клеточный ин фильтрат имеет эозинофильно-нейтрофильный характер. Кроме того, иммунный механизм развивается поТх 1-зависимому пути. Он направлен не только на возбудителя инфекции, но и на аутоаллергены в легочной ткани, образующиеся при инфекционном процессе. В этом заложена воз можность развития аутоаллергических механизмов повреждения тканей.
Улице неатопической конституцией аллергены не вызывают какойлибо видимой реакции. Ирританты могут приводить к развитию различ ных вариантов бронхита, а респираторные инфекционные процессы — к возникновению ОРВИ и различных видов банальных бронхитов. Посколь ку воспаление сопровождается в той или иной степени десквамацией эпи телия, то все это вместе взятое может спровоцировать развитие гипер реактивности бронхов с их обструкцией разной степени тяжести.
5.5. Псевдоаллергия
Псевдоаллергия (синонимы: неспецифическая, неиммунологичес кая аллергическая реакция; неиммунологический эквивалент аллергичес кой реакции; анафилактоидная реакция, если она протекает по типу ана филактического шока) — патологический процесс, клинически
сходный с проявлениями аллергической реакции, но не имеющий иммунологической стадии развития. Таким образом, при псевдоаллер гии, в отличие от истинной аллергии, отсутствует первая (иммунологи ческая) стадия развития. Остальные стадии — высвобождения (образо вания) медиаторов (патохимическая) и патофизиологическая (стадия клинических проявлений) сходны при псевдоаллергии и истинной аллер гии. Группа псевдоатопических реакций является составной частью псев доаллергии как более всеобъемлющего феномена, включающего и дру гие механизмы, которые не принимают участия в развитии атопии. Наряду с этим необходимо отличать псевдоаллергические реакции от клиничес ки сходных.
Основным критерием следует считать характер патохимической стадии заболевания. К лсевдоаллергическим процессам относят ся только те, в развитии которых ведущую роль играют такие медиаторы, которые образуются также и в период патохимической стадии истинных аллергических реакций.
Вещество, вызывающее развитие псевдоаллергии, называют псев доаллергеном. Псевдоаллерген действует непосредственно на клеткиэффекторы (тучные клетки, базофилы) или биологические жидкости 14 вызывает высвобождение из клеток или образование в жидкостях меди аторов. Псевдоаллергические реакции встречаются чаще всего при ле карственной и пищевой непереносимости. Многие лекарственные пре-
154
параты (ненаркотические анальгетики, рентгеноконтрастные вещества, плазмозамещающие растворы, плазма и др.) чаще способствуют разви тию псевдоаллергии, чем аллергии.
Впатогенезе псевдоаллергии принимают участие следующие ме ханизмы:
•гистаминовый;
•нарушения активации системы комплемента;
•нарушения метаболизма арахидоновой кислоты.
Вкаждом конкретном случае ведущую роль играет один из этих ме ханизмов.
5.5.1. Гистаминовый тип псевдоаллергии
Его суть заключается в увеличении в биологических жидкостях кон центрации свободного гистамина, который оказывает через и Н2-ре- цепторы клеток-мишеней патогенное действие. Н^рецепторы выявлены на гладких мышцах бронхов и сосудов; Н2-рецепторы — на париетальных клетках слизистой оболочки желудка. Гистаминовые рецепторы имеются на различных субпопуляциях лимфоцитов, тучных клетках, базофилах, эндотелиальных клетках посткапиллярных венул и др.
В легких гистамин вызывает спазм бронхов, в коже — расширение венул и повышение их проницаемости, что приводит к покраснению кожи
иразвитию ее отека, а при системном влиянии на сосудистую систему —
кгипотензии. Конечный результат действия гистамина определяется
местом его образования, концентрацией и соотношением и Н2-рецеп- торов на поверхности клеток. Увеличение концентрации гистамина при псевдоаллергии может идти несколькими путями:
1)действующие факторы оказывают прямое влияние на тучные клетки и базофилы и вызывают либо их разрушение и тем самым освобож дение медиаторов, либо, действуя на эти клетки через соответству ющие рецепторы, активируют их и тем самым вызывают секрецию . гистамина и других медиаторов. Выделение гистамина может быть весьма значительным;
2)увеличение содержания гистамина в связи с нарушением механиз мов его инактивации. В организме имеется несколько путей инакти
вации гистамина: окисление диаминоксидазой, метилирование азо та в кольце, окисление моноаминооксидазой или подобными ферментами, метилирование и ацетилирование аминогруппы боко вой цепи, связывание белком плазмы крови (гистаминопексия) и гликопротеидами. Мощность инактивирующих механизмов настолько велика, что введение через зонд в двенадцатиперстную кишку здо рового взрослого человека до 170—200 мг гистаминхлорида (из рас чета до 2,75 мг на 1 кг массы тела) вызывает через несколько минут небольшое ощущение прилива к лицу, при этом уровень гистамина в крови практически не увеличивается. У людей с нарушенной инактивирующей способностью значительно меньшая доза гистамина дает резко выраженные клинические проявления в виде головной боли,крапивницы,диареи;
155
3)увеличение концентрации гистамина в связи с поступлением его или других аминов с пищей. Так, в 1 г некоторых продуктов (ферментатированные сыры, копченые колбасы, рыбные консервы, шоколад и др.) содержится от 200 до 2000 мкг гистамина или тирамина;
4)дисбактериозы, сопровождающиеся увеличением кишечной микро флоры с декарбоксилирующей активностью, увеличивают образо вание гистамина, фенилэтиламина, тирамина из соответствующих аминов — гистидина, фенилаланина, тирозина.
5.5.2. Нарушение активации системы комплемента
Псевдоаллергические механизмы второго типа связаны с неадек ватным усилением классического или альтернативного пути активации комплемента. В результате активации комплемента образуются много численные пептиды с анафилатоксической активностью (С4а, С2Ь, СЗа, С5а и С5П Apr), которые вызывают высвобождение медиаторов из тучных клеток, базофилов, тромбоцитов, нейтрофилов, приводят к агрега ции лейкоцитов, повышению их адгезивных свойств, спазму гладких мышц и другим эффектам; при этом развивается анафилактоидная реакция вплоть до выраженного шока. Полисахариды и полианионы определен ной молекулярной массы активируют альтернативный путь каскада ком племента за счет связывания его третьего компонента. Выраженную актадацию комплемента вызывают протеазы. Так, плазмин и трипсин активируют CIs, С3 и фактор В, они же могут замещать фактор D. Калликреин расщепляет С3 с образованием СЗЬ. Компоненты комплемента (C1q) фиксируются на агрегированных молекулах у-глобулина, вызывая акти вацию всей системы комплемента. Агрегацию молекул белка in vivo на блюдают при криопатиях, in vitro—-при длительном хранении пастери зованной плазмы, растворов сывороточного альбумина человека, у-глобулина, особенно плацентарного. Внутривенное введение таких пре паратов в некоторых случаях вызывает выраженную активацию системы комплемента и приводит к развитию псевдоаллергии вплоть до анафилактоидного шока. Рентгеноконтрастные препараты также могут активи ровать комплемент. Это происходит в результате повреждения эндотелиальных клеток сосудов, что ведет к активации фактора Хагемана с последующим образованием плазмина, который активирует С1. Одновре менно активируется калликреин-кининовая система. Декстраны также способны активировать комплемент, что наблюдают при гемодиализе.
Наиболее демонстративные проявления псевдоаллергии разви ваются при дефиците ингибитора первого компонента комплемента — С1 -ингибитора, который представляет собой а2 -нейроаминогликопроте- ин с молекулярной массой 90 000 Д. В норме его концентрация в плазме крови составляет 18,0±5 мг%. Дефицит С1-ингибитора связан с мутаци ей гена (частота 1:100 000) и передается по наследству по аутосомнодоминантному типу. В большинстве случаев дефицит С1 -ингибитора свя зан с нарушением его синтеза в печени, что ведет к резкому снижению
156
концентрации этого ингибитора в плазме (до 17 % от нормы). Однако иног да сохраняется нормальный уровень С1 -ингибитора, но его структура ока зывается измененной; иногда уровень ингибитора даже увеличен. В по следнем случае он находится в комплексе с альбумином, в результате блокируется его активность. Дефицит ингибитора и сниженная его ак тивность приводят к развитию псевдоаллергической формы отека
Квинке.
Под влиянием различных повреждающих воздействий (например, удаление зуба и др.), физической нагрузки, эмоционального стресса происходит активация фактора Хагемана (ХИ-фактор свертывания крови). Последний включает плазминовую систему с образованием плазмина, ко торый в свою очередь запускает начальное звено классического пути ак тивации комплемента, начиная с С1. Активация происходит до СЗ и здесь прекращается, так какуСЗ свой ингибитор. Однако в начальном звене из С2 образуется кининоподобный фрагмент, который и вызывает повыше ние проницаемости сосудов и развитие отека Квинке.
5.5.3. Нарушения метаболизма арахидоновой кислоты
Механизмы третьего типа, участвующие в развитии псевдоаллер гии, связаны с нарушением метаболизма ненасыщенных жирных кислот и в первую очередь арахидоновой. Она высвобождается из фосфолипидов (фосфиглицеридов) клеточных мембран (нейтрофилы, макрофаги, тучные клетки, тромбоциты и др.)гпод действием внешних стимулов (по вреждение лекарством, эндотоксином и др.). Молекулярный процесс выс вобождения довольно сложен и включает как минимум два пути, которые начинаются с активации метилтрансферазы и заканчиваются накоплени ем кальция в цитоплазме клеток, где он активирует фисфолипазуА2Пос ледняя отщепляет арахидоновую кислоту от фосфоглицеридов. Освобо дившаяся арахидоновая кислота метаболизируется двумя путями: циклоксигеназным и липоксигеназным (схема 5.3). В первом пути мета болизма вначале образуются циклические эндопероксиды, которые за тем переходят в классические простагландины Е2, Е2а и ®2 (ПГЕ2, ПГР2а> ПГ02), простациклин и тромбоксаны. Во втором пути под влиянием липоксигеназ образуются моногидропероксижирные кислоты. Имеется не сколько липоксигеназ, каждая из которых вводит кислород в определен ное место молекулы арахидоновой кислоты. Хорошо изучены продукты, образующиеся под действием 5-липоксигеназы. Вначале образуется 5- гидропероксиэйкозаотетраеновая кислота (5-НРЕТЕ), которая может пре вращаться в нестабильный эпоксид — лейкотриен А4(ЛТА4). Последний может претерпевать дальнейшие превращения в двух направлениях: одно — энзиматический гидролиз до лейкотриена В4 (ЛТВ4), другое — присоединение глутатиона с образованием лейкотриена С4 (ЛТС4). По следующие дезаминирования переводят ЛТС4 в ЛТО4 и ЛТЕ4. Образую щиеся продукты метаболизма арахидоновой кислоты оказывают выра женное биологическое действие на функцию клеток, тканей, органов и
157
