
- •1. Строение атома
- •2. Химическая связь
- •3. Химическая термодинамика
- •Кинетика и равновесие химических реакций
- •Концентрация растворов
- •Электролитическая диссоциация
- •6 Гальванический элемент
- •Электролиз
- •Коррозия металлов
- •Энтальпии образования веществ, стандартные энтропии и температурные коэффициенты в уравнении теплоемкости
- •Электроотрицательность элементов по Полингу
- •Константы диссоциации кислот и оснований в водных растворах
- •Стандартные электродные потенциалы металлов (ряд напряжений)
Коррозия металлов
Задание.
1. Определите термодинамическую возможность коррозии металла А с деполяризацией Б в среде с концентрацией ионов металла, равной В (табл.13), при заданном pH (Т=298 К).
2. Напишите электронные уравнения процессов, протекающих на анодных и катодных участках.
При определении потенциалов водородного и кислородного электродов примите парциальные давления водорода и кислорода PH2 = 510-7 атм., PO2= 0,21 атм.
Значения стандартных электродных потенциалов металлов приведены в ряду напряжений.
Таблица 13
|
Номер вар. |
А |
Б |
В |
pH |
|
1 |
Свинец |
Кислородная |
0,001 |
7 |
|
2 |
Свинец |
Водородная |
0,1 |
0 |
|
3 |
Свинец |
Водородная |
0,01 |
7 |
|
4 |
Марганец |
Кислородная |
0,01 |
7 |
|
5 |
Алюминий |
Водородная |
0,001 |
7 |
|
6 |
Алюминий |
Водородная |
0,1 |
0 |
|
7 |
Никель |
Кислородная |
0,1 |
14 |
|
8 |
Никель |
Кислородная |
0,001 |
7 |
|
9 |
Никель |
Водородная |
0,1 |
0 |
|
10 |
Никель |
Водородная |
0,01 |
7 |
|
11 |
Железо |
Кислородная |
0,1 |
14 |
|
12 |
Железо |
Кислородная |
0,01 |
7 |
|
13 |
Железо |
Водородная |
0,1 |
0 |
|
14 |
Железо |
Водородная |
0,01 |
7 |
|
15 |
Медь |
Кислородная |
0,001 |
7 |
|
16 |
Медь |
Кислородная |
0,01 |
14 |
|
17 |
Медь |
Водородная |
0,0001 |
0 |
|
18 |
Медь |
Водородная |
0,01 |
7 |
|
19 |
Олово |
Кислородная |
0,01 |
14 |
|
20 |
Олово |
Кислородная |
0,01 |
7 |
|
21 |
Олово |
Водородная |
0,001 |
0 |
|
22 |
Марганец |
Водородная |
0,01 |
7 |
|
23 |
Олово |
Водородная |
0,1 |
7 |
|
24 |
Цинк |
Кислородная |
0,001 |
7 |
|
25 |
Цинк |
Водородная |
0,01 |
0 |
|
26 |
Цинк |
Водородная |
0,1 |
7 |
|
27 |
Марганец |
Кислородная |
0,01 |
14 |
|
28 |
Марганец |
Водородная |
0,1 |
0 |
|
29 |
Цинк |
Кислородная |
0,1 |
14 |
|
30 |
Свинец |
Кислородная |
0,1 |
14 |
Пример 1. Определите термодинамическую возможность коррозии хрома с кислородной деполяризацией в щелочном растворе (pH 14) с концентрацией ионов Cr3+, равной 0,001 моль/л.
Решение. Коррозия как самопроизвольный процесс протекает, если энергия Гиббса реакции имеет отрицательное значение (G<0).
G = -nFЭДС,
где n – число электронов, участвующих в процессе,
F – постоянная Фарадея (96500 Кл).
Для расчета ЭДС
рассчитаем потенциал окислителя (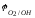 )
и восстановителя (
)
и восстановителя (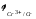 ).
Определим потенциал кислородного
электрода при 298 К согласно уравнению:
).
Определим потенциал кислородного
электрода при 298 К согласно уравнению:
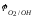 =1,23+0,0147lgP02
– 0.059 pH=1.23+0.0147lg
0,21-0,05914=0,391
В.
=1,23+0,0147lgP02
– 0.059 pH=1.23+0.0147lg
0,21-0,05914=0,391
В.
Рассчитаем потенциал металла в указанной среде:
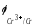 =
=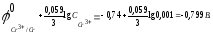
ЭДС=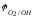 -
-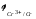 =0,.391-(-0,799)
=1.19B.
=0,.391-(-0,799)
=1.19B.
ЭДС>0, следовательно, G<0. Коррозия возможна и описывается следующими уравнениями процессов, протекающих на анодных и катодных участках:
Анод Cr – 3e = Cr3+.
Катод O2+2H2O+4e = 4OH-.
Пример 2. Определите термодинамическую возможность коррозии кадмия с водородной деполяризацией в кислом растворе (pH = 0) с концентрацией ионов Cd2+, равной 0,01 моль/л.
Решение. Для определения возможности процесса коррозии рассчитаем потенциалы окислителя и восстановителя. Потенциал водородного электрода при 298 К описывается уравнением:
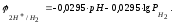
Учитывая, что
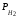 =510-7
атм., рассчитаем потенциал окислителя:
=510-7
атм., рассчитаем потенциал окислителя:
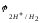 =-0,0590-0,0295lg510-7=0,186
В.
=-0,0590-0,0295lg510-7=0,186
В.
Рассчитаем потенциал восстановителя:
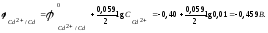 ЭДС
=
ЭДС
=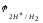 -
-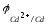 =0,186-(-0,459)=0,645
В.
=0,186-(-0,459)=0,645
В.
ЭДС>0, следовательно, G<0.
Коррозия возможна и выражается следующими уравнениями процессов на анодном и катодном участках:
Анод Cd - 2e = Cd2+
Катод 2H++2e = H2.
Справочные данные
