
Khimia_Akimov_07_Методичко
.pdfФедеральное агентство по образованию
Санкт-Петербургский государственный архитектурно-строительный университет
Кафедра химии
ХИМИЯ
Методические указания к лабораторным работам для студентов всех специальностей
Санкт-Петербург
2007
УДК 541 (075)
Химия: методические указания к лабораторным работам для студентов всех специальностей. – 2-е изд., перераб. и доп./Сост.: Л. И. Акимов, Н. А. Андреева, М. Д. Бальмаков, И. В. Гончарова, В. В. Инчик, А. М. Миронов, А. И. Павлов, А. В. Ухина, О. М. Халина; СПбГАСУ. Под ред. Л. И. Акимова. – СПб., 2007. – 73 с.
Данные методические указания являются необходимой составной частью учебного комплекса по химии и включают описание основных 18 лабораторных работ. Их последовательность соответствует расположению основных разделов курса химии в рабочих программах по химии.
Описанию лабораторных работ предшествуют небольшие теоретические введения, а завершают их контрольные вопросы для самопроверки. В приложение включены справочные таблицы, необходимые при решении задач и выполнении лабораторных работ.
Указания содержат общие правила работы в химической лаборатории, технику безопасности, порядок оформления отчетов по лабораторным работам, а также список рекомендованной литературы.
Табл. 20. Ил. 3. Библиогр.: 10 назв.
ОБЩИЕ ПРАВИЛА РАБОТЫ В ХИМИЧЕСКОЙ ЛАБОРАТОРИИ И ТЕХНИКА БЕЗОПАСНОСТИ.
ОФОРМЛЕНИЕ ЛАБОРАТОРНЫХ РАБОТ
При работе в химической лаборатории необходимо знать и строго соблюдать установленные правила по технике безопасности:
рабочее место содержать в чистоте и порядке; не загромождать его посторонними предметами;
не допускать попадания химических реактивов на кожу и на одежду; реактивы не уносить с рабочих мест, после пользования ставить их на пре-
жние места; если нет указаний по дозировке реактивов для данного опыта, то брать их следует в минимальном количестве;
во всех опытах использовать только дистиллированную воду; не путать пробки от склянок с разными реактивами; сухие реактивы брать только чистым шпателем; неизрасходованные реактивы не высыпать (не выливать) в те склянки, из которых они взяты;
не пользоваться реактивами без этикеток или с сомнительными этикетками; опыты с огнеопасными или легковоспламеняющимися веществами прово-
дить вдали от открытого огня; особую осторожность соблюдать при работе с ядовитыми и вредными ве-
ществами, с концентрированными кислотами и щелочами; работать с ними в вытяжном шкафу, окна которого должны быть открыты не более чем на одну треть; при нагревании или кипячении жидкости (особенно с осадком) во избежание разбрызгивания нагревать верхнюю часть пробирки, при этом держать ее от-
верстием от себя и работающих рядом; при всех несчастных случаях сразу же обращаться к преподавателю или де-
журному лаборанту; после окончания лабораторного занятия вымыть посуду, убрать рабочее ме-
сто, приборы и реактивы сдать лаборанту.
Каждый студент оформляет отчет по выполненной лабораторной работе
всоответствии с рекомендуемой формой:
1)дата выполнения;
2)название лабораторной работы;
3)цель данной работы;
4)название опыта;
5)наблюдения, уравнения реакций, схемы приборов, расчеты, таблицы,
графики;
6)выводы;
7)используемая литература;
8)домашнее задание.
В большинстве лабораторных работ необходимо проводить расчеты. Для числовых значений рассчитываемых величин достаточно 3–4 значащих цифры (число знаков, стоящих после предшествующих им нулей).
1
Отклонение результатов измерений от истинных значений соответствующих величин неизбежно, поэтому в отчете должен быть расчет ошибок. Для определения ошибки необходимо получить не менее трех результатов параллельных измерений. Среднее арифметическое значение этих измерений является наилучшим приближением к истинному значению.
При обработке результатов отдельных измерений следует определять абсолютную и относительную ошибки данной величины. Абсолютная ошибка показывает, на сколько данная величина больше или меньше истинной; отношение этой ошибки к истинной величине, умноженной на 100, дает относительную ошибку (%).
В ряде лабораторных работ результаты измерений представляют в виде графиков. Их строят на миллиметровой бумаге и вклеивают в отчет. Оси координат располагают на расстоянии 2,0–2,5 см от края листа. Около осей указывают буквенные обозначения величин и их единицы измерений. Через равные интервалы на оси наносят деления в соответствующем масштабе, но не менее трех и не более 6–8. Масштаб выбирают так, чтобы кривая полученной зависимости занимала почти всю площадь графика и не была прижата к одной из осей координат или расположена на каком-то небольшом участке. Против делений на осях ставят числовые значения измеряемой величины. Кривую проводят через точки, руководствуясь не только их расположением, но теоретическими соображениями о виде полученной зависимости.
Например, если известно, что исследуемая зависимость линейная, то проводят прямую, хотя экспериментальные точки могут несколько отличаться от нее вследствие погрешности эксперимента.
Работа 1. ВАЖНЕЙШИЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Неорганические соединения классифицируются как по составу, так и по свойствам (функциональным признакам). По составу они подразделяются на двухэлементные (бинарные) и многоэлементные соединения.
По функциональным признакам неорганические соединения подразделяются на классы в зависимости от характерных функций, выполняемых ими в химических реакциях. Выделяют следующие основные классы: оксиды, кислоты, основания (как частный случай гидроксидов, т. е. соединений, включающих группу ОН) и соли.
Оксиды – сложные вещества, состоящие из атомов кислорода и другого элемента. В оксидах кислород проявляет степень окисления –2. Общая формула ок-
сидов: ЭхОу-2.
Оксиды делятся на солеобразующие и несолеобразующие. Последних довольно мало (СО, NО, N2О). Они не образуют солей ни с кислотами, ни со щелочами. Солеобразующие оксиды делятся на основные (их гидраты – основания), кислотные (их гидраты – кислоты), амфотерные (их гидраты проявляют свойства как кислот, так и оснований).
2
По современной номенклатуре названия этого класса строятся следующим образом: к слову «оксид» добавляется название элемента с указанием его степени окисления, если она не постоянная. Например, МgО – оксид магния; СО – оксид углерода (II); CО2 – оксид углерода (IV).
К основным оксидам относятся оксиды щелочных и щелочноземельных металлов, а также многие оксиды других металлов со степенью окисления +1, +2. Они взаимодействуют с водой с образованием оснований:
СаО + Н2О = Са(ОН)2.
Основные оксиды взаимодействуют с кислотными оксидами и кислотами, образуя соли:
СаО + CО2 = СаCО3 СаО + 2НCl = СаCl2 + Н2О
Кислотные оксиды образуют неметаллы (Cl2О, CО2, SО2, N2О5 и др.), а также металлы со степенью окисления +5, +6, +7 (V2О5, CrО3, Mn2О7).
Многие кислотные оксиды непосредственно взаимодействуют с водой, образуя кислоты:
CО2 + Н2О = Н2СО3
SО3 + Н2О = Н2SО4
Со щелочами кислотные оксиды образуют соль и воду:
N2О5 + 2NаОН = 2NаNО3 + Н2О
Амфотерные оксиды образуют металлы, имеющие степень окисления +2, +3, иногда +4. К амфотерным оксидам относятся, например, ВеО, ZnO,Al2O3, Cr2O3, SnO, PbO, MnO2 и др. Они характеризуются реакциями солеобразования и с кислотами, и с основаниями, так как в зависимости от условий проявляют как основные, так и кислотные свойства. Например:
Cr2O3 + 6НCl = 2СrCl3 + 3Н2О
Cr2O3 + 2NаОН = 2NаCrO2 + Н2О
Оксиды можно получить следующими способами:
непосредственно взаимодействием простого вещества с кислородом:
2Mg + О2 = 2MgО 4Р + 5О2 = 2Р2О5 разложением сложных веществ:
Сu(ОН)2 =t° СuО + Н2О СаCО3 =t° СаО + CО2
2Zn(NO3)2 =t° 2ZnO + 4NO2 + О2
Кислоты – вещества, при электролитической диссоциации которых катионами могут быть только положительно заряженные ионы водорода Н+ (точнее,
ионы гидроксония [Н3О]+):
НCl → Н++ Cl−
Основность кислоты определяется числом катионов водорода, которые образуются при диссоциации молекулы кислоты: НCl – одноосновная кислота, H2SO4 – двухосновная, H3PO4 – трехосновная.
3
Кислоты можно разделить на бескислородные (HCl, HBr, HCN, H2S) и кислородсодержащие (HNO3, H2SO4, H3PO4).
Названия кислородсодержащих кислот, в которых степень окисления кислотообразующего элемента (центрального атома) равна номеру группы в периодической системе элементов Д. И. Менделеева (высшая степень окисления), образуется от названия элемента с добавлением суффикса –н (–ов или –ев) и окончания –ая. Например: HNO3 – азот–н–ая кислота, H2SiO3 – кремни–ев–ая кислота. При меньшей степени окисления центрального атома названия кислот образуются с суффиксом – ист. Например, HNO2 – азот–ист–ая кислота, H2SO3 – серн–ист–ая кислота. В зависимости от содержания молекул воды некоторые кислоты могут находиться в метаили ортоформе. Приставка метаозначает минимальное содержание молекул воды, орто- – на одну или несколько молекул больше. Например, HPO3 – метафосфорная кислота, H3PO4 (HPO3 + Н2О) – ортофосфорная кислота.
Вназваниях бескислородных кислот к наименованию элемента добавляют слово «водородная». Например, HCl – хлороводородная, H2S – сероводородная.
Всоответствии с электролитической диссоциацией общие свойства кислот обусловлены ионами водорода Н+. В растворах кислот индикаторы меняют свою окраску: лакмус становится красным, метиловый оранжевый – розовым.
Кислоты реагируют с основаниями и основными оксидами:
H2SO4 + Mg(OH)2 = MgSO4 + 2H2O
2HNO3 + СаО = Са(NO3)2 + H2O
При взаимодействии кислот с солями могут образовываться новые соль и кислота. Реакции этого типа идут при условии образования малорастворимых, летучих или малодиссоциирующих (слабых электролитов) продуктов реакции:
2HCl + СаСО3 = СаCl2 + H2СO3
H2SO4 + ВаCl2 = ВаSO4↓ + 2HCl.
Кислоты получают гидратацией кислотных оксидов:
Р2О5 + H2O = H3РО4 обменной реакцией соли с кислотой:
Са3(РО4)2 +3H2SO4 = 3СаSO4↓+ 2H3РО4
Основания – вещества, при электролитической диссоциации которых
в качестве анионов образуются гидроксид-ионы ОН−: NаОН → Nа+ + ОН−
Кислотность основания определяется числом ионов ОН−, образующихся при диссоциации молекулы гидроксида. NаОН – однокислотное основание, Са(ОН)2 – двухкислотное основание, Fe(ОН)3 – трехкислотное основание.
По растворимости в воде различают:
а) основания, растворимые в воде, – щелочи, например, LiOH, NaOH, KOH, Ca(OH)2, Ba(OH)2 и др.;
б) основания, нерастворимые в воде, например: Cu(OH)2, Fe(OH)3, Cr(OH)3 и др. Названия оснований образуются из слова «гидроксид» и названия соответствующего металла с указанием его степени окисления, если она переменная. На-
4
пример, Ca(OH)2 – гидроксид кальция, Fe(OH)2 – гидроксид железа (II), Fe(OH)3 – гидроксид железа (III).
Водные растворы щелочей изменяют окраску индикаторов. В их присутствии фиолетовый лакмус синеет, бесцветный фенолфталеин становится малиновым.
Щелочи реагируют с кислотными оксидами и кислотами: Ba(OH)2 + СО2 = BaСО3 + H2O
2NaOH + H2SO4 = Na2SO4 + 2H2O
При действии щелочей на растворы солей получаются новая соль и новое основание, причем одно из полученных веществ должно выпадать в осадок:
2КОН + CuSО4 = Cu(ОН)2↓ + К2SО4
Ca(OH)2 + Na2СО3 = CaСО3↓ + 2NaOH
С точки зрения электролитической диссоциации общие свойства щелочей обусловлены гидроксид-ионами ОН−.
Нерастворимые в воде основания, так же, как и щелочи, взаимодействуют с кислотами:
Fe(OH)3 + 3HCl = FeCl3 + 3H2O
и разлагаются при нагревании:
2Fe(OH)3 =t° Fe2О3 + 3H2O
Получить щелочи можно растворением в воде соответствующих металлов и их оксидов:
2Na + 2H2O = 2NaOH + Н2 СаО + H2O = Ca(OH)2
Общий способ получения нерастворимых в воде оснований – действие щелочей на растворимые соли металлов, основания которых нерастворимы:
2NaOH + FeSО4 = Fe(OH)2↓ +Na2SО4
Основания являются частным случаем группы соединений с общим названием «гидроксиды». Гидроксиды – вещества, содержащие группу ОН−, получаются соединением оксидов с водой. В зависимости от того, какой ион (Н+ или ОН−) образуется при электролитической диссоциации, гидроксиды бывают трех видов: основные (основания), кислотные (кислородсодержащие кислоты) и амфотерные (амфолиты).
Амфолиты – это гидроксиды, которые проявляют как основные, так и кислотные свойства. К ним относятся, например, Cr(OH)3, Zn(OH)2, Be(OH)2, Al(OH)3 и др.
Амфотерные гидроксиды способны реагировать как с кислотами, так и со щелочами. С кислотами они реагируют как основания, а со щелочами – как кислоты. Чтобы установить амфотерность гидроксида, следует провести две реакции взаимодействия его с кислотой и со щелочью. Если обе реакции имеют место, то гидроксид амфотерен. Например, гидроксид алюминия Al(OH)3 при взаимодействии со щелочью ведет себя как кислота H3AlO3 (ортоалюминиевая) или HAlO2 (метаалюминиевая):
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + 3NaOH = Na3AlO3 + 3H2O 5
Соли – вещества, при диссоциации которых образуются катионы металлов (или аммония NН4+) и анионы кислотных остатков.
Соли можно рассматривать как продукты полного или частичного замещения атомов водорода в молекуле кислоты атомами металла или гидроксильных групп в молекуле основания кислотными остатками. В зависимости от этого соли делятся на средние, кислые и основные.
Средние соли – продукты полного замещения, они состоят только из катионов металлов или NН4+ и анионов кислотных остатков.
Чтобы правильно написать формулу какой-либо соли, следует учитывать величины зарядов катиона и аниона. Число каждого иона должно быть таким, чтобы алгебраическая сумма зарядов была равна нулю, т. е. соединение было электронейтральным. Например, сульфат хрома (III) состоит из ионов Cr3+ и SO42− имеет состав Cr2(SO4)3, а ортофосфат кальция, состоящий из ионов Са2+ и РО43−, –
Са3(РО4)2.
Названия солей составляют из названия аниона кислоты в именительном падеже и названия катиона в родительном падеже (хлорид натрия, карбонат кальция и т. п.). Если степень окисления катиона металла переменная, ее указывают римскими цифрами в скобках (сульфат железа (II) – FeSО4, сульфат железа (III) –
Fe2(SО4)3.
Кислые соли (гидросоли) – продукты неполного замещения ионов водорода многоосновных кислот катионами металлов. Их образуют только многоосновные кислоты. Признак кислой соли – наличие в ее составе незамещенных Н+. Для верного написания формул кислых солей следует рассчитать заряд аниона с учетом незамещенных ионов Н+ (НСО3−, НРО42−, Н2РО4−). Число ионов подбирается так, чтобы соединение было электронейтральным. Например, формула кислой соли из ионов Cr3+ и НРО42− имеет состав Cr2(НРО4)3.
Названия кислых солей образуются добавлением к названию аниона (кислотного остатка) приставки гидроили дигидро-, если не замещены два иона Н+, что возможно только для трехосновных кислот: Cа(НСО3)2 – гидро-карбонат кальция, Al2(НРО4)3 – гидроортофосфат алюминия, Al(Н2РО4)3 – дигидроортофосфат алюминия.
Основные соли (гидроксосоли) по составу являются продуктами неполного замещения гидроксогрупп основания на кислотные остатки. Их образуют только многокислотные основания. Признак гидроксосоли – наличие в составе незамещенных ОН-. Для верного написания формул основных солей следует рассчитать заряд катиона с учетом незамещенных групп ОН- (СаОН+, AlOH2+, Al(OH)2+). Далее число ионов, как для средних и кислых солей, подбирается так, чтобы соединение было электронейтральным. Например, формула гидроксосоли из ионов
Al(OH)2+ и SО42-: (Al(OH)2)2SО4.
Названия основных солей образуются добавлением к названию катиона металла приставки гидроксоили дигидроксо-, если незамещены две гидроксогруппы, что возможно только для трехкислотных оснований: (CuOH)2СО3 – карбонат гидроксомеди; AlOHSО4 – сульфат гидроксоалюминия, (Al(OH)2)2SО4 – сульфат дигидроксоалюминия.
6
Средние соли получают следующими способами: 1) металл + неметалл:
2Na + Cl2 = 2NaCl
2) металл + кислота:
Мg + 2НCl = МgCl2 + H2
3) металл + соль:
Zn + CuSО4 = Cu + ZnSО4
4) основной оксид + кислотный оксид: СаО + СО2 = СаСО3
5) основание + кислота:
Zn(ОН)2 + 2НNО3 = Zn(NО3)2 + 2Н2О
6) соль + соль:
Pb(NO3)2 + Na2SO4 = PbSO4↓+ 2NaNO3
7) основной оксид + кислота:
CuО + Н2SО4 = CuSО4 + Н2О
8) кислотный оксид + основание:
9) щелочь + соль: Р2О5 + 6NaОН = 2Na3РО4 +3Н2О
Ва(ОН)2 + К2СО3 = ВаСО3↓ + 2КОН 10) кислота + соль:
Н2SО4 + ВаCl2 = ВаSО4↓+2НCl Кислые соли могут быть получены в кислой среде:
1) основание + кислота (избыток):
NaОН + Н3РО4 = NaН2РО4 + Н2О
2NaОН + Н3РО4 = Na2НРО4 + Н2О 2) средняя соль + кислота (избыток):
Na3РО4 + 2Н3РО4 = 3NaН2РО4 2Na3РО4 + Н3РО4 = 3Na2НРО4
Основные соли могут быть получены в щелочной среде: 1) кислота + основание (избыток):
Al(OH)3 + 2НCl = AlOHCl2 + 2Н2О
Al(OH)3 + НCl = Al(OH)2Cl + Н2О
2) средняя соль + щелочь:
AlCl3 + NaОН = AlOHCl2 +NaCl
AlCl3 + 2NaОН = Al(OH)2Cl +2NaCl
Превращение кислых и основных солей в средние происходит следующими способами:
1) кислая соль + щелочь:
NaНSО3 + NaОН = Na2SО3 + Н2О
Са(Н2РО4)2 + 2Са(ОН)2 = Са3(РО4)2 +4Н2О 2) основная соль + кислота:
(CuОН)2SО4 + Н2SО4 = 2CuSО4 + 2Н2О
7
Экспериментальная часть
Цель работы – получение и ознакомление со свойствами оксидов, кислот, оснований, амфотерных гидроксидов и солей.
Оборудование и реактивы: аппарат Киппа, тигельные щипцы, пробирки цилиндрические, стеклянные палочки, спиртовка; карбонат гидроксомеди, медь, цинк, мел, ацетат натрия; растворы серной кислоты, гидроксида натрия – (2М), ортофосфорной кислоты (разбавленная), гидроксида кальция (насыщенная), сульфата меди, хлорида железа (III), хлорида или сульфата цинка, сульфата алюминия, сульфата хрома (III), хлорида натрия, хлорида бария, хлорида кальция, карбоната натрия, сульфата кобальта (II) – (0,5М); индикаторы: лакмус, фенолфталеин, индикаторная бумага.
Опыт 1. Получение оксида меди (II) разложеием гидроксосоли
Всухую пробирку засыпать немного соли карбоната гидроксомеди (II)
инагреть до полного разложения соли. Какие произошли изменения? Составить уравнение реакции. Полученный оксид сохраните для опыта № 9.
Опыт 2. Получение оксида меди (II) окислением меди
Тонкую медную пластинку или проволоку зажать щипцами и внести в пламя горелки. Нагреть до почернения. Составить уравнение реакции.
Опыт 3. Получение оксида кальция разложением карбоната кальция
Зажать щипцами небольшой кусочек мела и прокалить его в течение 5–7 мин в верхней части пламени горелки. На какие вещества разлагается СаСО3 при нагревании? Написать уравнение реакции. Затем, добавив в пробирку с водой несколько капель фенолфталеина, опустить прокаленный кусочек. Записать наблюдения и составить уравнения реакций.
Опыт 4. Получение угольной кислоты
В пробирку с водой добавить несколько капель индикатора (лакмуса), отметить окраску индикатора. Пропустить через воду в течение нескольких минут углекислый газ из аппарата Киппа. Как изменилась окраска индикатора? Составить уравнение реакции.
Опыт 5. Получение уксусной кислоты
Положить в пробирку немного кристаллов ацетата натрия NaСН3СОО и прибавить несколько капель Н2SО4. Определить по запаху, какое вещество образовалось. Написать уравнение реакции.
Опыт 6. Получение гидроксида кальция
Взболтать в пробирке небольшое количество оксида кальция с водой. Отстоявшийся раствор осторожно слить в другую пробирку и прилить к нему не-
8
сколько капель фенолфталеина. Как изменился цвет раствора? Составить уравнение реакции.
Опыт 7. Получение нерастворимых в воде оснований
Налить в две отдельные пробирки растворы солей CuSO4 и FeCl3 и в каждую пробирку добавить раствора гидроксида натрия. Отметить окраску образовавшихся осадков. К полученным осадкам добавить раствор серной кислоты до полного их растворения. Записать уравнения всех химических реакций.
Опыт 8. Получение амфотерных гидроксидов и изучение их свойств
1.В две пробирки внести 1–2 мл раствора любой соли цинка. В каждую добавить по каплям раствор NaОН до образования осадка (пробирки встряхивать для перемешивания). К полученному осадку в одну пробирку прибавить раствор кислоты, в другую – избыток раствора щелочи. Происходит ли растворение осадка
вобеих пробирках? Записать наблюдения и составить уравнения реакций.
2.Повторить опыт 8.1, взяв в качестве реактива раствор соли алюминия.
3.Повторить опыт 8.1, взяв в качестве реактива раствор соли хрома (III). Сделать вывод о характере гидроксидов цинка, алюминия и хрома (III).
Опыт 9. Получение соли при взаимодействии оксида с кислотой
К полученному в опыте 1 оксиду меди добавить немного раствора серной кислоты и подогреть до полного растворения. Как изменилась окраска раствора? Составить уравнение реакции.
Опыт 10. Получение соли при взаимодействии металла с кислотой
В пробирку с раствором серной кислоты внести кусочек цинка. Испытать выделяющийся газ с помощью горящей лучины. Составить уравнение реакции.
Опыт 11. Получение соли взаимодействием двух растворимых солей
В четыре пробирки налить растворы солей: в первую пробирку NaCl иAgNO3, во вторую – Na2SO4 и BaCl2, в третью – CaCl2 и Na2CO3, в четвертую – Pb(NO3)2 и KI. Отметить окраску образовавшихся осадков и записать уравнения реакций.
Опыт 12. Получение кислой соли взаимодействием кислотного оксида и основания
Налить в пробирку раствор Cа(OH)2. Пропустить оксид углерода (IV) из аппарата Киппа. Наблюдать вначале образование осадка средней соли СаСО3, а затем его растворение вследствие образования кислой соли Cа(НСO3)2. Составить уравнение реакции образования средней соли и уравнение взаимодействия средней соли с избытком угольной кислоты. К полученному раствору прилить немного раствора Cа(OH)2. Записать наблюдения. Составить уравнение реакции превращения кислой соли в среднюю.
9

Опыт 13. Получение кислой соли взаимодействием основания и кислот
Внести в пробирку несколько капель насыщенного раствора Cа(OH)2. Прибавлять по каплям разбавленный раствор Н3РО4. Отметить цвет образовавшегося осадка средней соли. Прилить к осадку избыток ортофосфорной кислоты, перемешивая стеклянной палочкой содержимое пробирки. Почему осадок растворяется при прибавлении избытка кислоты. Составить уравнения реакций образования средней соли и превращения ее в кислую соль, учитывая, что образуется дигидроортофосфат кальция.
Опыт 14. Получение гидроксосоли взаимодействием соли и основания
К раствору сульфата кобальта (II) прилить по каплям раствор гидроксида натрия до образования синего осадка. Составить уравнение реакции образования сульфата гидроксокобальта (II).
Осадок разделить на две части. К одной порции добавить раствор щелочи до изменения цвета осадка, к другой – раствор серной кислоты до его растворения. Отметить цвет полученного осадка и образовавшегося раствора. Составить уравнения реакций превращения основной соли в основание и основной соли в среднюю.
Контрольные вопросы
1.На какие основные классы подразделяются неорганические соединения?
2.Что называется оксидом? Назовите типы оксидов и дайте характеристику каждого из них, способы их получения.
3.Что называется кислотой? Что такое основность кислоты? Укажите свойства кислот и способы их получения.
4.Что называется основанием? Что такое кислотность основания? Укажите свойства оснований и способы их получения.
5.Какие соединения называют гидроксидами? Назовите типы гидроксидов.
6.Какие металлы образуют амфотерные гидроксиды? Укажите свойства амфотерных гидроксидов.
7.Что называется солью? Охарактеризуйте средние, кислые (гидро-) соли
иосновные (гидроксо-) соли.
8.Укажите способы получения средних солей.
9.Укажите способы получения гидро- и гидроксосолей, взаимные переходы различных типов солей.
10
Работа 2. ОПРЕДЕЛЕНИЕ ХИМИЧЕСКОГО ЭКВИВАЛЕНТА ЭЛЕМЕНТА И СЛОЖНОГО ВЕЩЕСТВА
Эквивалент простого вещества
Эквивалентом элемента называется такое его количество, которое соединяется с 1 молем атомов водорода или замещает такое же количество атомов водорода в химических реакциях. Например, в соединениях НСl, H2S, NH3 эквивалент хлора, серы, азота соответственно 1 моль, 1/2 моль, 1/3 моль.
Масса одного эквивалента называется его эквивалентной массой. Так, в приведенных примерах эквивалентные массы хлора, серы, азота соответственно
34,45/1 = 34,45 г/моль, 32/2 = 16 г/моль, 14/3 = 4,67 г/моль.
Между валентностью элемента в данном соединении В, мольной массой его атомов А и его эквивалентной массой Э существует простое соотношение:
Эm = А / В.
Например, магний двухвалентен, его эквивалентная масса 24,32/2 = = 12,156 г/моль.
Химический эквивалент элемента может быть вычислен или экспериментально определен по реакции замещения или соединения этого элемента с водородом, кислородом и другим элементом, для которого известен эквивалент.
Всоответствии с законом эквивалентов различные вещества реагируют друг
сдругом в количествах, пропорциональных их эквивалентным массам. Математически этот закон записывается так:
m1 = Эm1 , m2 Эm2
где m1 и m2 – массы веществ, вступивших в реакцию; Эm1 и Эm2 – эквивалентные массы веществ.
Наиболее употребительным методом экспериментального определения эквивалентной массы является метод вытеснения водорода. Этот метод применяется для определения эквивалента тех металлов, которые способны вытеснять водород из разбавленных кислот и щелочей.
Пример. При взаимодействии 0,0936 г железа с серной кислотой выделилось при нормальных условиях 37,3 мл водорода.
Согласно закону Авогадро моль любого газа при нормальных условиях, т. е. при 0 °С и давлении 101 325 Па (760 мм рт. ст.), занимает объем 22 400 мл. Эквивалентная масса водорода, составляющая 1/2 моля, занимает при нормальных условиях объем 11 200 мл (по весу 1,008 г), тогда эквивалентная масса железа
Эm = |
0,0956 ×11200 |
= 27,9 |
г/моль. |
|
37,3 ×1,008 |
||||
|
|
|
||
|
11 |
|
|
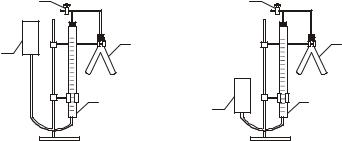
Экспериментальная часть
Целью данной работы является экспериментальное определение эквивалента металла по объему выделившегося водорода в реакции растворения металла в избытке кислоты (опыт 1) и экспериментальное определение эквивалентов сложного вещества – гидроксида натрия – по объему израсходованной кислоты известной концентрации (опыт 2).
Оборудование и реактивы: бюретка на 50 мл – 2 шт., уравнительная склянка – 1 шт., пробирка Освальда – 1 шт., воронка малая – 1 шт., мерная колба на 100 мл – 1 шт.; навески металла цинка, магния по 0,015 – 0,030 г; соляная кислота 5 %-ной концентрации, серная кислота 15 %-ной концентрации, гидроксид натрия, титрованный раствор соляной кислоты, фенолфталеин.
Опыт 1. Определение эквивалента простого вещества
Прибор для определения эквивалентов состоит из следующих частей (рисунок): бюретки на 50 мл, двухколенной пробирки (пробирки Освальда), открытой трубки, служащей в качестве уравнительного сосуда, стеклянного крана.
По указанию преподавателя взять навеску магния или цинка и поместить ее в одну часть пробирки Освальда.
Другую часть пробирки Освальда аккуратно с помощью воронки наполнить на 2/3 объема разбавленной соляной кислотой. Для магния взять 5 %-ный раствор, для цинка – 15 %-ный. Присоединить двухколенную пробирку к пробке на трубке, соединенной с бюреткой. При этом кран открывают, укрепляют бюретку на штатив так, чтобы уровни воды в бюретке и открытой трубке совпадали с нулевым делением (рис. а).
|
а |
4 |
|
|
|
3 |
|
2 |
|
|
|
|
|
1 |
б |
4 |
|
2 |
3 |
1 |
|
Прибор для определения эквивалента металла: 1 – измерительная бюретка; 2 – пробирка Освальда;
3 – уравнительный сосуд; 4 – кран
12
Прежде чем проводить реакцию, необходимо проверить прибор на герметичность. Для этого проверить, плотно ли вставлены пробки, и закрыть кран тройника. Затем уравнительную трубку опустить на 15–20 с (рис. б). Если уровень воды в бюретке снизится и останется без изменения несколько секунд, то прибор герметичен, можно приступить к опыту. Если же уровень воды в бюретке меняется, то необходимо плотно закрыть пробку на бюретке, проверить пробку на пробирке Освальда и повторить проверку.
После проверки на герметичность установить уравнительную трубку так, чтобы уровень воды в бюретке был на нулевом делении.
Аккуратно, стараясь не нарушить герметичность прибора, повернуть пробирку Освальда таким образом, чтобы кислота полностью перелилась в то колено пробирки, где находился металл. Начинается реакция с образованием водорода:
Ме + 2НСl = МеСl2 + Н2
Осторожно закрепить пробирку на штативе и ждать, когда весь металл растворится. Пока идет реакция, зарисовать в тетради установку и записать показания барометра и термометра. После полного растворения металла следует выдержать 5–7 мин, чтобы содержимое сосуда охладилось, затем, не открывая крана, опустить уравнительную трубку до установления на одной высоте уровня воды в бюретке и трубке. При этом внутри прибора создается давление, равное давлению
наружного воздуха. |
|
|
|
|
|
|
|
|
|
Записать данные: |
m = |
|
|
|
|
|
|
|
|
масса металла |
|
г; |
|
|
|
|
|
|
|
объем вытесненного водорода в условиях опыта V = |
мл; |
||||||||
температура опыта |
t = |
°C; |
|
|
|
|
|||
атмосферное давление по барометрур = |
|
|
мм рт. ст.; |
|
|||||
давление насыщенного водяного пара при температуре опыта |
|
||||||||
(находят по табл. 4 приложения) h = |
|
|
мм рт. ст. |
|
|||||
|
|
Вычисления |
|
|
|
|
|||
1. Объем водорода при н.у. вычислить по формуле |
|
||||||||
|
|
V = |
V × ( р - h) ×T0 |
, |
|
||||
|
|
|
|
|
|
||||
|
|
0 |
|
T × р0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
где V0 – объем водорода при нормальных условиях (н. у.), мл; |
|
||||||||
V – объем водорода в условиях опыта, мл; |
|
|
|
|
|||||
Т – абсолютная температура (t + 273); |
T0 = 273 °C; |
|
|||||||
р – атмосферное давление мм рт. ст.; |
р0 = 760 мм рт. ст.; |
|
|||||||
h – давление насыщенного водяного пара, мм рт. ст. |
|
||||||||
2. Эквивалент металла найти по формуле |
|
|
|
|
|||||
|
|
Эm опытн |
= |
11200×m |
, |
|
|||
|
|
|
|
||||||
|
|
|
|
|
V0 |
|
|
|
|
|
|
|
|
13 |
|
|
|
|
|

где m – навеска металла, г;
V0 – объем водорода при н. у., мл.
3. Теоретический эквивалент металла определить из соотношения
|
Эm теор = |
А |
, |
|
|
|
|
|
|||
|
|
В |
|
||
где А – мольная масса металла; |
В – валентность металла. |
||||
4. Ошибку в процентах вычислить по формуле |
|||||
Ошибка = |
Эm теор - Эm опытн |
×100%. |
|||
Эm теор |
|||||
|
|
||||
Эквивалент сложного вещества
Экспериментально эквивалент сложного вещества в зависимости от его химического состава может быть найден различными путями, однако все методы сводятся к определению соотношений, в которых вещества вступают в реакцию друг с другом. Эквивалент многих сложных соединений определяется в растворах.
Концентрацию растворенных веществ для выполнения данной работы удобно выражать двумя способами: через эквивалентную (нормальную) концентрацию и через титр.
Эквивалентная (нормальная) концентрация – это число эквивалентов вещества, растворенного в 1 л раствора:
0,1 н. (децинормальный раствор) = 0,1 Эm ; 0,01 н. (сантинормальный раствор) = 0,01 ,
где Эm – эквивалентная масса, г/моль.
Масса растворенного вещества, содержащегося в 1 мл раствора, называется титром раствора (Т). Раствор, титр которого известен, называется титрованным.
Между нормальной концентрацией Н, эквивалентной массой Эm и титром Т существуют следующие соотношения:
T = |
m |
, г/мл |
|
(1) |
|
|
|
|
|||
V |
|
|
|
||
Эm = |
T ×1000 |
, |
(2) |
||
|
|||||
|
|
|
H |
|
|
где m – масса вещества, г; V – объем раствора, мл.
Пример расчета. 2 г гидроксида натрия растворили в 500 мл дистиллированной воды. Методом титрования установили, что эквивалентная (нормальная) концентрация – 0,1 н. Рассчитать титр и эквивалентную массу гидроксида натрия.
14
T = 5002 = 0,004 г/мл;
Эm = |
0,004 ×1000 |
= 40 |
г/мл. |
|
0,1 |
||||
|
|
|
Для определения эквивалента кислоты используют титрованный раствор щелочи, а для определения эквивалента щелочи – титрованный раствор кислоты. Процесс определения концентрации растворенных веществ при помощи титрованных растворов называется титрованием.
При титровании к раствору неизвестной концентрации (допустим, щелочи) добавляют постепенно, при помешивании, по каплям титрованный раствор (в данном случае кислоты) до тех пор, пока не окончится реакция между кислотой и щелочью – реакция нейтрализации. Окончание реакции определяют индикатором – веществом, меняющим окраску при переходе от кислой или щелочной среды в нейтральную; с помощью индикатора устанавливают момент нейтрализации кислоты щелочью или, наоборот, – щелочи кислотой. Этот момент служит признаком достижения так называемой точки эквивалентности, когда на определенное количество кислоты израсходовано эквивалентное количество щелочи.
Если растворы кислоты и основания имеют одинаковую нормальную концентрацию, то это значит, что они содержат в одинаковых объемах равное число эквивалентных масс, и так как вещества вступают в реакции в эквивалентных количествах, то реакция между такими растворами кислоты и щелочи произойдет полностью при смешении равных объемов.
Если же растворы кислоты и щелочи имеют неодинаковую нормальную концентрацию, то точка эквивалентности наступает тогда, когда
Vщ × Нщ =Vк × Нк , |
(3) |
где Vщ – количество раствора щелочи, мл.;
Нщ – нормальная концентрация раствора щелочи; Vк – количество кислоты, мл;
Нк – нормальная концентрация кислоты.
Опыт 2. Определение эквивалента щелочи методом титрования
Получить у преподавателя мерную колбочку на 100 мл, в нее налить раствор заданной щелочи, мерную колбочку осторожно заполнить дистиллированной водой до метки и перемешать.
Установить точную концентрацию приготовленного раствора щелочи при помощи титрованного раствора НСl. Титрованным раствором НСl заполнить бюретку через воронку до нулевой отметки, отсчитывать уровень по нижнему мениску. Пипеткой на 10 мл отобрать в три конические колбочки раствор щелочи, в каждую коническую колбочку добавить 2–3 капли индикатора (фенолфталеина), который в щелочной среде окрашивается в малиновый цвет.
15

Титрование кислоты щелочью производить следующим образом: под бюреткой на белый лист бумаги ставят коническую колбочку, правой рукой регулируют скорость подачи жидкости из бюретки, а левой размешивают раствор. Капля за каплей щелочь постепенно нейтрализует кислоту. Уравнение реакции имеет вид
NaOH + HCl ® NaCl + Н2О
или в ионном виде
ОН− + Н+ ® Н2О Затем отмерить по бюретке объем кислоты, израсходованной на нейтрали-
зацию титруемой щелочи. Титрование проводить 2–3 раза, каждый раз начиная от нулевой метки, объемы израсходованной кислоты внести в табл. 1.
|
|
|
Таблица 1 |
|
|
|
|
|
|
Номер |
Объем раствора |
Объем титрованного |
Среднее значение |
|
титрования |
щелочи |
раствора кислоты |
титрованного объема |
|
|
Vщ, мл |
Vк, мл |
кислоты |
|
|
|
|
Vк.ср, мл |
|
|
|
|
|
|
1 |
10 |
|
|
|
2 |
10 |
|
|
|
3 |
10 |
|
|
|
Порядок расчетов
1.Рассчитать нормальную концентрацию щелочи по формуле (3).
2.Определить титр щелочи по формуле (1).
3.Рассчитать эквивалентную массу щелочи Эm опытн по формуле (2).
4.Определить щелочь.
5.Рассчитать теоретически эквивалентную массу щелочи Эm теор .
6.Вычислить ошибку, %, по формуле
Ошибка = Эm теор − Эm опытн ×100 %.
Эm теор
7.Записать уравнение реакции нейтрализации щелочи кислотой в молекулярной и ионной форме.
Контрольные вопросы
1. Дать определение химического эквивалента элемента и сложного веще-
ства.
2. Как рассчитывают эквиваленты элемента, кислоты, основания, соли, ок-
сида?
3.Какие существуют практические методы определения эквивалента элемента, эквивалента сложного вещества?
4.Как выражают концентрацию растворов?
5.Какая операция называется титрованием?
16
Работа 3. ХИМИЧЕСКАЯ КИНЕТИКА. КАТАЛИЗ
Целью работы являются изучение влияния концентрации, температуры, катализаторов на скорость химических реакций и измерение каталитической активности различных катализаторов.
Оборудование и реактивы: пробирки, цилиндры (50 мл), стаканы (100 мл), бюретки (25–50 мл), термометры, пробирки Освальда, секундомер; диоксид марганца, диоксид свинца, активированный уголь, бихромат калия; растворы тиосульфата натрия (0,1 н.), серной кислоты (1 моль/л), пероксида водорода (30 %-ный).
Опыт 1. Влияние концентрации реагирующих веществ на скорость реакции
Зависимость скорости реакции от концентрации реагирующих веществ предлагается изучить на примере реакции взаимодействия растворов тиосульфата на-
трия Na2S2O3 и серной кислоты |
|
|
|
|
|
|||
|
|
Na2S2O3 + H2SO4 |
® Na2SO4 |
+ SO2 + H2O + S¯ |
||||
при различных концентрациях тиосульфата натрия. Реакция идет в три стадии: |
||||||||
S |
O |
2− |
+ 2Н+® H S |
O |
3 |
(очень быстро) |
||
2 |
|
3 |
2 |
2 |
|
|
|
|
H2S2O3 ® H2SO3 + S |
|
|
(медленно) |
|||||
H2SO3 |
® SO2 + H2O |
|
|
(быстро) |
||||
_______________________________________________ |
||||||||
S |
O |
2− |
+ 2Н+® S + SO + H O |
|
||||
2 |
|
3 |
|
|
|
2 |
2 |
|
Скорость суммарного процесса определяется второй стадией. В опыте ско-
рость реакции измеряется временем от начала сливания растворов до появления во всех опытах одинаковой плотности суспензии серы.
Впробирку ввести из бюретки 1 мл раствора Na2S2O3 и 4 мл дистиллированной воды. К полученному раствору Na2S2O3 добавить 5 мл раствора H2SO4 и сразу же начать отсчет времени по секундомеру с момента перемешивания раствора до
начала помутнения t1.
Во вторую пробирку налить из бюретки 2 мл раствора Na2S2O3 и 3 мл дистиллированной воды. Добавить 5 мл раствора H2SO4 и отметить время начала помутнения t2.
Втретью, четвертую и пятую пробирки растворы слить в соотношениях, указанных в табл. 1, по аналогии отмечают время начала помутнения t3, t4, t5.
Вданном опыте измеряют не скорость реакции, а промежуток времени между началом реакции и ее видимым результатом. Однако этот промежуток времени обратно пропорционален скорости реакции, и поэтому величину 100/t называют
условной скоростью vусл.
По данным опытов рассчитать концентрацию и условную скорость. Результаты записать в табл. 1.
Построить график зависимости скорости реакции от концентрации Na2S2O3, откладывая на оси абсцисс концентрацию Na2S2O3, а на оси ординат – величину
17
