
Khimia_Akimov_07_Методичко
.pdf
vусл. На основании полученных данных сделать вывод о влиянии концентрации на скорость реакции, графически определить порядок реакции и записать математическое выражение закона действующих масс.
Таблица 1
|
Объем раствора, мл |
|
Концентрация |
Время до |
Vусл = |
100 |
, |
||||
Номер |
|
|
|
|
раствора, моль/л |
начала |
|
t |
|
||
опыта |
Na2S2O3 |
H2O |
H2SO4 |
СNa2S2O3 |
= |
0,1× a |
помутнения |
с–1 |
|
||
|
(а) |
(б) |
|
(в) |
a + б + в |
t, с |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||
1 |
1 |
4 |
|
5 |
|
|
|
|
|
|
|
2 |
2 |
3 |
|
5 |
|
|
|
|
|
|
|
3 |
3 |
2 |
|
5 |
|
|
|
|
|
|
|
4 |
4 |
1 |
|
5 |
|
|
|
|
|
|
|
5 |
5 |
– |
|
5 |
|
|
|
|
|
|
|
Опыт 2. Влияние температуры на скорость реакции
Налить в одну пробирку 5 мл раствора Na2S2O3, а в другую 5 мл раствора H2SO4. Поместить обе пробирки и термометр в стакан с водой комнатной температуры и через 5 мин записать в табл. 2 показания термометра t1. Не вынимая пробирки с тиосульфатом натрия из стакана с водой, добавить в нее содержимое пробирки с H2SO4 и начать отсчет времени по секундомеру с момента перемешивания до появления опалесценции (легкого помутнения). Записать время протекания данной реакции t1.
|
|
|
|
|
|
|
|
|
Таблица 2 |
|
|
|
|
|
|
|
|
|
|
|
|
Номер |
Температу- |
Температу- |
1/T |
Время до на- |
Температур- |
Vусл = |
100 |
, |
|
|
опыта |
ра опыта |
ра опыта |
|
чала помут- |
ный коэф- |
|
|
τ |
|
lg vусл |
|
t, °С |
Т, K |
|
нения t, с |
фициент, g |
с–1 |
|
|
||
1 |
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
В две другие пробирки налить такие же объемы растворов Na2S2O3 и H2SO4. Поместить пробирки и термометр в стакан с водой, нагреть воду до температуры на 10° выше комнатной (t2 = t1 + 10°). Затем проделать опыт так же, как и в первом случае, и отмечают по секундомеру время t2.
Аналогично поступить с третьей парой пробирок, повысив температуру воды еще на 10° (т. е. t3 = t2 + 10°). Отметить по секундомеру время t3. Результаты опытов записать в таблицу по указанной далее форме.
Построить график зависимости логарифма скорости реакции от обратной величины абсолютной температуры. Из графика определяют Еакт:
Еакт = 2,3 × R × tga.
Рассчитать температурный коэффициент реакции g:
g = |
τ1 |
, g |
|
= |
τ2 , g |
|
= |
γ1 + γ2 |
. |
|
|
|
2 |
||||||
1 |
t2 |
2 |
|
t3 |
ср |
|
|
||
|
|
|
|
|
18 |
|
|
|
|
Энергию активации рассчитать по уравнению Аррениуса
Еакт = 2,3 × R × lg g × T1 − T2 .
T2 - T1
Опыт 3. Количественное определение активности различных катализаторов
Прибор для определения активности катализатора состоит из следующих частей (рисунок): бюретки на 50 мл, двухколенной пробирки (пробирки Освальда), открытой трубки, служащей в качестве уравнительного сосуда, стеклянного крана.
В одну часть пробирки Освальда внести один из катализаторов: 1 мл 5 %- ного раствора К2Cr2O7, или 0,05 г угля, или 0,05 г MnO2, или столько же диоксида свинца. В другую часть пробирки аккуратно с помощью воронки налить на 1/2 объема 30 %-ный раствор пероксида водорода. Присоединить двухколенную пробирку к пробке на трубке, соединенной с бюреткой. При этом кран открывают, укрепляют бюретку на штатив так, чтобы уровни воды в бюретке и открытой трубке совпадали с нулевым делением (рис. а)
Прежде чем проводить реакцию, необходимо проверить прибор на герметичность. Для этого проверить, плотно ли вставлены пробки, и закрыть кран тройника. Затем уравнительную трубку опустить на 15–20 с (рис. б). Если уровень воды в бюретке снизится и останется без изменения несколько секунд, то прибор герметичен, можно приступить к опыту. Если же уровень воды в бюретке меняется, то необходимо плотно закрыть пробку на бюретке, проверить пробку на пробирке Освальда и повторить проверку.
|
а |
4 |
|
|
|
3 |
|
2 |
|
|
|
|
|
1 |
|
б |
4 |
|
|
|
|
|
2 |
3 |
|
1 |
|
|
Прибор для определения активности катализатора: 1 – измерительная бюретка; 2 – пробирка Освальда;
3 – уравнительный сосуд; 4 – кран
После проверки на герметичность установить уравнительную трубку так, чтобы уровень воды в бюретке был на нулевом делении.
19

Аккуратно, стараясь не нарушать герметичность прибора, повернуть пробирку Освальда таким образом, чтобы Н2О2 перелить в часть сосуда с катализатором. Отметить по секундомеру время соприкосновения пероксида водорода с катализатором. По истечении 5 мин (всегда необходимо брать один и тот же интервал времени) привести давление внутри прибора к атмосферному. Измерить объем воды, вытесненной кислородом при разложении пероксида водорода, для чего установить на одинаковом уровне воду в бюретке и трубке.
Опыты повторить с другими катализаторами и по объему выделившегося кислорода расположить испытанные катализаторы в порядке возрастания их активности.
Контрольные вопросы
1.Для каких реакций можно предсказать зависимость скорости реакции от концентрации реагирующих веществ?
2.Перечислите в порядке понижения значимости факторы, влияющие на скорость химической реакции.
3.Перечислите в порядке понижения значимости факторы, влияющие на константу скорости химической реакции.
4.Каков физический смысл константы скорости? Как она определяется? Когда численные значения константы скорости и скорости совпадают? Каковы размерности и единицы измерения константы скорости и скорости?
5.Предложите определения понятий порядка и молекулярности химической реакции. Укажите необходимые признаки, характеризующие эти понятия. Особое внимание обратите на то, что молекулярность всегда целое небольшое число, а порядок может быть равным нулю, целому и дробному числам.
6.Как скажутся на значении константы скорости следующие факторы, влияющие на скорость реакции: а) различные начальные концентрации реагирующих веществ; б) изменение температуры; в) введение различных веществ; г) смена растворителя; д) изменение объема системы?
Работа 4. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Целью работы является изучение влияния различных факторов на установление и смещение химического равновесия.
Оборудование и реактивы: пробирки, хлорид аммония; растворы хлорида железа (III), очень разбавленный и концентрированный; роданида аммония, очень разбавленный и концентрированный; хромата калия, серной кислоты, гидроксида калия – (2 н.).
Опыт 1. Влияние концентрации реагирующих веществ на сдвиг химического равновесия
Приготовить смесь равных объемов 0,1 н. FeCl3 и 0,1 н. NH4CNS (2 мл раствора FeCl3 и 2 мл раствора NH4CNS).
20
Реакция взаимодействия хлорида железа (III) и роданида аммония обратима:
FeCl + 3NH CNS ↔ Fe(CNS) |
3 |
+ 3NH Cl |
|
3 |
4 |
4 |
|
Роданид железа интенсивно окрашен в красный цвет, FeCl3 – в желтый, |
|||
а NH4CNS и NH4Cl бесцветны. |
|
|
|
Разлить 4 мл раствора (FeCl3 + 3NH4CNS) в четыре пронумерованные |
|||
пробирки. В пробирку 1 внести несколько капель концентрированного раствора NH4CNS, в пробирку 2 – несколько капель концентрированного раствора FeCl3, в пробирку 3 – немного кристаллической соли NH4Cl. Раствор в пробирке 4 контрольный. Пробирки встряхнуть (соли должны полностью раствориться) и наблюдать за изменением окраски растворов в пробирках 1, 2, 3 по сравнению с окраской контрольной смеси.
Пользуясь законом действия масс, объяснить изменение окраски в первых трех пробирках. Результаты записать в табл. 1 по указанной форме.
|
|
Таблица 1 |
|
|
|
|
|
Добавленный раствор |
Изменение интенсивности |
Направление смещения |
|
|
окраски |
равновесия |
|
|
|
|
|
|
|
|
|
Опыт 2. Влияние температуры
При взаимодействии йода с крахмалом образуется синее вещество сложного состава (соединение включения):
йод+ крахмал ↔ йодокрахмал.
В две пробирки налить по 4–5 мл раствора крахмала и добавить 1 каплю 0,1 н. раствора I2. Нагреть одну из пробирок, а затем снова охладить. Вторую пробирку оставить для сравнения. Что происходит? Экзоили эндотермической является реакция образования йодокрахмала?
Опыт 3. Изучение равновесия гомогенной реакции в растворе, определение константы равновесия Kр
Изучается реакция
2FeCl3 + 2КI ↔ 2FeCl2 + I2 + 2KCl
В пронумерованные колбы на 100 мл с притертыми пробками налить заданное количество растворов КI и FeCl3 известной концентрации. Колбы поместить в термостат на 30 мин при температуре 23 ± 0,2 °С. (По указанию преподавателя часть учащихся проводит эксперимент при 40 °С).
Растворы исходных продуктов представлены в виде табл. 2 по указанной форме.
Точнее, в данной реакции получаются роданидные комплексы железа (III) с числом роданидных групп железа от 1 до 5.
21

|
|
|
|
Таблица 2 |
|
|
|
|
|
|
|
Раствор 0,03 М, мл |
|
Номер колбы |
|
|
|
1 |
2 |
3 |
4 |
|
|
|
|
||||
FeCl3 |
50 |
− |
55 |
− |
|
КI |
− |
50 |
− |
45 |
|
Налить в 8 конических колб по 35–50 мл дистиллированной воды и охладить их. Ледяная вода должна приостановить реакцию и зафиксировать момент, к которому относится изменение концентрации. Слить вместе содержимое колб 1 и 2, а через 10 мин – содержимое колб 3 и 4. Момент сливания растворов зафиксировать. Колбы закрыть пробками и поставить в термостат.
Протекание реакции контролируют по увеличению концентрации йода. Постоянная концентрация I2 свидетельствует о достижении равновесия. Контролируют изменение концентрации йода следующим образом. Через 25 мин после смешения растворов из каждой колбы, не вынимая ее из термостата, отобрать пипеткой 15 мл раствора и слить в охлажденную колбу титрования. За время отбора пробы считать момент сливания раствора из пипетки в колбу титрования. Время отмечают с точностью до 1 мин. Сразу после отбора пробы йод оттитровать 0,015 М раствором гипосульфита натрия с известным титром до бледно-желтой окраски раствора. Затем прибавить несколько капель раствора крахмала и продолжить титрование до исчезновения синего окрашивания раствора. Светло-синяя окраска, появляющаяся через некоторое время, не учитывается. Вторую пробу титруют через 30 мин, третью – через 40 мин и т. д. Отбор проб прекращают тогда, когда на титрование йода в двух последовательно взятых пробах из каждой колбы, расходуется одинаковое количество гипосульфита. Это свидетельствует о достижении равновесного состояния реакции.
Экспериментальные и расчетные данные записывают в табл. 3 по приведенной далее форме.
Константу равновесия изучаемой реакции определить по уравнению
Kp |
= |
[FeCl2 ]2 |
[KCl]2 |
[I2 ] |
|
|
[KI]2[FeCl3 ] |
2 |
|||
|
|
|
|||
Концентрация йода в состоянии равновесия
С |
I2 |
= |
1 |
× C |
г |
× |
V1 |
, |
|
|
|||||||
|
2 |
|
V2 |
|
||||
|
|
|
|
|
||||
где Cг – молярность раствора гипосульфита;
V1 – объем гипосульфита, израсходованного на титрование, мл; V2 – объем взятой пробы, мл.
Концентрация ионов Fe+2 будет равна удвоенной концентрации йода, так как по уравнению реакции образуется одна молекула йода и два иона Fe+2; следова-
тельно, CFe+2 = 2 ×СI2 .
22
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Колба 1 |
|
Колба 2 |
|
Колба 3 |
Колба 4 |
||||||
|
|
|
|
|
Концентрация, моль |
|
|||||||
|
|
|
|
|
|
|
|
|
|
||||
Номер пробы |
Время отбора пробы |
|
Объем гипосульфита, израсходованного на титрование, мл |
Время отбора пробы |
|
Объем гипосульфита, израсходованного на титрование, мл |
Вещество |
Начальная |
|
Равновесная |
Начальная |
Равновесная |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Равновесная концентрация Fe+3 равна разности начальной концентрации ионов Fe+3 и равновесной концентрации Fe+2, так как по уравнению реакции прирост концентрации Fe+2 равен убыли концентрации Fe+3:
C |
Fe |
+3 = СFeCl |
2 |
− C |
Fe |
+2 |
или |
C |
Fe |
+3 |
= СFeCl |
2 |
− 2CI |
2 |
|
|
|
|
|
|
|
|
|
Содержание FeCl3 вычисляют по концентрации израсходованного раствора и степени разбавления его при смешении растворов:
CFeCl2 = C0FeCl2 × a a+ b ,
где C0FeCl2 – начальная концентрация раствора, моль/л;
a и b – количества растворов соответственно, мл. Концентрацию ионов I− вычисляют по уравнениям
C |
− = CKI - a × CI |
2 |
, |
CKI = C0KI × |
b |
, |
|
a + b |
|||||||
I |
|
|
|
|
где C0KI – исходная концентрация йодида калия. Расчет Kp производится отдельно для двух взятых исходных смесей.
Контрольные вопросы
1.Как объяснить, почему изменение температуры в равновесной системе приводит к смещению равновесия?
2.Почему чем больше тепловой эффект реакции, тем сильнее сказывается изменение температуры на равновесии и константе равновесия?
23

3.С повышением температуры равновесие реакции 2SO2 + O2 ↔ 2SO3 смещается влево. Определите знак теплового эффекта.
4.Назовите факторы, позволяющие смещать равновесие, не изменяя константу равновесия.
5.Назовите факторы, смещающие равновесие и изменяющие константу равновесия.
6.Предложите возможные объяснения, почему концентрация вещества
вкристаллическом и жидком состояниях не входит в выражение константы равновесия.
Работа 5. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ. СВОЙСТВА РАСТВОРОВ ЭЛЕКТРОЛИТОВ
Электролитами называются вещества, растворы или расплавы которых проводят электрический ток.
Электролитическая диссоциация – это процесс распада электролита на ионы под действием полярных молекул растворителя. В зависимости от степени электролитической диссоциации (a) различают сильные и слабые электролиты. Степень диссоциации – это отношение числа молекул распавшихся на ионы (n) к общему числу молекул (N):
α = Nn .
Если α > 0,3, т. е. из 100 молекул более 30 молекул распались на ионы, то электролит сильный. К сильным электролитам относятся:
∙ некоторые неорганические кислоты, такие как HCl, HBr, HI, HNO3, H2SO4,
H2SeO4, HClO4, HMnO4;
∙ основания щелочных и некоторых щелочно-земельных металлов; ∙ почти все растворимые соли.
Сильные электролиты диссоциируют в одну стадию, количественной характеристикой процесса является константа диссоциации (отношение произведения равновесных концентраций образовавшихся ионов к равновесной концентрации исходного вещества). Например:
H SO → 2H+ + SO −2 |
KД = |
[H+ ]2 |
[SO |
−2 |
] |
||
[H2SO4 |
4 |
|
|||||
2 |
4 |
4 |
|
] |
|
||
|
|
|
|
|
|||
Слабые электролиты могут диссоциировать ступенчато, причем процесс протекает преимущественно по первой ступени, слабее по второй и совсем незначительно по третьей.
H CO ↔ H+ + HCO − |
KД1 = |
[H+ ][HCO3− ] |
||||
|
[H2CO3] |
|||||
2 |
3 |
3 |
|
|
||
|
|
|
|
|||
HCO3– ↔ H+ + CO3−2 |
KД2 = |
[H+ ][CO3−2 ] |
||||
|
[HCO3− ] |
|
||||
|
|
|
24 |
|
|
|
К слабым электролитам относятся:
1)все органические кислоты;
2)неорганические кислоты кроме упомянутых выше;
3)основания металлов, за исключением щелочных и щелочно-земельных;
4)вода.
Одновременно с процессом диссоциации (распада на ионы) происходит процесс ассоциации (соединения положительно и отрицательно заряженных ионов в молекулы), т. е. электролитическая диссоциация является обратимой реакцией.
На степень электролитической диссоциации существенное влияние оказывают концентрация электролита и температура. Обычно при разбавлении раствора и повышении температуры процесс усиливается.
Экспериментальная часть
Цель работы – экспериментальное изучение процесса электролитической диссоциации и электропроводности сильных и слабых электролитов.
Оборудование и реактивы: лабораторный реостат, угольные электроды; хлорид натрия, мрамор, хлорид аммония; растворы соляной кислоты, гидроксида натрия, уксусной кислоты, гидроксида аммония, хлорида железа (III), метасиликата натрия, хлорида бария.
Опыт 1. Экспериментальноенаблюдение электролитической диссоциации
Химический стакан наполнить на 1/2 его объема дистиллированной водой. Предварительно убедиться, что вилка лампового реостата вынута из розетки. Опустить в стакан угольные электроды. Электроды должны быть частично погружены в воду, но не касаться дна стакана. Включить реостат в сеть. Проводит ли электрический ток дистиллированная вода? Выключить реостат.
В сухой стакан насыпать поваренную соль (NaCl) так, чтобы она покрыла дно стакана и электроды, опущенные в стакан, могли касаться ее. Включить ламповый реостат. Загорается ли лампочка? Проводит ли сухая соль электрический ток?
При выключенном реостате прилить к соли 20–30 мл дистиллированной воды, перемешать. Что наблюдается при включении лампового реостата?
Результаты опыта занести в табл. 1.
Таблица 1
Раствор (вещество) |
Оценка электропроводности |
Заключение |
|
|
|
|
|
|
|
|
|
Опыт 2. Сравнение электропроводности растворов электролитов
Испытать электропроводность растворов, приведенных в таблице, погружая электроды реостата в стакан, заполненный на 1/2 объема испытуемым раствором. После каждого испытания ополаскивать стакан дистиллированной водой.
25
В последнем опыте слить растворы гидроксида аммония и уксусной кислоты. Испытать электропроводность полученного раствора, сравнить с электропроводностью индивидуальных веществ.
Написать уравнение взаимодействия гидроксида аммония и уксусной кислоты в молекулярной и ионно-молекулярной формах.
Заполнить табл. 2:
|
|
|
Таблица 2 |
|
|
|
|
|
|
Электролит |
Характеристика |
Уравнение |
Выражение |
|
|
электролита |
электролитической |
константы |
|
|
|
диссоциации |
диссоциации |
|
HC1 |
|
|
|
|
NaOH |
|
|
|
|
CH3COOH (конц.) |
|
|
|
|
NH4OH (конц.) |
|
|
|
|
NH4OH+CH3COOH |
|
|
|
|
Опыт 3. Влияние добавления соли слабого основания на степень его диссоциации
В две пробирки внести по 2–3 мл раствора гидроксида аммония. В каждую пробирку прибавить одну-две капли раствора фенолфталеина. Одну пробирку оставить в качестве контрольной, а в другую добавить 3–4 микрошпателя сухого хлорида аммония и перемешать раствор стеклянной палочкой. Сравнить интенсивность окраски полученного раствора и контрольного.
Написать уравнение диссоциации гидроксида аммония и выражение константы его диссоциации. Указать, как смещается равновесие в этом растворе при добавлении к нему хлорида аммония и почему окраска раствора бледнеет.
Опыт 4. Сравнение химической активности кислот
Водну пробирку на 1/4 ее объема налейте раствор соляной кислоты
смолярной концентрацией СHCl = 2 моль/л, в другую – столько же уксусной кислоты
стакой же концентрацией.
Выбрать два примерно одинаковых кусочка мрамора. В каждую пробирку бросить по одному кусочку. Отметить интенсивность выделения газа в одной и второй пробирках.
Написать уравнения реакций.
Опыт 5. Направление обменных процессов в растворах электролитов
В три пробирки внести по 1–2 мл следующих растворов: в первую – хлорид железа (III) + гидроксид натрия; во вторую – метасиликат натрия (Na2SiO3) + + соляную кислоту; в третью – разбавленную серную кислоту + хлорид бария. Наблюдать в первой пробирке выпадение осадка гидроксида железа, во второй – кремниевых кислот (условно метакремниевой кислоты), в третьей – сульфата бария. Написать уравнение реакций в молекулярной и ионных формах.
26
Контрольные вопросы
1.Какие вещества называются электролитами?
2.В чем заключается механизм процесса диссоциации?
3.Что такое степень и константа диссоциации электролита и от чего зависят их величины?
4.В чем суть закона разбавления Освальда?
Работа 6. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ. ГИДРОЛИЗ СОЛЕЙ
Химическое обменное взаимодействие ионов растворенной соли с водой, приводящее к образованию слабодиссоциирующих продуктов (молекул слабых кислот или оснований, анионов кислых и катионов основных солей) и сопровождающееся измерением рН среды, называется гидролизом.
Изменение рН при растворении солей в воде является одним из основных признаков, указывающих на протекание в растворе гидролиза. Так, раствор, получающийся при растворении ацетата натрия в воде, имеет щелочную реакцию
(рН > 7):
NаСН3СОО + Н2О ↔ СН3СООН + NaОН или в ионной форме
СН3СОО− + Н2О ↔ СН3СООН + ОН− Характер гидролиза растворенного вещества определяется природой соли.
Различают несколько вариантов взаимодействия соли с водой.
Пример 1. Соль, образованная сильным основанием и слабой кислотой, гидролизуется по аниону, так как анион образует с ионами водорода слабодиссоциирующее соединение:
КСN + Н2О ↔ КОН + НСN
или в ионной форме
СN− + Н2О ↔ ОН− + НСN. Реакция среды щелочная (рН > 7).
Соли, образованный многоосновной слабой кислотой, гидролизуются ступенчато.
Первая ступень:
К2СО3 + Н2О ↔ КНСО3 + КОН
или в ионной форме
СО3−2 + Н2О ↔ НСО3− + ОН−
Вторая ступень:
КНСО3 + Н2О ↔ Н2СО3 + КОН
или в ионной форме
НСО3− + Н2О ↔ Н2СО3 + ОН−
27
Пример 2. Соль, образованная слабым основанием и сильной кислотой, гидролизуется по катиону, так как катион образует с ионами гидроксида слабодиссоциирующее соединение. Поскольку в результате гидролиза образуется сильная кислота, то раствор такой соли имеет рН < 7. Соли слабых многокислотных оснований гидролизуются ступенчато.
Первая ступень:
Fe2(SO4)3 + 2Н2О ↔ 2FeОHSO4 + Н2SO4
Fe+3 + Н2О ↔ (FeОH) +2 + Н+
Вторая ступень:
2FeОHSO4 + 2Н2О ↔ [Fe(ОH)2]2SO4 + Н2SO4 (FeОH) +2 + Н2О ↔ Fe(ОH)2+ + Н+
Третья ступень:
[Fe(ОH)2]2SO4 + 2Н2О ↔ 2Fe(ОH)3 + Н2SO4 Fe(ОH)2+ + Н2О ↔ Fe(ОH)3 + Н+
Пример 3. Соль, образованная слабым основанием и слабой кислотой, гидролизуется и по катиону, и по аниону:
NН4СН3СОО + Н2О ↔ СН3СООН + NН4ОН или в ионной форме
NН4+ + СН3СОО− + Н2О ↔ NН4ОН + СН3СООН.
От силы образующихся слабых кислоты и основания зависит рН среды, обычно составляющее 6–8.
Экспериментальная часть
Целью работы является экспериментальное изучение гидролиза солей в зависимости от их природы, влияния различных факторов на степень гидролиза, определение и измерение водородного показателя при растворении веществ в воде, указывающее на протекание в растворе гидролиза.
Оборудование и реактивы: спиртовка, пробирки на 10 мл – 8 шт., стакан емкостью 50 мл – 1шт., рН-метр; растворы хлорида натрия, карбоната натрия, сульфата алюминия, сульфата калия, хлорида алюминия, ацетата калия – 0,1 моль/л, нитрата висмута – 0,5 моль/л, фенолфталеина, метилового оранжевого; металл – цинк.
Опыт 1. Исследование гидролиза солей и определение рН растворов с помощью индикаторов и рН-метра
Налить в отдельные пробирки по 1–2 мл 0,1 н. растворов солей NаCl, Nа2CO3, Al2(SO4)3, K2SO4. Прибавить в каждую пробирку по 2–3 капли индикатора – фенолфталеина. Появление малиновой окраски свидетельствует о том, что раствор имеет щелочную реакцию. Отсутствие окраски указывает на нейтральность или кислотность раствора.
28
Для определения характера реакции растворов, которые не изменили своей окраски, прибавить к ним 2–3 капли индикатора – метилоранжа. Появление розовой окраски свидетельствует о кислой реакции среды. Растворы, в которых цвет метилоранжа не изменился, следует считать нейтральными.
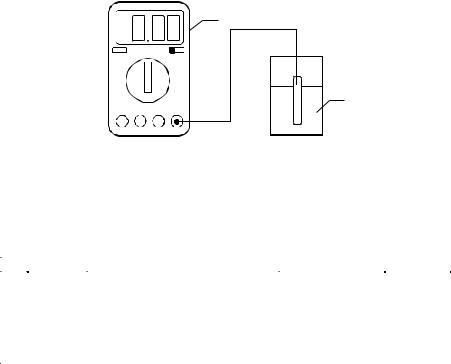
Уточнить значения рН растворов путем измерения с помощью рН-метра (рисунок). Установить переключатель «размах» в положение «рН». Включить рН-метр, при этом на передней панели прибора загорается цифровой индикатор.
Стакан и электроды ополоснуть дистиллированной водой, высушить их фильтровальной бумагой. В сухой стакан поместить исследуемый раствор (20–30 мл), опустить в него электроды и зафиксировать значение рН раствора.
1
Вкл. рН
2  3
3
Схема установки для измерения рН:
1 – рН-метр; 2 – измерительный электрод; 3 – стакан с раствором
Результаты определений внести в табл. 1. Составить молекулярные и ионные уравнения реакций гидролиза тех солей, для которых он имеет место.
|
|
|
|
|
|
|
Таблица 1 |
|
|
|
|
|
|
|
|
|
|
№ |
Формулы |
Реакция растворов |
рН |
Основание или ки- |
Вывод о |
|||
п/п |
солей |
Щелоч- |
Кислая |
Ней- |
рас- |
слота (сильные, |
том, что |
|
|
|
ная |
|
тральная |
твора |
слабые), которыми |
произошел |
|
|
|
|
|
|
|
образована соль |
гидролиз |
|
1 |
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
Опыт 2. Растворение металла в продуктах гидролиза
В пробирку налить 2 мл раствора хлорида алюминия и опустить в раствор кусочек цинка, очищенного от оксидной пленки. Раствор нагреть до кипения. Наблюдать выделение газа. Составить уравнения реакций.
Опыт 3. Влияние температуры на степень гидролиза
В две пробирки налить по 1–2 мл раствора ацетата калия и добавить по 1–2 капли раствора фенолфталеина. Нагреть одну пробирку до кипения и срав-
29
нить интенсивность окраски индикатора в обеих пробирках. Дать немного остыть пробирке, затем охладить ее холодной водой. Объяснить наблюдения. Составить уравнения реакций гидролиза.
Опыт 4. Влияние концентрации соли на степень гидролиза
Налить в пробирку 1–2 мл раствора нитрата висмута. Обратить внимание на прозрачность раствора. Разбавить раствор водой в 2–3 раза и наблюдать выделение мелкокристаллического осадка. Составить уравнение реакции гидролиза, зная, что продуктом гидролиза является нитрат дигидроксовисмута.
Контрольные вопросы
1.Что называется гидролизом?
2.Какие типы гидролиза в зависимости от состава солей известны?
3.Что такое степень и константа гидролиза?
4.Какие факторы и как влияют на степень гидролиза солей?
5.Что называется водородным показателем? Каково значение рН в нейтральной, кислой и щелочной средах?
Работа 7. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Цель работы – закрепление знаний студентов о комплексных соединениях. В процессе работы студенты знакомятся с образованием различных типов комплексных соединений, устойчивостью и разрушением комплексов, приобретают навыки пользования номенклатурой комплексных соединений.
Оборудование и реактивы: спиртовка, держатель для пробирок, стеклянные палочки, пробирки; растворы с концентрацией 0,05 моль/л: K3[Fe(CN)6], FeCl3, K4[Fe(CN)6]; растворы с концентрацией 0,1 моль/л: NH4Fe(SO4)2, BaCl2, ZnSO4, Cr(NO3)3,Al2(SO4)3, Bi(NO3)3, KI, Pb(NO3)2, Na2SO4, NaCH3COO, CuSO4, Na2S, NiSO4;
растворы с концентрацией 1 моль/л: KCNS, NaCl; раствор NaOH (30%-ный), NH4OH (25%-ный); твердые вещества: CuCl2, NaCl.
Каждый студент должен выполнить несколько опытов (4–5) по указанию преподавателя. В тех опытах, где имеется несколько вариантов (а, б, в,…), студент выполняет один из них по указанию преподавателя.
Опыт 1. Различие между двойными и комплексными солями
В три пробирки налить по 1–2 мл раствора двойной соли – железоаммонийных квасцов NH4Fe(SO4)2 и проверить наличие в растворе ионов NH4+, Fe+3, SO4-2.
Для этого в одну из пробирок прилить 0,5–1 мл раствора щелочи (KOH или NaOH) и нагреть. Определить по запаху выделение газообразного аммиака. В другую пробирку прилить несколько капель раствора KCNS или NH4CNS. Появилось ли темно-красное окрашивание раствора, свидетельствующее о наличии
30
иона Fe+3? В третью пробирку приливают 1–2 мл раствора хлорида бария. Наблюдать выпадение белого осадка.
Написать уравнения диссоциации квасцов и уравнения реакций, доказывающих присутствие всех трех ионов в растворе.
Для сравнения в чистую пробирку налить 1–2 мл раствора комплексной соли K3[Fe(CN)6]. Добавить к этому раствору 1–2 капли KCNS или NH4CNS. Появилось ли темно-красное окрашивание раствора? Сделать вывод, присутствует ли ион железа Fe+3 в растворе или нет.
Опыт 2. Образование гидроксокомплексов
В три пробирки налить по 4–5 капель в каждую растворы сульфата цинка, нитрата хрома (III) и сульфата алюминия. В каждую пробирку по каплям добавить раствор щелочи (NaOH, 30%-ный) до выпадения осадка. Затем в эти же пробирки при постоянном помешивании содержимого стеклянной палочкой добавить избыток щелочи до растворения осадка. В результате образуются гидроксокомплексы, содержащие ионы:
[Zn(OH)4]−2; [Cr(OH)6]−3; [Al(OH)6]−3
Написать уравнения получения нерастворимых осадков – гидроксидов металлов, а также уравнения растворения этих осадков в избытке щелочи с образованием комплексного соединения.
Дать название каждому из трех комплексных соединений.
Опыт 3. Образование соединений с комплексным анионом
1. Налить в пробирку 4–5 капель раствора нитрата висмута. Добавить к нему по каплям раствор йодида калия до выпадения осадка. Отметить цвет выпавшего осадка. Затем в эту же пробирку добавить избыток раствора KI до полного растворения осадка и образования комплексного соединения K[BiI4].
Написать в молекулярной и ионно-молекулярной формах уравнения реакций образования осадка и его растворения в избытке реактива.
Дать название получившемуся комплексному соединению.
2. Налить в пробирку 4–5 капель раствора нитрата свинца. Добавить в эту же пробирку по каплям раствор сульфата натрия до выпадения осадка. Отметить цвет осадка. Затем к образовавшемуся осадку добавить по каплям раствор ацетата натрия до полного растворения осадка и образования комплексного соединения
Na2[Pb(CH3COO)4].
Написать в молекулярной и ионно-молекулярной формах уравнения реакций образования осадка и его растворения с образованием комплексного соединения.
Дать название получившемуся комплексному соединению.
Опыт 4. Образование соединений с комплексным катионом
Налить в пробирку 4–5 капель раствора соли соответственно варианту:
а) CuSO4 ; б) ZnSO4; в) NiSO4.
31
К раствору соли осторожно по каплям прилить 25%-ный раствор аммиака до выпадения осадка гидроксида металла. В эту же пробирку добавить избыток раствора аммиака до растворения осадка и образования комплексного соединения:
а) [Cu(NH3)4](OH)2; б) [Zn(NH3)4](OH)2; в) [Ni(NH3)6](OH)2.
Сравнить цвет раствора исходной соли и получившегося комплексного соединения.
Написать уравнения реакций образования осадка гидроксида металла и его растворения в избытке раствора аммиака.
Дать название комплексному соединению. Записать, чему равно координационное число комплексообразователя.
Опыт 5. Прочность комплексных ионов
1.Внести в пробирку небольшое количество сухого безводного хлорида меди бледно-зеленого цвета. Добавить к нему несколько капель воды при перемешивании содержимого стеклянной палочкой до получения раствора голубого цвета,
обусловленного образованием тетрааквакупрумат-иона [Cu(H2O)4]+2.
К получившемуся раствору прилить несколько капель 25%-ного раствора аммиака. Отметить изменение цвета раствора на темно-синий, что связано с пере-
ходом аквакомплекса в тетраамминкупрумат [Cu(NH3)4]+2.
Отметить, какой из двух комплексных ионов является более прочным. Записать уравнения реакций получения этих комплексных соединений и уравнения их диссоциации.
2.Внести в пробирку небольшое количество сухого хлорида меди. Добавить в эту же пробирку ~ 1 мл дистиллированной воды. Перемешать содержимое стеклянной палочкой до образования раствора голубого цвета. Затем в эту же пробирку добавить немного сухого хлорида натрия. Наблюдать изменение окраски на светло-зеленую, что связано с переходом
[Cu(H2O)4]+2 → [CuCl4]−2
Написать уравнение реакции перехода одного комплекса в другой, а также выражения для констант нестойкости одного и другого иона.
Опыт 6. Разрушение комплексов
Налить в пробирку 4–5 капель раствора сульфата никеля. Добавить туда же в избытке раствор аммиака до образования комплексного соединения, содержа-
щего ион [Ni(NH3)6]+2.
К получившемуся раствору прилить по каплям раствор сульфида натрия до выпадения осадка сульфида никеля.
Написать уравнения реакций получения комплексного соединения и его разрушения.
Опыт 7. Обменные реакции простых и комплексных солей
К 4–5 каплям раствора FeCl3 прилить 1–2 капли раствора гексацианоферрата (II) калия K4[Fe(CN)6]. Отметить образование синего осадка Fe4[Fe(CN)6]3.
32
Написать уравнение реакции получения комплексного соединения.
Дать название полученному комплексному соединению. Определить степень окисления атомов железа в исходных веществах и конечном продукте.
Контрольные вопросы
1.Какие соединения называются комплексными?
2.Как построена молекула комплексного соединения?
3.Что такое комплексообразователь, лиганды, координационное число?
4.Что такое внутренняя и внешняя координационные сферы комплексного соединения?
5.Как протекает процесс диссоциации комплексных солей? Привести
пример.
6.Дать определение константы нестойкости комплексного иона. Привести
пример.
Работа 8. ДИСПЕРСНЫЕ СИСТЕМЫ. СВОЙСТВА КОЛЛОИДНЫХ РАСТВОРОВ
Целью работы является углубление знаний по теории коллоидных систем. Студент должен рассмотреть и усвоить некоторые методы получения коллоидов, сущность устойчивости и коагуляции коллоидных растворов, электрические свойства коллоидных систем. Студенту необходимо научиться изображать схемы строения мицелл и определять знак их заряда.
Оборудование и реактивы: электрическая плитка, стеклянные палочки, пробирки; растворы хлорида железа (III), нитрата серебра, карбоната калия, танина, хлорида натрия, силиката натрия, соляной кислоты, гексацианоферрата (III) калия, сульфата калия, желатина, сульфата аммония.
Метод получения коллоидов и их характеристика
Опыт 1. Получение золя гидроксида железа (III) методом гидролиза
В конической колбе емкостью 250 мл нагреть до кипения 100 мл дистиллированной воды. В кипящую воду прибавить по каплям концентрированный раствор хлорида железа (III) и кипятить раствор еще 10 мин.
После прибавления к кипящей воде раствора хлорида железа (III) образуется коллоидный раствор гидроксида железа (III), окрашенный в интенсивный краснокоричневый цвет. (Полученный раствор сохранить для следующих опытов).
Реакция гидролиза хлорида железа (III) идет по схеме
FeCl3 + 3H2O ↔ Fe(OH)3 + 3HCl
Поверхностные молекулы агрегата Fe(OH)3 могут вступать в химическое взаимодействие с HCl:
Fe(OH)3 + HCl ↔ FeOCl + 2H2О 33

Образующиеся в результате этой реакции молекулы FeOCl, подвергаясь электролитической диссоциации, дают ионы FeO+ и Cl−.
Потенциалообразующими являются ионы Fe3+ и FeO+.
Указать к какому методу следует отнести получение этого коллоидного раствора. Изобразить строение мицеллы золя гидроксида железа (III) и ее заряд.
Опыт 2. Получение золя серебра методом восстановления
В коническую колбу налить 50 мл дистиллированной воды, прибавить 5 мл раствора нитрата серебра и несколько капель свежеприготовленного раствора танина в качестве восстановителя. Раствор довести до кипения и прилить по каплям при перемешивании 1 %-ный раствор К2СО3 до получения красновато-желтой окраски. При восстановлении солей серебра танином в растворе образуется коллоидный раствор серебра.
Уравнения реакции
AgNO3 + K2CO3 ↔ AgOK + KNO3 + CO2
6AgOK + C76H52O46 + 3H2О ↔ 6Ag + C76H52O49 + 6KOH
Применяемый в опыте танин представляет собой сложное органическое вещество, эмпирическая формула которого C76H52O46. При окислении он превращается в флобафен C76H52O49. На поверхности агрегатов адсорбируются ионы AgO-, противоионами являются ионы K+.
Изобразите строение мицеллы золя серебра.
Опыт 3. Получение золя хлорида серебра методом ионного обмена
1.В тщательно вымытую и высушенную пробирку налить 2 мл 0,1 н. раствора
NаCl и по каплям добавить 0,1 н. раствор AgNO3 (примерно 1 мл) до помутнения раствора.
2.В тщательно вымытую и высушенную пробирку налить 2 мл 0,1 н. раствора
AgNO3 и по каплям добавить 0,1 н. раствор NаCl до помутнения раствора.
В обоих случаях в результате химической реакции ионного обмена образуется золь хлорида серебра. Уравнение реакции
AgNO3 + NаCl → AgCl↓ + NаNO3
Взависимости от порядка сливания растворов получаются два вида коллоидных частиц.
Впервом случае получается коллоидный раствор хлорида серебра в избытке
NаCl, во втором – в избытке AgNO3.В зависимости от этого мицеллы золя могут быть заряжены либо отрицательно, либо положительно.
Изобразить строение мицелл для обоих случаев, укажите заряд золя.
Опыт 4. Получение золя и геля кремниевой кислоты
1. В пробирку внести 1 мл концентрированной соляной кислоты и прибавить 2–4 капли раствора силиката натрия (Nа2SiO3), содержимое пробирки хорошо перемешать. Образуется золь кремниевой кислоты.
34
Изобразить строение мицеллы. Указать, почему в данном случае не должно происходить образование геля. Полученный золь сохранить для следующих опытов.
2. В пробирку внести 1 мл концентрированного раствора силиката натрия и прибавить к нему 2–4 капли 2 н. раствора соляной кислоты. Перемешать раствор стеклянной палочкой. Наблюдать образование геля.
Объяснить причину образования геля в этом случае. Описать внешние признаки золя и геля кремниевой кислоты.
Устойчивость и коагуляция коллоидных растворов
Опыт 5. Определение порога коагуляции золя гидроокиси железа
Использовать золь Fe(OH)3, полученный в опыте 1, и растворы электролитов
2М КСl, 0,05М К2SO4 и 0,005М К3[Fe(CN)6].
Приготовить три серии пробирок по 8 пробирок в каждой. Налить в четыре пробирки по 5 мл золя, в другие четыре пробирки – соответствующие количества дистиллированной воды и раствора электролита (табл. 1). Смешать попарно, встряхивая раствор электролита и золя. Получить четыре раствора, в которых концентрация золя одинакова (1:1), концентрация электролита в каждой последующей пробирке больше, чем в предыдущей, в два раза. Через 20 мин отметить, в каких пробирках произошла явная коагуляция (помутнение). Пробирки с одним и тем же электролитом разместить в штативах в ряд от более низкой концентрации к более высокой.
Отметить помутнение растворов для каждого электролита в приведенной в качестве образца табл. 1.
Отметить минимальную концентрацию, необходимую для коагуляции, и рассчитать приближенное значение порогов коагуляции при действии трех электролитов (моль/л) по уравнению
= 1000 × С ×V
Спор W ,
где С – концентрация электролита, моль/л;
V – наименьший объем раствора электролита, достаточный для коагуляции, мл; W – объем золя, мл.
|
|
|
|
Таблица 1 |
|
|
|
|
|
|
|
Номер |
Золь, |
Вода, |
Электролит, |
Помутнение через 20 мин |
|
опыта |
мл |
мл |
мл |
|
|
1 |
5 |
4,5 |
0,5 |
|
|
2 |
5 |
4 |
1 |
|
|
3 |
5 |
3 |
2 |
|
|
4 |
5 |
1 |
4 |
|
|
Рассчитать отношение порогов коагуляции. Указать коагулирующие ионы и соблюдение правила Шульце–Гарди.
35
Опыт 6. Определение защитного действия лиофильного коллоида – желатина на золь гидроксида железа
Оттитровать 10 мл золя Fe(OH)3 0,02М раствором (NН4)2SO4 до помутнения раствора. В другой пробирке к 10 мл золя Fe(OH)3 добавить 1 мл 0,5 %-ного раствора желатина. Перемешать и добавить столько раствора (NН4)2SO4, сколько надо для коагуляции золя без желатина. В третью пробирку к 10 мл золя, защищенного 1 мл желатина, добавить небольшое количество сухого порошка сульфата аммония, нарушающего устойчивость раствора желатина.
Описать явления. Указать, произошла ли защита золя при действии лиофильного коллоида.
Объяснить, почему белые хлопья желатина, выпавшие вначале, окрашиваются затем в желтый цвет.
Опыт 7. Определение взаимной коагуляции золей
К золю кремниевой кислоты, полученной в опыте 4, прибавить 3–4 капли золя гидроксида железа. Что при этом наблюдается?
Объяснить выпадение осадка.
Контрольные вопросы
1.Укажите характерные свойства коллоидных систем и их отличие от истинных растворов.
2.Опишите основные методы получения коллоидных систем. Приведите примеры.
3.Дайте определение основным понятиям: золь, гель, суспензия, эмульсия, лиофильная и лиофобная коллоидная система.
4.Как образуется дойной электрический слой на поверхности коллоидной частицы? Каково его строение?
5.Чем определяется агрегативная устойчивость золей? В чем ее отличие от кинетической устойчивости?
6.В чем состоит правило Шульце–Гарди?
7.Что такое коагуляция, пептизация, защита?
8.Дайте характеристику электрокинетическим явлениям.
9.Что такое диализ? Почему при длительном диализе происходит разрушение
золя?
10.Укажите типы эмульсий и методы определения их.
Работа 9. ЖЕСТКОСТЬ ВОДЫ, ЕЕ ОПРЕДЕЛЕНИЕ И УСТРАНЕНИЕ
Жесткость – один из технологических показателей, принятых для характеристики состава и качества природных вод. Жесткость воды обусловливается присутствием в ней катионов кальция и магния.
36
Жесткая вода не пригодна для питания паровых котлов, затрудняет эксплуатацию систем водоснабжения и канализации из-за накипи, источником которой являются соли кальция, магния.
Накипь снижает теплопроводность стенок котлов, что приводит к перерасходу топлива, прогару паровых труб, взрыву котлов и другим эксплуатационным трудностям.
Жесткой называют воду с повышенным содержанием ионов Са2+ и Mg2+. Сумма концентраций ионов Са2+ и Mg2+ является количественной мерой жесткости воды.
Ж = CCa 2+ + CMg2+ .
Измеряют жесткость числом миллимолей эквивалентов ионов жесткости (Са2+ и Mg2+) в 1 кг воды (ммоль/кг).
Плотность воды близка к единице, поэтому жесткость можно выражать в ммоль/дм3 или ммоль/л.
При расчетах следует учитывать, что эквивалентная масса Са2+ и Mg2+:
ЭmCa +2 =1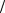 2MCa +2 = 20 г/моль,
2MCa +2 = 20 г/моль,
ЭmMg+2 =1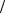 2MMg+2 =12 г/моль,
2MMg+2 =12 г/моль,
где Эm – эквивалентная масса, М – молярная масса иона.
Например, 0,2 г – это масса 0,01 моль или 10 ммоль эквивалентов Са2+. Различают следующие виды жесткости:
1)карбонатную или временную, обусловленную присутствием в воде
гидрокарбонатов кальция и магния – Са(НСО3)2 и Mg(НСО3)2, переходящих при кипячении воды в малорастворимые карбонаты и гидроксиды кальция и магния, выпадающие в осадок;
2)некарбонатную, постоянную, обусловленную присутствием в воде хлоридов, сульфатов, нитратов и силикатов магния и кальция. Соли постоянной жесткости при кипячении не удаляются;
3)общую, представляющую собою сумму карбонатной и некарбонатной жесткости.
Для устранения жесткости воды используют следующие методы: Термический метод основан том, что при нагревании воды до 95–98 °С
гидрокарбонатные ионы НСО3− переходят в карбонатные ионы СО3−2 и последние при взаимодействии с ионами кальция образуют карбонат кальция, выделяющийся из раствора:
Са2+ + СО3−2 → СаСО3↓ Реагентные методы основаны на удалении из воды ионов кальция и магния
в виде нерастворимых осадков. Так, при содово-известковом методе карбонатную жесткость устраняют добавлением в воду гашеной извести. При этом гидрокарбонат кальция переходит в карбонат, а гидрокарбонат магния – в гидроксид магния:
Са(НСО3)2 + Са(ОН)2 → 2СаСО3↓ + 2Н2О
37
