
Metodichka_Akimov_Khimia
.pdf2.Внестивпробиркунебольшоеколичествосухогохлоридамеди. |
4. Что такое внутренняя и внешняя координационные сферы ком- |
||||
Добавить в эту же пробирку ~1 мл дистиллированной воды. Пере- |
плексного соединения? |
||||
мешать содержимое стеклянной палочкой до образования раствора |
5. Как протекает процесс диссоциации комплексных солей? При- |
||||
голубого цвета. Затем в эту же пробирку добавить немного сухого |
вести пример. |
||||
хлорида натрия. Наблюдать изменение окраски на светло-зеленую, |
6. Дать определение константы нестойкости комплексного иона. |
||||
что связано с переходом |
|
|
|
|
Привести пример. |
[Cu(H |
O) |
]+2 |
→ [CuCl |
]−2 |
|
2 |
4 |
|
4 |
|
|
Написать уравнение реакции перехода одного комплекса в другой, а также выражения для констант нестойкости одного и другого иона (табл. 6 приложения).
Опыт 6. Разрушение комплексов
Налить в пробирку 4-5 капель раствора сульфата никеля. Добавить туда же в избытке раствор аммиака до образования комплексного соединения, содержащего ион [Ni(NH3)6]+2.
К получившемуся раствору прилить по каплям раствор сульфида натрия до выпадения осадка сульфида никеля.
Написать уравнения реакций получения комплексного соединения и его разрушения.
Опыт 7. Обменные реакции простых и комплексных солей
К 4–5 каплям раствора FeCl3 прилить 1-2 капли раствора гексацианоферрата (II) калия K4[Fe(CN)6]. Отметить образование синего осадка Fe4[Fe(CN)6]3.
Написать уравнение реакции получения комплексного соединения.
Дать название полученному комплексному соединению. Определить степень окисления атомов железа в исходных веществах и конечном продукте.
Контрольные вопросы
1.Какие соединения называются комплексными?
2.Как построена молекула комплексного соединения?
3.Что такое комплексообразователь, лиганды, координационное число?
58 |
59 |
Работа 9. ДИСПЕРСНЫЕ СИСТЕМЫ. СВОЙСТВА КОЛЛОИДНЫХ РАСТВОРОВ
Цель работы – углубление знаний по теории коллоидных систем. Студент должен рассмотреть и усвоить некоторые методы получения коллоидов, сущность устойчивости и коагуляции коллоидных растворов, электрические свойства коллоидных систем. Студенту необходимо научиться изображать схемы строения мицелл и определять знак их заряда.
Оборудование и реактивы: электрическая плитка, стеклянные палочки, пробирки; растворы хлорида железа (III), нитрата серебра, карбоната калия, танина, хлорида натрия, силиката натрия, соляной кислоты, гексацианоферрата (III) калия, сульфата калия, желатина, сульфата аммония.
Метод получения коллоидов и их характеристика
Опыт 1. Получение золя гидроксида железа (III) методом гидролиза
В конической колбе емкостью 250 мл нагреть до кипения 100 мл дистиллированной воды. В кипящую воду прибавить по каплям концентрированный раствор хлорида железа (III) и кипятить раствор еще 10 мин.
После прибавления к кипящей воде раствора хлорида железа (III) образуется коллоидный раствор гидроксида железа (III), окрашенный в интенсивный красно-коричневый цвет. (Полученный раствор сохранить для следующих опытов.)
Реакция гидролиза хлорида железа (III) идет по схеме
FeCl3 + 3H2O ↔ Fe(OH)3 + 3HCl
Поверхностные молекулы агрегата Fe(OH)3 могут вступать в химическое взаимодействие с HCl:
Fe(OH)3 + HCl ↔ FeOCl + 2H2О
Образующиеся в результате этой реакции молекулы FeOCl, подвергаясь электролитической диссоциации, дают ионы FeO+ и Cl−.
Потенциалообразующими являются ионы Fe3+ и FeO+.
Указать, к какому методу следует отнести получение этого коллоидного раствора. Изобразить строение мицеллы золя гидроксида железа (III) и ее заряд.
Опыт 2. Получение золя серебра методом восстановления
В коническую колбу налить 50 мл дистиллированной воды, прибавить 5 мл раствора нитрата серебра и несколько капель свежеприготовленного раствора танина в качестве восстановителя. Раствор довести до кипения и прилить по каплям при перемешивании 1%-ный раствор К2СО3 до получения красновато-желтой окраски. При восстановлении солей серебра танином в растворе образуется коллоидный раствор серебра.
Уравнения реакции
AgNO3 + K2CO3 ↔AgOK + KNO3 + CO2
6AgOK + C76H52O46 + 3H2О ↔ 6Ag + C76H52O49 + 6KOH
Применяемый в опыте танин представляет собой сложное органическое вещество, эмпирическая формула которого C76H52O46. При окислении он превращается в флобафен C76H52O49. На поверхно-
сти агрегатов адсорбируются ионы AgO−, противоионами являются ионы K+.
Изобразить строение мицеллы золя серебра.
Опыт 3. Получение золя хлорида серебра методом ионного обмена
1.В тщательно вымытую и высушенную пробирку налить 2 мл 0,1 н. раствора NаCl и по каплям добавить 0,1 н. раствор AgNO3 (примерно 1 мл) до помутнения полученного раствора.
2.В тщательно вымытую и высушенную пробирку налить 2 мл 0,1 н. раствора AgNO3 и по каплям добавить 0,1 н. раствор NаCl до помутнения полученного раствора.
В обоих случаях в результате химической реакции ионного обмена образуется золь хлорида серебра по реакции
AgNO3 + NаCl →AgCl↓ + NаNO3
60 |
61 |
Взависимости от порядка сливания растворов получаются два вида коллоидных частиц.
Впервом случае получается коллоидный раствор хлорида серебра в избытке NаCl, во втором – в избыткеAgNO3. В зависимости от этого мицеллы золя могут быть заряжены либо отрицательно, либо положительно.
Изобразить строение мицелл для обоих случаев, указать заряд золя.
Опыт 4. Получение золя и геля кремниевой кислоты
1.В пробирку внести 1 мл концентрированной соляной кислоты
иприбавить 2–4 капли раствора силиката натрия (Nа2SiO3), содержимое пробирки хорошо перемешать. Образуется золь кремниевой кислоты.
Изобразить строение мицеллы. Указать, почему в данном случае не должно происходить образование геля. Полученный золь сохранить для следующих опытов.
2.Впробиркувнести1млконцентрированногорастворасиликата натрия и прибавить к нему 2–4 капли 2 н. раствора соляной кислоты. Перемешать раствор стеклянной палочкой. Наблюдать образование геля.
Объяснить причину образования геля в этом случае. Описать внешние признаки золя и геля кремниевой кислоты.
Устойчивость и коагуляция коллоидных растворов
Опыт 5. Определение порога коагуляции золя гидроокиси железа
Использовать золь Fe(OH)3, полученный в опыте 1, и растворы электролитов 2 М KСl, 0,05 М K2SO4 и 0,005 М K3[Fe(CN)6].
Приготовить три серии пробирок по 8 пробирок в каждой. Налить в четыре пробирки по 5 мл золя, в другие четыре пробирки – соответствующие количества дистиллированной воды и раствора электролита (таблица). Смешать попарно, встряхивая раствор электролита и золя. Получить четыре раствора, в которых концентрация золя одинакова (1 : 1), концентрация электролита в каждой по-
следующей пробирке больше, чем в предыдущей, в два раза. Через 20 мин отметить, в каких пробирках произошла явная коагуляция (помутнение). Пробирки с одним и тем же электролитом разместить в штативах в ряд от более низкой концентрации к более высокой.
Отметить помутнение растворов для каждого электролита в приведенной в качестве образца таблице.
Отметить минимальную концентрацию, необходимую для коагуляции, и рассчитать приближенное значение порогов коагуляции при действии трех электролитов (моль/л) по уравнению
С = 1000 С V ,
пор W
где С – концентрация электролита, моль/л; V – наименьший объем раствора электролита, достаточный для коагуляции, мл; W – объем золя, мл.
Номер |
Золь, |
Вода, |
Электролит, |
Помутнение |
опыта |
мл |
мл |
мл |
через 20 мин |
1 |
5 |
4,5 |
0,5 |
|
|
|
|
|
|
2 |
5 |
4 |
1 |
|
|
|
|
|
|
3 |
5 |
3 |
2 |
|
|
|
|
|
|
4 |
5 |
1 |
4 |
|
|
|
|
|
|
Рассчитать отношение порогов коагуляции. Указать коагулирующие ионы и соблюдение правила Шульце – Гарди.
Опыт 6. Определение защитного действия лиофильного коллоида – желатина – на золь гидроксида железа
Оттитровать 10 мл золя Fe(OH)3 0,02 М раствором (NН4)2SO4 до помутнения раствора. В другой пробирке к 10 мл золя Fe(OH)3 добавить 1 мл 0,5%-ного раствора желатина. Перемешать и добавить столько раствора (NН4)2SO4, сколько надо для коагуляции золя без желатина. В третью пробирку к 10 мл золя, защищенного 1 мл желатина, добавить небольшое количество сухого порошка сульфата аммония, нарушающего устойчивость раствора желатина.
Описать явления. Указать, произошла ли защита золя при действии лиофильного коллоида.
62 |
63 |
Объяснить, почему белые хлопья желатина, выпавшие вначале, окрашиваются затем в желтый цвет.
Опыт 7. Определение взаимной коагуляции золей
К золю кремниевой кислоты, полученной в опыте 4, прибавить 3-4 капли золя гидроксида железа. Что при этом наблюдается?
Объяснить выпадение осадка.
Контрольные вопросы
1.Укажите характерные свойства коллоидных систем и их отличие от истинных растворов.
2.Опишите основные методы получения коллоидных систем. Приведите примеры.
3.Дайте определение основным понятиям: золь, гель, суспензия, эмульсия, лиофильная и лиофобная коллоидная система.
4.Как образуется дdойной электрический слой на поверхности коллоидной частицы? Каково его строение?
5.Чем определяется агрегативная устойчивость золей? В чем ее отличие от кинетической устойчивости?
6.В чем состоит правило Шульце – Гарди?
7.Что такое коагуляция, пептизация, защита?
8.Дайте характеристику электрокинетическим явлениям.
9.Что такое диализ? Почему при длительном диализе происходит разрушение золя?
10.Укажите типы эмульсий и методы определения их.
Работа 10. ЖЕСТКОСТЬ ВОДЫ, ЕЕ ОПРЕДЕЛЕНИЕ И УСТРАНЕНИЕ
Жесткость – один из технологических показателей, принятых для характеристики состава и качества природных вод. Жесткость воды обусловливается присутствием в ней катионов кальция и магния.
Жесткая вода не пригодна для питания паровых котлов, затрудняет эксплуатацию систем водоснабжения и канализации из-за накипи, источником которой являются соли кальция, магния.
Накипь снижает теплопроводность стенок котлов, что приводит к перерасходу топлива, прогару паровых труб, взрыву котлов и другим эксплуатационным трудностям.
Жесткой называют воду с повышенным содержанием ионов Са2+ и Mg2+. Сумма концентраций ионов Са2+ и Mg2+ является количественной мерой жесткости воды:
Ж =CCa2+ +CMg2+
Измеряют жесткость числом миллимолей эквивалентов ионов жесткости (Са2+ и Mg2+) в 1 кг воды (ммоль/кг).
Плотность воды близка к единице, поэтому жесткость можно выражать в ммоль/дм3 или ммоль/л.
При расчетах следует учитывать, что эквивалентная масса Са2+
и Mg2+:
mэ Ca+2 =1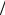 2 MCa+2 = 20 г/моль,
2 MCa+2 = 20 г/моль,
mэ Mg+2 =1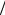 2 MMg+2 =12 г/моль,
2 MMg+2 =12 г/моль,
где mэ – эквивалентная масса; М – молярная масса иона.
Например, 0,2 г – это масса 0,01 моль или 10 ммоль эквивалентов Са2+.
Различают следующие виды жесткости:
1)карбонатную, или временную, обусловленную присутствием
вводе гидрокарбонатов кальция и магния – Са(НСО3)2 и Mg(НСО3)2,
64 |
65 |
переходящих при кипячении воды в малорастворимые карбонаты и гидроксиды кальция и магния, выпадающие в осадок;
2) некарбонатную, постоянную, обусловленную присутствием в воде хлоридов, сульфатов, нитратов и силикатов магния и кальция. Соли постоянной жесткости при кипячении не удаляются;
3) общую, представляющую собою сумму карбонатной и некарбонатной жесткости.
Для устранения жесткости воды используют термический и реагентный методы.
Термический метод основан на том, что при нагревании воды до 95–98 °С гидрокарбонатные ионы НСО3− переходят в карбонатные ионы СО3−2 и последние при взаимодействии с ионами кальция образуют карбонат кальция, выделяющийся из раствора:
Са2+ + СО3−2 → СаСО3↓
Реагентные методы основаны на удалении из воды ионов кальция и магния в виде нерастворимых осадков. Так, при содовоизвестковомметодекарбонатнуюжесткостьустраняютдобавлением
вводу гашеной извести. При этом гидрокарбонат кальция переходит
вкарбонат, а гидрокарбонат магния – в гидроксид магния:
Са(НСО3)2 + Са(ОН)2 → 2СаСО3↓ + 2Н2О
Mg(НСО3)2 + Са(ОН)2 → Mg(ОН)2↓ + СаСО3↓ + Н2О + СО2
Некарбонатную жесткость устраняют содой, которая вызывает образование осадка; например,
СаCl2 + Na2СО3 → СаСО3↓ + 2NaCl
Более глубокое удаление достигается при обработке воды солями фосфорных кислот Na3РО4:
3Са2+ + 2РО4−3 → Са3(РО4)2↓ При ионообменном методе для удаления катионов магния и каль-
ция используют катиониты – природные алюмосиликаты либо синтетические – ионообменные смолы на основе полистирола или фенолформальдегида. Они содержат функциональные группы, способные обмениваться на катионы Са и Mg:
Са(НСО3)2 + Na2R → СаR + 2NaНСО3
MgSО4 + Na2R → MgR + Na2SО4
Здесь R – радикал сложной молекулы катионита.
Экспериментальная часть
Цель работы – экспериментальное определение карбонатной, некарбонатной, общей жесткости и ознакомление с методами устранения жесткости.
Оборудование и реактивы: колбы конические, пипетки, бюретки, капельницы для индикатора, фильтры с катионитом, воронки стеклянные, палочки стеклянные, мерные цилиндры; модельная жесткая вода; растворы трилона Б, соляной кислоты, аммиачный буферный, метилоранжа, эриохрома черного.
Опыт 1. Определение карбонатной жесткости
Для анализа в коническую колбу отбирают 20 мл исследуемой воды, добавляют 1-2 капли метилоранжа и титруют 0,01 н. НСl до появления оранжевого оттенка. Титрование определяет концентрацию анионов HCO3−, а следовательно, жесткость воды, обусловливаемую присутствием гидрокарбонатов.
Расчет карбонатной жесткости, ммоль/л, проводят по формуле
Жк = |
Сн. Vк 1000 , |
(1) |
|
Vпробы |
|
где Сн. – концентрация соляной кислоты, моль/л; Vк – объем соляной кислоты, затраченной на титрование, мл; Vпробы – объем взятой на анализ пробы воды, мл.
Опыт 2. Определение общей жесткости комплексометрическим методом
Способность аминополикарбоновых кислот, в частности комплексона III (трилона Б), образовывать комплексные соединения с ионами щелочно-земельных металлов и некоторых других двух-, трехвалентных металлов позволяет применять эти кислоты для определения жесткости воды.
Для определения общей жесткости используют титрованные растворы комплексона III (трилона Б). Полное связывание ионов Са2+ и Mg2+ в комплексонаты сопровождается изменением окраски индикатора.
66 |
67 |

Ход определения. В коническую колбу отбирают 20 мл исследуемой воды, 10 мл аммиачного буферного раствора, добавляют несколько капель индикатора (эриохрома черного) и медленно титруют 0,01 н. раствором трилона Б до перехода вишневой окраски в синюю.
Расчет общей жесткости, ммоль/л, проводят по формуле
Ж = |
Стр Vтр 1000 |
, |
(2) |
|
|||
|
Vпробы |
|
|
где Стр – концентрация раствора трилона Б, моль/л; Vтр – объем рас-
твора трилона Б, пошедшего на титрование, мл; Vпробы – объем воды, взятой на титрование, мл.
Расчет некарбонатной жесткости, ммоль/л, проводят по формуле
|
|
Жн = Ж −Жк. |
|
(3) |
||
Результаты определений представляют в виде табл. 1. |
||||||
|
|
|
|
|
|
Таблица 1 |
|
|
|
|
|
|
|
Определяемый |
Результаты |
|
Формула |
|
Результаты |
Соли, |
титрования |
|
|
анализа, |
обусловливающие |
||
параметр |
|
расчета |
|
|||
V, мл |
|
|
ммоль/л |
жесткость |
||
|
|
|
|
|||
Карбонатная |
|
|
|
|
|
|
жесткость Жк |
|
|
|
|
|
|
Общая |
|
|
|
|
|
|
жесткость Ж |
|
|
|
|
|
|
Некарбонатная |
|
|
|
|
|
|
жесткость Жн |
|
|
|
|
|
|
Опыт 3. Умягчение воды методом катионирования
Через фильтр (колонку), заполненную катионитом, пропускают 150–200 мл жесткой воды (выдается преподавателем). Скорость фильтрования регулируется зажимом и не должна превышать 10–15капельвминуту.Умягченнуюводусобираютвстаканианали- зируют, определяя общую жесткость. Полученные результаты сравнивают с показателями исходной (неумягченной) воды. Результаты определения записывают в табл. 2.
|
|
|
|
|
|
Таблица 2 |
|
|
|
|
|
||
Объем раство- |
Концентрация |
Объем воды, |
Общая жест- |
Эффектив- |
||
ра трилона Б |
(нормаль- |
взятой на |
кость воды |
ность работы |
||
V |
, мл |
ность) |
анализ V , |
после умягчения, |
фильтра, |
|
1 |
|
трилона Б СН1 |
мл |
2 |
ммоль/л |
Э, % |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Эффективность, %, определяют по формуле
Э= Ждо умяг −Жпосле умяг 100.
Ждо умяг
Контрольные вопросы
1.Дать понятие жесткости воды. Указать единицы измерения.
2.Почему жесткую воду нельзя применять для генерации пара на тепловых и атомных электростанциях?
3.Какой метод используется при определении карбонатной жесткости воды? Дать его определение.
4.В чем принцип определения общей жесткости комплексометрическим методом?
5.Перечислить методы устранения жесткости, написать характерные реакции.
6.Рассчитать жесткость воды, содержащей в 1 л: а) 10 ммоль СаCl2; б) 0,01 моль Са(НСО3)2.
68 |
69 |
Работа 11. ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Цель работы – изучение окислительно-восстановительных свойств веществ, приобретение опыта составления окислительновосстановительных реакций.
Реактивы: растворы с концентрацией 0,1 н.: BaCl2, SnCl2, KI, I2, H2O2, K2Cr2O7; растворы с концентрацией 2 н.: KOH, HNO3, HCl, H2SO4; раствор KMnO4 c концентрацией 0,01 н., хлорная вода; концентрированная серная кислота (96%-ная), концентрированная азотная кислота (60%-ная); сухие вещества: цинк в гранулах, сульфит калия или натрия.
Опыт 1. Сравнение обменных и окислительновосстановительных реакций
Налитьвпробирку1–2млрастворахлоридабария.Добавитьтудаже 0,5–1млрастворасернойкислоты.Отметитьцветвыпавшегоосадка.
В другую пробирку налить 1–2 мл раствора йодида калия и такой же объем хлорной воды (вода, содержащая растворенный хлор). Как изменилась окраска раствора?
Написать уравнения реакций. Определить, какая из них является окислительно-восстановительной, а какая – нет.
Опыт 2. Влияние среды на восстановительную способность иона Mn+7
Втри пробирки налить по 1–2 мл раствора KМnO4.
Водну из них добавить 1–2 мл раствора серной кислоты и немного (2–3 микрошпателя) сухого K2SO3. Что происходит с цветом раствора? Следует учесть, что в этой реакции сульфит калия превра-
щается в сульфат калия, а марганец восстанавливается до степени окисления Mn+2 и остается в растворе.
Во вторую пробирку добавить немного сухого сульфита калия (2–3 микрошпателя). Какого цвета осадок образуется? В этой реакции сульфит калия окисляется до сульфата, а марганец образует осадок оксида MnO2.
В третью пробирку добавить 1–2 мл раствора KОН и немного сухого сульфита калия (2–3 микрошпателя). Отмечают образование
грязно-зеленого раствора, связанного с изменением степени окисле-
ния марганца Mn+7 → Mn+6 (K2MnO4).
Написать уравнения окислительно-восстановительных реакций для каждого случая.
Опыт 3. Влияние концентрации кислоты на ее окислительные свойства
1.Взять две пробирки. В одну из них налить 1–2 мл концентрированнойсернойкислоты, вдругую–1–2млразбавленной сернойкислоты. В каждую пробирку бросить по грануле цинка. Если реакция не идет, слегка подогреть растворы на пламени спиртовки.
Отметить слабое газовыделение и легкое помутнение в первой пробирке, связанное с восстановлением S+6 до свободной серы и сероводорода. Во второй пробирке отметить сильное газовыделение, обусловленное выделением водорода.
Написать уравнения окислительно-восстановительных реакций. Указать окислитель и восстановитель в каждой реакции. Учесть, что
впервой реакции образуются три продукта реакции, одним из которых будет сероводород.
2.В две пробирки налить по 1–2 мл концентрированной и разбавленной азотной кислоты (2 н.). В каждую пробирку бросить по грануле цинка. Если реакция не идет, слегка подогреть растворы на пламени спиртовки. Какого цвета газ выделяется в каждой из пробирок? Выделение бурого газа – результат образования оксида азота NO2, выделение бесцветного газа – образования азота N2.
Написать уравнения окислительно-восстановительных реакций. Указать окислитель и восстановитель.
Опыт 4. Определение окислительных свойств дихромата калия
Налить в пробирку 1–2 мл раствора дихромата калия K2Cr2O7. Затем туда же добавить 1–2 мл раствора серной кислоты и немного
70 |
71 |
сухого сульфита калия (2–3 микрошпателя). Что происходит с окраской раствора? Изменение окраски раствора объясняется изменением степени окисления иона хрома с Cr+6 до Cr+3.
Написать уравнение реакции. Указать окислитель и восстановитель.
Опыт 5. Определение восстановительных свойств ионов металлов в низшей степени окисления
В пробирку налить 1–2 мл раствора KMnO4. Затем добавить туда же 1–2 мл раствора соляной кислоты и 2–3 мл раствора хлорида олова SnCl2. Что происходит с окраской раствора?
Написать уравнение реакции, учитывая, что образуется четыре продукта реакции, причем олово окисляется до степени окисления (+4), а марганец восстанавливается до Mn+2.
Опыт 6. Изучение окислительно-восстановительной двойственности
Взять две пробирки. В одну налить 1–2 мл раствора йодида на- трия,вовторую–растворKMnO4.Затемвкаждуюпробиркуприлить раствор пероксида водорода (Н2О2) до изменения окраски раствора. В каком случае наблюдается выделение газа? Следует учесть, что одним из продуктов в первой реакции будет I2, а во второй – MnO2.
Написать уравнения реакций. Указать, в каком случае пероксид водорода будет окислителем, а в каком – восстановителем.
Контрольные вопросы
1.Что называется степенью окисления элемента?
2.Что происходит с электронами при окислении, восстановлении элемента?
3.Дать определение процессу диспропорционирования.
4.Как относятся понятия «степень окисления» и «валентность» элемента?
Работа 12. ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Цель работы – изучение химических свойств металлов. Оборудованиеиреактивы:пробирки,штатив-подставка,стеклян-
ные палочки; растворы гидроксида натрия, соляной кислоты, азотной кислоты, серной кислоты (разбавленные и концентрированные); металлы: железо, алюминий, свинец, медь, цинк, магний; растворы солей этих металлов.
Опыт 1. Химическая активность металлов (вытеснение одних металлов другими из растворов их солей)
С учетом активности металлов расположить их в определенной последовательности (ряд напряжений металлов).
Более активный металл (расположенный левее в ряду напряжений) будет вытеснять менее активный из раствора его соли.
В растворы солей цинка, железа, свинца и меди опустить металлы: цинк, железо, свинец, медь (каждый металл в раствор соли, кроме своей).
Где происходит вытеснение металлов?
Соответствуют ли полученные результаты положению металлов в ряду напряжений?
Написать уравнения химических реакций.
Опыт 2. Реакции взаимодействия металлов с водой
С водой взаимодействуют металлы, стоящие в ряду активности до железа, с образованием соответствующего гидроксида металла и водорода. Однако эта реакция протекает активно с металлами, стоящими до магния. Остальные металлы, как правило, покрыты оксидными пленками.
Кусочки магния или алюминия опустить в пробирку с водой. Записать наблюдения.
72 |
73 |

Положить в пробирку немного алюминия и взболтать с 3–5 мл воды. Объяснить, почему реакция не идет. Кипятить алюминиевые опилки, добавив в пробирку 2–3 мл разбавленного раствора щелочи. Слить жидкость, несколько раз промыть опилки водой для удаления щелочи и оставить опилки в воде. Через некоторое время происходит выделение пузырьков газа. Составить уравнение реакции взаимодействия алюминия с водой. Указать условие возможности протекания этой реакции.
Опыт 3. Взаимодействие металлов с растворами щелочей
Амфотерные металлы (Zn,Al, Pb, Sn, …) взаимодействуют с растворами щелочей с образованием комплексных соединений и выделением водорода.
В пробирки поместить немного Al, Zn, Pb и осторожно прилить разбавленный раствор гидроксида натрия. Что наблюдается? Составить уравнения реакций.
Опыт 4. Получение и свойства гидроксидов амфотерных металлов
1.К раствору соли алюминия в пробирке прилить по каплям раствор гидроксида натрия до образования осадка. Что он собой представляет, каков его цвет? Составить уравнение реакции в молекулярной и ионной формах.
2.Разделить осадок, полученный в опыте, на две пробирки.
Водну пробирку прибавить разбавленный раствор соляной кислоты, в другую – раствор щелочи. Что наблюдается? Сделать вывод о химическом характере гидроксида. Составить уравнение реакции в молекулярной и ионной формах, имея в виду, что алюминат образуется в форме гидроксокомплекса.
Опыт 5. Взаимодействие металлов с соляной кислотой
Разбавленная соляная кислота взаимодействует с металлами, расположенными до водорода в ряду напряжений, с выделением водорода.
Концентрированная кислота растворяет металлы, стоящие и после водорода (например, медь).
В пробирки налить по 2–3 мл 2 н. соляной кислоты. Опустить
вкаждую пробирку указанные преподавателем кусочки металлов. Отметить наблюдения. Составить уравнения химических реак-
ций.
Опыт 6. Взаимодействие металлов с серной кислотой
Разбавленная серная кислота взаимодействует с металлами, расположенными до водорода в ряду напряжений, с выделением водорода. Концентрированная кислота взаимодействует с металлами, стоящими в ряду напряжений и после водорода (за исключением серебра, золота, платины). В зависимости от активности металла могут выделяться либо оксид серы (IV), либо сера, либо сероводород.
Повторить предыдущий опыт, заменив соляную кислоту серной кислотой. Сначала опыты проводить с разбавленной (2 н.) Н2SО4, затем с концентрированной*. Написать уравнения соответствующих реакций.
Опыт 7. Взаимодействие металлов с азотной кислотой
Азотная кислота взаимодействует почти со всеми металлами (за исключением золота, платины, родия, иридия).
Взависимости от природы металла и концентрации кислоты продуктами реакции могут быть NН4NО3, азот, оксиды азота (N2О, NО, NО2). Чем более активный металл взаимодействует с кислотой, тем более глубоко протекает восстановление азота.
Вдве пробирки положить по кусочку меди. В одну из них налить 2–3 мл разбавленной азотной кислоты, в другую – 2–3 мл концентрированной кислоты. Какой газ выделяется? Написать уравнения реакций.
Вдве пробирки положить по кусочку металла (цинк или магний), стоящих в ряду напряжений до водорода, прилить в одну из них 2–3 мл разбавленной азотной кислоты, в другую 2–3 мл концентрированной азотной кислоты. Сделать наблюдения. Написать уравнения реакций.
* Опыты с концентрированными кислотами проводить в вытяжном шкафу.
74 |
75 |
Контрольные вопросы
1.Перечислить важнейшие физические и химические свойства металлов.
2.Какие металлы относятся к группе щелочных, щелочноземельных металлов?
3.Какие металлы относятся к группе «благородных» металлов?
4.Какие металлы называются черными и цветными металлами?
5.Какие металлы взаимодействуют со щелочами?
6.Какие металлы пассивируются в концентрированных кисло-
тах?
7.Как изменяются металлические свойства элементов в группах
ипериодах в периодической системе элементов?
8.Алюминиевая пластинка опущена в раствор хлорида никеля
ихлорида меди. Какой металл осаждается? Написать уравнение реакции.
Работа 13. ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ МЕТАЛЛОВ. ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
Целью работы является изучение физико-химических основ работы гальванического элемента.
Оборудование и реактивы: милливольтметр, U-образный электролитический мостик, химические стаканы, пробирки; пластинки меди, цинка, железа, свинца; растворы: хлорида калия (насыщ.), сульфата меди (II) (1 М), сульфата цинка (1 М, 0,1 М, 0,01 М), сульфата железа (II), хлорида олова (II), хлорида кадмия (1 М), нитрата серебра, иодида калия (0,1 М), сульфата хрома (III), сульфата калия, дихромата калия, хлорида железа (III), серной кислоты (0,5 М), красной кровяной соли (0,05 М), йодная вода.
Опыт 1. Исследование сравнительной активности металлов
Налить в пробирки по 1 мл растворов сульфата меди (II) (1 М), сульфата цинка (1 М), сульфата железа (II) (1 М), хлорида олова (II) (1 М), хлорида кадмия (1 М), нитрата серебра (0,1 М). Опустить в растворы (кроме раствора с одноименными ионами) пластинки металлического цинка. Сделать выводы об активности металлов.
Провестианалогичныеопытыспластинкамимеди,железа,свинца. Из каких растворов вытесняются металлы? Почему?
Составить уравнения соответствующих реакций.
Записать металлы по убыванию их восстановительной способности, определенной экспериментально. Привести значения их стандартных электродных потенциалов (табл. 7 приложения).
Соответствует ли экспериментальный ряд металлов их положению в электрохимическом ряду напряжений?
76 |
77 |
