
Metodichka_Akimov_Khimia
.pdf
Работа 2. ОПРЕДЕЛЕНИЕ ХИМИЧЕСКОГО ЭКВИВАЛЕНТА ЭЛЕМЕНТА И СЛОЖНОГО ВЕЩЕСТВА
Эквивалент простого вещества
Эквивалентом элемента называется такое его количество, которое соединяется с 1 молем атомов водорода или замещает такое же количество атомов водорода в химических реакциях. Например, в соединениях НСl, H2S, NH3 эквивалент хлора, серы, азота соответственно 1 моль, 1/2 моля, 1/3 моля.
Масса одного эквивалента называется его эквивалентной массой. Так, в приведенных примерах эквивалентные массы хлора, серы, азота соответственно 34,45/1 = 34,45 г/моль, 32/2 = 16 г/моль, 14/3 = = 4,67 г/моль.
Между валентностью элемента в данном соединении В, мольной
массой его атомов А и его эквивалентной массой mэ существует про- |
|
стое соотношение: |
А |
m |
––– |
э |
В . |
Например, магний двухвалентен, его эквивалентная масса
24,32/2 = 12,156 г/моль.
Химический эквивалент элемента может быть вычислен или экспериментально определен по реакции замещения или соединения этого элемента с водородом, кислородом и другим элементом, для которого известен эквивалент.
В соответствии с законом эквивалентов различные вещества реагируют друг с другом в количествах, пропорциональных их эквивалентным массам. Математически этот закон записывается так:
m1 = mэ1 , m2 mэ2
где m1 и m2 – массы веществ, вступивших в реакцию; mэ1и mэ2 – эквивалентные массы веществ.
Наиболее употребительным методом экспериментального определения эквивалентной массы является метод вытеснения водорода. Этот метод применяется для определения эквивалента тех металлов, которые способны вытеснять водород из разбавленных кислот и щелочей.
Пример. При взаимодействии 0,0936 г железа с серной кислотой выделилось при нормальных условиях 37,3 мл водорода.
Согласно закону Авогадро, моль любого газа при нормальных условиях, т. е. при 0 °С и давлении 101 325 Па (760 мм рт. ст.), занимаетобъем22 400 мл. Эквивалентная массаводорода,составляющая 1/2 моля, занимает при нормальных условиях объем 11 200 мл (по весу 1,008 г), тогда эквивалентная масса железа
mэ = 0,0956 11 200 = 27,9 г/моль. 37,3 1,008
Экспериментальная часть
Целью данной работы является экспериментальное определение эквивалента металла по объему выделившегося водорода в реакции растворения металла в избытке кислоты (опыт 1) и экспериментальное определение эквивалента сложного вещества – гидроксида натрия – по объему израсходованной кислоты известной концентрации
(опыт 2).
Оборудование и реактивы: бюретка на 50 мл – 2 шт., уравнительная склянка – 1 шт., пробирка Оствальда – 1 шт., воронка малая – 1 шт., мерная колба на 100 мл – 1 шт.; навески металла цинка, магния по 0,015–0,030 г; серная кислота 15%-ной концентрации, гидроксид натрия, титрованный раствор соляной кислоты, фенолфталеин.
Опыт 1. Определение эквивалента простого вещества
Прибор для определения эквивалентов состоит из следующих частей (рисунок): бюретки на 50 мл, двухколенной пробирки (пробирки Оствальда), открытой трубки, служащей в качестве уравнительного сосуда, стеклянного крана.
По указанию преподавателя взять навеску магния или цинка и поместить ее в одну часть пробирки Оствальда.
18 |
19 |
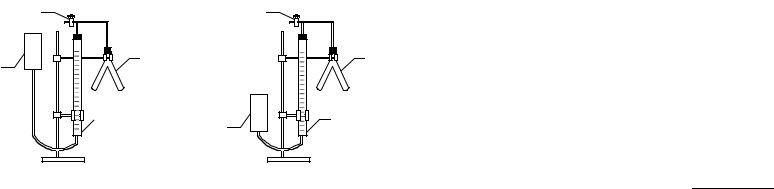
Другую часть пробирки Оствальда аккуратно с помощью воронки наполнить на 2/3 объема разбавленной соляной кислотой. Для магния взять 5%-ный раствор, для цинка – 15%-ный. Присоединить двухколенную пробирку к пробке на трубке, соединенной с бюреткой. При этом кран открывают, укрепляют бюретку на штатив так, чтобы уровни воды в бюретке и открытой трубке совпадали с нулевым делением (рисунок, а).
Прежде чем проводить реакцию, необходимо проверить прибор на герметичность. Для этого проверить, плотно ли вставлены пробки, и закрыть кран тройника. Затем уравнительную трубку опустить на 15–20 с (рисунок, б). Если уровень воды в бюретке снизится и останется без изменения несколько секунд, то прибор герметичен, можно приступить к опыту. Если же уровень воды в бюретке меняется, то необходимо плотно закрыть пробку на бюретке, проверить пробку на пробирке Оствальда и повторить проверку.
После проверки на герметичность установить уравнительную трубку так, чтобы уровень воды в бюретке был на нулевом делении.
Аккуратно, стараясь не нарушить герметичность прибора, повернуть пробирку Оствальда таким образом, чтобы кислота полностью перелилась в то колено пробирки, где находится металл. Начинается реакция с образованием водорода:
Ме + Н2SO4(разб.) = МеСl2 + Н2↑
Осторожно закрепить пробирку на штативе и ждать, когда весь металл растворится. Пока идет реакция, зарисовать в тетради уста-
а |
44 |
б |
4 |
3 |
2 |
|
22 |
|
|
|
|
|
1 |
3 |
1 |
|
|
|
Прибор для определения эквивалента металла: 1 – измерительная бюретка; 2 – пробирка Оствальда; 3 – уравнительный сосуд; 4 – кран
новку и записать показания барометра и термометра. После полного растворенияметалласледуетвыдержать5–7мин,чтобысодержимое сосуда охладилось, затем, не открывая крана, опустить уравнительную трубку до установления на одной высоте уровня воды в бюретке и трубке. При этом внутри прибора создается давление, равное дав-
лению наружного воздуха. |
|
|
|
Записать данные: |
|
|
|
масса металла m = |
г; |
|
|
объем вытесненного водорода в условиях опыта V = |
мл; |
||
температура опыта t = |
°C; |
|
|
атмосферное давление по барометру р = |
мм рт. ст.; |
|
|
давление насыщенного водяного пара при температуре опыта
(находят по таблице) h = |
|
мм рт. ст. |
|
|
Вычисления |
|
|
1. Объем водорода при н. у. вычислить по формуле |
|||
V |
|
= V (р−h) T0 |
, |
0 |
T р0 |
|
|
|
|
|
|
где V0 – объем водорода при нормальных условиях (н. у.), мл; V – объем водорода в условиях опыта, мл; Т – абсолютная температура (t + 273); T0 = 273 °К; р – атмосферное давление, мм рт. ст.; p0 = = 760 мм рт. ст.; h – давление насыщенного водяного пара, мм рт. ст.
2. Эквивалент металла найти по формуле
m =11 200 m ,
э опыт |
V0 |
|
где m – навеска металла, г; V0 – объем водорода при н. у., мл.
3. Теоретический эквивалент металла определить из соотношения
mэ теор = АВ,
где А – мольная масса металла; В – валентность металла. 4. Ошибку, %, вычислить по формуле
Ошибка = mэ теор −mэ опыт 100. mэ теор
20 |
21 |

Эквивалент сложного вещества
Экспериментально эквивалент сложного вещества в зависимости от его химического состава может быть найден различными путями, однако все методы сводятся к определению соотношений, в которых вещества вступают в реакцию друг с другом. Эквивалент многих сложных соединений определяется в растворах.
Концентрацию растворенных веществ для выполнения данной работы удобно выражать двумя способами: через эквивалентную (нормальную) концентрацию и через титр.
Эквивалентная (нормальная) концентрация – это число эквива-
лентов вещества, растворенного в 1 л раствора:
0,1 н. (децинормальный раствор) = 0,1 mэ; 0,01 н. (сантинормальный раствор) = 0,01 mэ,
где mэ – эквивалентная масса, г/моль.
Масса растворенного вещества, содержащегося в 1 мл раствора, называется титром раствора (Т). Раствор, титр которого известен, называется титрованным. Между нормальной концентрацией Сн., эквивалентной массой mэ и титром Т существуют следующие соотношения:
|
m |
|
|
T = V |
, г/мл; |
(1) |
|
mэ = |
T С1000 , |
(2) |
|
|
|
Cнн.. |
|
где m – масса вещества, г; V – объем раствора, мл.
Пример расчета. 2 г гидроксида натрия растворили в 500 мл дистиллированной воды. Методом титрования установили, что эквивалентная (нормальная) концентрация – 0,1 н. Рассчитать титр и эквивалентную массу гидроксида натрия.
T = 5002 = 0,004 г/мл;
СCн. = 0,004 1000 = 40 г/моль.
0,1
Для определения эквивалента кислоты используют титрованный раствор щелочи, а для определения эквивалента щелочи – титрованный раствор кислоты. Процесс определения концентрации растворенных веществ при помощи титрованных растворов называется
титрованием.
При титровании к раствору неизвестной концентрации (допустим, щелочи) добавляют постепенно, при помешивании, по каплям титрованный раствор (в данном случае кислоты) до тех пор, пока не окончится реакция между кислотой и щелочью – реакция нейтрализации. Окончание реакции определяют индикатором – веществом, меняющим окраску при переходе от кислой или щелочной среды в нейтральную; с помощью индикатора устанавливают момент нейтрализации кислоты щелочью или, наоборот, – щелочи кислотой. Этот момент служит признаком достижения так называемой точки эквивалентности, когда на определенное количество кислоты израсходовано эквивалентное количество щелочи.
Если растворы кислоты и основания имеют одинаковую нормальную концентрацию, то это значит, что они содержат в одинаковых объемах равное число эквивалентных масс, а так как вещества вступают в реакции в эквивалентных количествах, то реакция между такими растворами кислоты и щелочи произойдет полностью при смешении равных объемов.
Если же растворы кислоты и щелочи имеют неодинаковую нормальную концентрацию, то точка эквивалентности наступает тогда, когда
Vщ Cн.щ =Vк Сн.к , |
(3) |
где Vщ – количество раствора щелочи, мл; Сн.щ – нормальная концентрация раствора щелочи; Vк – количество кислоты, мл; Сн.к – нормальная концентрация кислоты.
Опыт 2. Определение эквивалента щелочи методом титрования
Получить у преподавателя мерную колбочку на 100 мл, в нее налить раствор заданной щелочи, мерную колбочку осторожно заполнить дистиллированной водой до метки и перемешать.
Установить точную концентрацию приготовленного раствора щелочи при помощи титрованного раствора НСl. Титрованным раство-
22 |
23 |

ром НСl заполнить бюретку через воронку до нулевой отметки, отсчитыватьуровеньпонижнемумениску.Пипеткойна10млотобрать
втри конические колбочки раствор щелочи, в каждую коническую колбочку добавить 2–3 капли индикатора (фенолфталеина), который
вщелочной среде окрашивается в малиновый цвет.
Титрование кислоты щелочью производить следующим образом: подбюреткойнабелыйлистбумагипоставитьконическуюколбочку, правой рукой регулировать скорость подачи жидкости из бюретки, а левой размешивать раствор. Капля за каплей щелочь постепенно нейтрализует кислоту. Уравнение реакции имеет вид
NaOH + HCl → NaCl + Н2О
или в ионном виде
ОН− + Н+ → Н2О Затем отмерить по бюретке объем кислоты, израсходованной на
нейтрализацию титруемой щелочи. Титрование проводить 2-3 раза, каждый раз начиная от нулевой метки, объемы израсходованной кислоты внести в таблицу.
Номер |
Объем раствора |
Объем титрованного |
Среднее значение титро- |
||
щелочи V |
щ |
, |
раствора кислоты |
ванного объема кислоты |
|
титрования |
мл |
|
Vк, мл |
Vк.ср, мл |
|
1 |
10 |
|
|
|
|
2 |
10 |
|
|
|
|
3 |
10 |
|
|
|
|
Порядок расчетов
1.Рассчитать нормальную концентрацию щелочи по формуле (3).
2.Определить титр щелочи по формуле (1).
3.Рассчитать эквивалентную массу щелочи mэ.опыт по формуле (2).
4.Определить щелочь.
5..Рассчитать теоретически эквивалентную массу щелочиmэ.теор
6. Вычислить ошибку, %, по формуле
Ошибка = mэ теор −mэ опытн 100. mэ теор
7.Записать уравнение реакции нейтрализации щелочи кислотой
вмолекулярной и ионной форме.
Контрольные вопросы
1.Дать определение химического эквивалента элемента и сложного вещества.
2.Как рассчитывают эквиваленты элемента, кислоты, основания, соли, оксида?
3.Какие существуют практические методы определения эквивалента элемента, эквивалента сложного вещества?
4.Как выражают концентрацию растворов?
5.Какая операция называется титрованием?
24 |
25 |

Работа 3. ХИМИЧЕСКАЯ КИНЕТИКА. КАТАЛИЗ
Целями работы являются изучение влияния концентрации, температуры, катализаторов на скорость химических реакций и измерение каталитической активности различных катализаторов.
Оборудование и реактивы: пробирки, цилиндры (50 мл), стаканы (100 мл), бюретки (25–50 мл), термометры, пробирки Оствальда, секундомер; диоксид марганца, диоксид свинца, активированный уголь, бихромат калия; растворы тиосульфата натрия (0,1 н.), серной кислоты (1 моль/л), пероксида водорода (30%-ный).
Опыт 1. Влияние концентрации реагирующих веществ на скорость реакции
Зависимость скорости реакции от концентрации реагирующих веществ предлагается изучить на примере реакции взаимодействия растворов тиосульфата натрия Na2S2O3 и серной кислоты
Na2S2O3 + H2SO4 → Na2SO4 + SO2 + H2O + S↓
при различных концентрациях тиосульфата натрия. Реакция идет в три стадии:
S2O32− + 2Н+→ H2S2O3 |
(очень быстро) |
H2S2O3 → H2SO3 + S |
(медленно) |
H2SO3 → SO2 + H2O |
(быстро) |
S2O32− + 2Н+→ S + SO2 + H2O
Скорость суммарного процесса определяется второй стадией. В опыте скорость реакции измеряется временем от начала сливания растворов до появления во всех опытах одинаковой плотности суспензии серы.
В пробирку ввести из бюретки 1 мл раствора Na2S2O3 и 4 мл дистиллированной воды. К полученному раствору Na2S2O3 добавить
5 мл раствора H2SO4 и сразу же начать отсчет времени по секундомеру с момента перемешивания раствора до начала помутнения τ1.
Во вторую пробирку налить из бюретки 2 мл раствора Na2S2O3 и 3 мл дистиллированной воды. Добавить 5 мл раствора H2SO4 и отметить время начала помутнения τ2.
В третью, четвертую и пятую пробирки растворы слить в соотношениях, указанных в табл. 1. По аналогии отмечают время начала
помутнения τ3, τ4, τ5.
В данном опыте измеряют не скорость реакции, а промежуток времени между началом реакции и ее видимым результатом. Однако этот промежуток времени обратно пропорционален скорости реакции, и поэтому величину 100/τ называют условной скоростью vусл.
По данным опытов рассчитать концентрацию и условную скорость. Результаты записать в табл. 1.
Построить график зависимости скорости реакции от концентрации Na2S2O3, откладывая на оси абсцисс концентрацию Na2S2O3, а на оси ординат – величину vусл. На основании полученных данных сделать вывод о влиянии концентрации на скорость реакции, графически определить порядок реакции и записать математическое выражение закона действующих масс.
Таблица 1
|
Объем раствора, мл |
|
Концентрация |
Время |
|
|
|
100 |
|
|||||
|
|
|
|
раствора, моль/л |
ν |
|
= |
, |
||||||
|
|
|
|
|
||||||||||
Номер |
|
|
|
|
|
|
0,1 a |
|
до начала |
усл |
||||
Na2S2O3 |
H2O |
H2SO4 |
С |
|
= |
помутнения |
|
|
τ |
|
||||
опыта |
(а) |
(б) |
(в) |
|
Na2S2O3 |
|
a +б+в |
τ, с |
|
|
с–1 |
|
||
1 |
1 |
4 |
5 |
|
|
|
|
|
|
|
|
|
|
|
2 |
2 |
3 |
5 |
|
|
|
|
|
|
|
|
|
|
|
3 |
3 |
2 |
5 |
|
|
|
|
|
|
|
|
|
|
|
4 |
4 |
1 |
5 |
|
|
|
|
|
|
|
|
|
|
|
5 |
5 |
− |
5 |
|
|
|
|
|
|
|
|
|
|
|
Опыт 2. Влияние температуры на скорость реакции
Налить в одну пробирку 5 мл раствора Na2S2O3, а в другую 5 мл раствора H2SO4. Поместить обе пробирки и термометр в стакан
26 |
27 |
с водой комнатной температуры и через 5 мин записать в табл. 2 показания термометра t1. Не вынимая пробирки с тиосульфатом натрия из стакана с водой, добавить в нее содержимое пробирки с H2SO4 и начать отсчет времени по секундомеру с момента перемешивания до появления опалесценции (легкого помутнения). Записать время протекания данной реакции τ1.
ВдведругиепробиркиналитьтакиежеобъемырастворовNa2S2O3 и H2SO4. Поместить пробирки и термометр в стакан с водой, нагреть воду до температуры на 10° выше комнатной (t2 = t1 + 10°). Затем проделать опыт так же, как и в первом случае, и отметить по секундомеру время τ2.
Аналогично поступить с третьей парой пробирок, повысив температуру воды еще на 10° (т. е. t3 = t2 + 10°). Отметить по секундомеру время τ3. Результаты опытов записать в таблицу по указанной далее форме.
Построить график зависимости логарифма скорости реакции от обратной величины абсолютной температуры. Из графика определяют Еакт:
|
Еакт |
= 2,3 R tg α. |
|||||||||
Рассчитать температурный коэффициент реакции γ: |
|||||||||||
γ = |
τ1 |
; γ |
|
= |
τ2 |
; |
γ |
|
= |
γ1 +γ2 |
. |
|
|
|
|
|
|||||||
1 |
τ2 |
2 |
|
τ3 |
|
ср |
2 |
|
|||
Энергию активации рассчитать по уравнению Аррениуса |
|||||||||||
|
|
Еакт |
= 2,3 R lgγ |
T1 −T2 . |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
T2 −T1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 2 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Темпе- |
Темпе- |
|
|
|
|
Время |
|
Температур- |
νусл = |
100 |
, |
|
|
|
Номер |
ратура |
ратура |
|
1 |
|
до начала |
|
|
|||||||
опыта |
опыта |
опыта |
|
|
|
|
помутнения |
ный коэф- |
|
|
τ |
|
lg v |
|
|
|
|
T |
|
|
|
усл |
|||||||||
|
t, °С |
Т, К |
|
|
|
|
τ, с |
|
фициент γ |
с |
−1 |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
28 |
|
|
|
|
|
|
|
|
Опыт 3. Количественное определение активности различных катализаторов
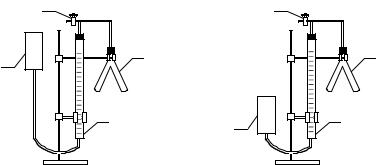
Прибор для определения активности катализатора состоит из следующих частей (рисунок): бюретки на 50 мл, двухколенной пробирки (пробирки Оствальда), открытой трубки, служащей в качестве уравнительного сосуда, стеклянного крана.
В одну часть пробирки Оствальда внести один из катализаторов: 1мл 5%-ногораствораK2Cr2O7,или0,05гугля,или0,05гMnO2,или столько же диоксида свинца. В другую часть пробирки аккуратно с помощью воронки налить на 1/2 объема 30%-ный раствор пероксида водорода. Присоединить двухколенную пробирку к пробке на трубке, соединенной с бюреткой. При этом кран открывают, укрепляют бюретку на штатив так, чтобы уровни воды в бюретке и открытой трубке совпадали с нулевым делением (рисунок, а).
Прежде чем проводить реакцию, необходимо проверить прибор на герметичность. Для этого проверить, плотно ли вставлены пробки, и закрыть кран тройника. Затем уравнительную трубку опустить на 15–20 с (рисунок, б). Если уровень воды в бюретке снизится и останется без изменения несколько секунд, то прибор герметичен, можно приступить к опыту. Если же уровень воды в бюретке меняется, то необходимо плотно закрыть пробку на бюретке, проверить пробку на пробирке Оствальда и повторить проверку.
После проверки на герметичность установить уравнительную трубку так, чтобы уровень воды в бюретке был на нулевом делении.
|
а 4 |
|
б 4 |
3 |
22 |
|
22 |
|
|
|
|
|
1 |
3 |
1 |
|
|
|
Прибор для определения активности катализатора: 1 – измерительная бюретка; 2 – пробирка Оствальда; 3 – уравнительный сосуд; 4 – кран
29

Аккуратно, стараясь не нарушать герметичность прибора, повернуть пробирку Оствальда таким образом, чтобы Н2О2 перелить в часть сосуда с катализатором. Отметить по секундомеру время соприкосновения пероксида водорода с катализатором. По истечении 5 мин (всегда необходимо брать один и тот же интервал времени) привести давление внутри прибора к атмосферному. Измерить объем воды, вытесненной кислородом при разложении пероксида водорода, для чего установить на одинаковом уровне воду в бюретке и трубке.
Опыты повторить с другими катализаторами и по объему выделившегося кислорода расположить испытанные катализаторы в порядке возрастания их активности.
Контрольные вопросы
1.Для каких реакций можно предсказать зависимость скорости реакции от концентрации реагирующих веществ?
2.Перечислите в порядке понижения значимости факторы, влияющие на скорость химической реакции.
3.Перечислите в порядке понижения значимости факторы, влияющие на константу скорости химической реакции.
4.Каков физический смысл константы скорости? Как она определяется? Когда численные значения константы скорости и скорости совпадают? Каковы размерности и единицы измерения константы скорости и скорости?
5.Предложите определения понятий порядка и молекулярности химической реакции. Укажите необходимые признаки, характеризующие эти понятия. Особое внимание обратите на то, что молекулярность всегда целое небольшое число, а порядок может быть равным нулю, целому и дробному числам.
6.Как скажутся на значении константы скорости следующие факторы, влияющие на скорость реакции: а) различные начальные концентрации реагирующих веществ; б) изменение температуры; в)введениеразличныхвеществ;г)сменарастворителя;д)изменение объема системы?
Работа 4. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Целью работы является изучение влияния различных факторов на установление и смещение химического равновесия.
Оборудование и реактивы: пробирки, хлорид аммония; очень разбавленный и концентрированный раствор хлорида железа (III); очень разбавленный и концентрированный раствор роданида аммония; растворы хромата калия, серной кислоты, гидроксида калия (2 н.).
Опыт 1. Влияние концентрации реагирующих веществ на сдвиг химического равновесия
Приготовить смесь равных объемов 0,1 н. FeCl3 и 0,1 н. NH4CNS (2 мл раствора FeCl3 и 2 мл раствора NH4CNS).
Реакция взаимодействия хлорида железа (III) и роданида аммония обратима:
FeCl3 + 3NH4CNS ↔ Fe(CNS)3 + 3NH4Cl*
Роданид железа интенсивно окрашен в красный цвет, FeCl3 – в желтый, а NH4CNS и NH4Cl бесцветны.
Разлить 4 мл раствора (FeCl3 + 3NH4CNS) в четыре пронумерованные пробирки. В пробирку 1 внести несколько капель концентрированного раствора NH4CNS, в пробирку 2 – несколько капель концентрированного раствора FeCl3, в пробирку 3 – немного кристаллической соли NH4Cl. Раствор в пробирке 4 – контрольный. Пробирки встряхнуть (соли должны полностью раствориться) и наблюдать за изменением окраски растворов в пробирках 1, 2, 3 по сравнению с окраской контрольной смеси.
Пользуясь законом действия масс, объяснить изменение окраски в первых трех пробирках. Результаты записать в табл. 1 по указанной форме.
*Точнее, в данной реакции получаются роданидные комплексы железа
(III)с числом роданидных групп железа от 1 до 5.
30 |
31 |
|
|
Таблица 1 |
|
|
|
|
|
Добавленный раствор |
Изменение интенсивности |
Направление смещения |
|
окраски |
равновесия |
||
|
|||
|
|
|
|
|
|
|
Опыт 2. Влияние температуры
При взаимодействии йода с крахмалом образуется синее вещество сложного состава (соединение включения):
йод + крахмал ↔ йодокрахмал.
В две пробирки налить по 4-5 мл раствора крахмала и добавить 1 каплю 0,1 н. раствора I2. Нагреть одну из пробирок, а затем снова охладить. Вторую пробирку оставить для сравнения. Что происходит? Экзоили эндотермической является реакция образования йодокрахмала?
Опыт 3. Изучение равновесия гомогенной реакции в растворе, определение константы равновесия Kр
Изучается реакция
2FeCl3 + 2KI ↔ 2FeCl2 + I2 + 2KCl
В пронумерованные колбы на 100 мл с притертыми пробками налить заданное количество растворов KI и FeCl3 известной концентрации. Колбы поместить в термостат на 30 мин при температуре 23 ± 0,2 °С. (По указанию преподавателя часть учащихся проводит эксперимент при 40 °С).
Растворы исходных продуктов представлены в виде табл. 2 по указанной форме.
Налить в 8 конических колб по 35–50 мл дистиллированной воды и охладить их. Ледяная вода должна приостановить реакцию и зафиксировать момент, к которому относится изменение концентрации. Слить вместе содержимое колб 1 и 2, а через 10 мин – содержимое колб 3 и 4. Момент сливания растворов зафиксировать. Колбы закрыть пробками и поставить в термостат.
|
|
|
|
Таблица 2 |
|
|
|
|
|
|
|
Раствор 0,03 М, мл |
|
Номер колбы |
|
||
|
|
|
|
||
1 |
2 |
3 |
4 |
||
|
|||||
|
|
|
|
|
|
FeCl3 |
50 |
− |
55 |
− |
|
KI |
− |
50 |
− |
45 |
|
|
|
|
|
|
|
Протекание реакции контролируют по увеличению концентрации йода. Постоянная концентрация I2 свидетельствует о достижении равновесия. Контролируют изменение концентрации йода указанным далее образом. Через 25 мин после смешения растворов из каждой колбы, не вынимая ее из термостата, отобрать пипеткой 15 мл раствора и слить в охлажденную колбу титрования. За время отбора пробы считать момент сливания раствора из пипетки в колбу титрования. Время отмечают с точностью до 1 мин. Сразу после отбора пробы йод оттитровать 0,015 М раствором гипосульфита натрия с известным титром до бледно-желтой окраски раствора. Затем прибавить несколько капель раствора крахмала и продолжить титрование до исчезновения синего окрашивания раствора. Светло-синяя окраска, появляющаяся через некоторое время, не учитывается. Вторую пробу титруют через 30 мин, третью – через 40 мин и т. д. Отбор проб прекращают тогда, когда на титрование йода в двух последовательно взятых из каждой колбы пробах, расходуется одинаковое количество гипосульфита. Это свидетельствует о достижении равновесного состояния реакции.
Экспериментальные и расчетные данные записывают в табл. 3 по приведенной далее форме.
Константу равновесия изучаемой реакции определить по уравнению
Kp = |
[FeCl2 ]2 [KCl]2 [I2 ] |
|||||
|
|
[KI]2 [FeCl3 |
]2 |
|||
|
|
|
||||
Концентрация йода в состоянии равновесия |
||||||
С |
I2 |
= 1 C |
г |
V1 |
, |
|
|
|
2 |
V2 |
|
||
|
|
|
|
|
||
где Сг – молярность раствора гипосульфита; V1 – объем гипосульфита,израсходованногонатитрование,мл;V2 –объемвзятойпробы,мл.
32 |
33 |

|
|
|
|
|
|
|
|
|
Таблица 3 |
|
|
|
|
|
|
|
|
||
|
|
Колба 1 |
|
Колба 2 |
|
Колба 3 |
Колба 4 |
||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
Концентрация, моль |
||||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
Номер пробы |
Время отбора пробы |
Объем гипосульфита, израсходованного на титрование, мл |
Время отбора пробы |
Объем гипосульфита, израсходованного на титрование, мл |
Вещество |
Начальная |
Равновесная |
Начальная |
Равновесная |
1
2
3
4
5
Концентрация ионов Fe+2 будет равна удвоенной концентрации йода, так как по уравнению реакции образуется одна молекула йода и два иона Fe+2; следовательно, CFe+2 = 2 СI2 .
Равновесная концентрация Fe+3 равна разности начальной концентрации ионов Fe+3 и равновесной концентрации Fe+2, так как по
уравнению реакции прирост концентрации Fe+2 равен убыли концентрации Fe+3:
CFe+3 = СFeCl2 −CFe+2 или CFe+3 = СFeCl2 −2CI2
Содержание FeCl3 вычисляют по концентрации израсходованного раствора и степени разбавления его при смешении растворов:
C0FeCl2 =C0FeCl2 |
a |
, |
|
a +b |
|||
|
|
где C0FeCl2 – начальная концентрация раствора, моль/л; a и b – количества растворов соответственно, мл.
Концентрацию ионов I− вычисляют по уравнениям
C |
− = C |
|
−a C |
, |
C |
KI |
= C0 KI |
b |
, |
KI |
|
||||||||
I |
|
|
I2 |
|
KI |
a +b |
|
||
|
|
|
|
|
|
|
|
|
где C0 KI – исходная концентрация йодида калия. Расчет Kр производится отдельно для двух взятых исходных смесей.
Контрольные вопросы
1.Как объяснить, почему изменение температуры в равновесной системе приводит к смещению равновесия?
2.Почему чем больше тепловой эффект реакции, тем сильнее сказывается изменение температуры на равновесии и константе равновесия?
3. С повышением температуры равновесие реакции 2SO2 + O2 ↔ 2SO3 смещается влево. Определите знак теплового эффекта.
4.Назовите факторы, позволяющие смещать равновесие, не изменяя константу равновесия.
5.Назовите факторы, смещающие равновесие и изменяющие константу равновесия.
6.Предложите возможные объяснения, почему концентрация вещества в кристаллическом и жидком состояниях не входит в выражение константы равновесия.
34 |
35 |
Работа 5. ИДЕАЛЬНЫЕ РАСТВОРЫ И ИХ СВОЙСТВА
Целью работы является изучение основных закономерностей поведенияидеальныхрастворовиэкспериментальныхметодовопределения концентрации идеальных растворов на основании изменения свойств раствора относительно свойств растворителя.
Основные понятия
Смеси веществ и растворы
Если привести в соприкосновение два вещества, то можно получить либо их механическую смесь, либо новое химическое соединение, образующееся за счет их химического взаимодействия. Растворение представляет собой промежуточный процесс между приведеннымислучаями.Составраствороввопределенныхинтервалах изменения температуры и концентраций может меняться непрерывно. Отсутствие постоянных соотношений между компонентами, образующими раствор, и неприменимость к процессу растворения закона эквивалентов приближает растворы к механическим смесям. С химическими же соединениями их роднит однородность растворов на молекулярном уровне, а также наблюдаемые при растворении тепловые и объемные эффекты.
Понятия растворителя и растворенного вещества в значительной степени условны. Выбор одного из компонентов как растворителя обычно связан с преобладанием его концентрации в растворе. Иногда за растворитель принимают то вещество, которое при охлаждении первым кристаллизуется из раствора.
При образовании раствора в общем случае происходит изменение свойств как растворителя, так и растворенного вещества. Совокупность всех процессов, протекающих в результате введения в растворитель растворенного вещества, называется сольватацией. В резуль-
татесольватацииврастворемогутвозникнутьразличныесоединения переменного состава, включающие в себя частицы как растворителя, так и растворенного вещества. Такие соединения называют сольватами. В результате образования в растворе сольватов изменяется структура растворителя, соответственно, свойства раствора должны отличаться от свойств чистого растворителя. Образование сольватов может быть рассмотрено как протекание химических реакций, и, как и любой химический процесс, оно сопровождается тепловыми и (или) объемными эффектами. Однако в ряде случаев тепловые и объемные эффекты при образовании раствора отсутствуют. Такие растворы называют идеальными.
Идеальные растворы
Следует иметь в виду, что понятие идеального раствора является абстрактным, так как в реальной ситуации, пусть и незначительные, тепловые и объемные эффекты при растворении присутствуют всегда и можно говорить только о том, в какой степени раствор приближается к идеальному.
Если тепловые и объемные эффекты пренебрежимо малы, то для описания такого раствора можно использовать понятие идеального раствора.
Идеальные растворы по своим свойствам близки к идеальным газам, то есть системам, получаемым простым механическим перемешиванием компонентов на молекулярном уровне. В этом случае силами взаимодействия между частицами разных веществ (А и В) можно пренебречь по сравнению с силами взаимодействия между частицами каждого из компонентов (А и А или В и В). Наиболее близкими по своим свойствам к идеальным растворам являются растворы веществ, близких по своему строению и свойствам (например, растворы толуола в бензоле, метилового спирта в этиловом и т. д.). Кроме того, как идеальные можно рассматривать сильно разбавленные растворы неэлектролитов. В первом случае взаимодействие между частицами растворенного вещества и растворителя примерно одинаково, а во втором – незначительность концентрации растворенного вещества и отсутствие электростатических зарядов у продуктов его взаимодействия с растворителем приводят к тому, что изменения в строении растворителя носят локальный и незначительный характер. Частицы растворенного вещества в сильно
36 |
37 |
