
Metodichka_Akimov_Khimia
.pdfразбавленном растворе неэлектролита находятся друг от друга на значительном расстоянии, их взаимодействием между собой можно пренебречь, и растворитель практически не изменяет своего строения и свойств.
Температуры кипения и отвердевания
Для того чтобы давление пара над раствором было таким же, что и над чистым растворителем, необходимо нагреть раствор до более высокой температуры. В соответствии с этим раствор при одинаковом атмосферном давлении закипает при более высокой температуре, чем чистый растворитель. При этом смещение температуры кипения пропорционально содержанию растворенного вещества в растворе:
Tкип = Ткип.раствора – Tкип.растворителя = E · Cm, |
(1) |
где С – концентрация раствора; Е – коэффициент пропорциональности.
Кристаллизация растворителя начинается при условии, что давление насыщенных паров над жидкостью снизится до величины, соответствующей давлению паров над его кристаллами. При замерзании (кристаллизации) идеального раствора процесс начинается с выпадения из него кристаллов чистого растворителя.
Именно температура появления первых кристаллов и принимается за температуру кристаллизации (замерзания) раствора. Понижение температуры кристаллизации раствора пропорционально понижению давления паров чистого растворителя. Поэтому раствор всегда замерзает при более низкой температуре, чем чистый растворитель:
∆Tзамерз. =Tзамерз.растворителя −Tзамерз. раствора = K · Cm, |
(2) |
где Сm – моляльная концентрация раствора; K – коэффициент пропорциональности.
Обычно концентрация раствора при проведении измерений изменения температуры фазовых переходов в растворах определяется в виде моляльной концентрации.
Моляльная концентрация показывает, сколько молей растворенного вещества содержится в 1 кг растворителя. Если g граммов растворенного вещества с молекулярной массой М растворены в G
граммах растворителя, то моляльная концентрация такого раствора определяется по формуле
Cm = |
1000 g . |
(3) |
|
M G |
|
Физический смысл коэффициентов пропорциональности Е и K ясен из приведенных выше выражений для изменения температуры фазовых переходов. K и Е представляют собой моляльные изменения температуры соответствующих фазовых переходов (то есть изменения, происходящие при введении в раствор 1 моля вещества на 1 кг растворителя).
Константа K называется криоскопической постоянной, а константа Е – эбулиоскопической постоянной. Значения K и Е зависят только от природы растворителя и не зависят от того, какое вещество мы в нем растворяем. Теоретически значение констант K и Е может быть вычислено из уравнений:
|
|
R T 2 |
|
|
||
K = |
|
кр. |
; |
(4) |
||
|
1000 F |
|||||
E = |
|
R T 2 |
|
|
||
|
кип. |
|
, |
(5) |
||
1000 L |
||||||
|
|
|
||||
где Tкр – температура кристаллизации чистого растворителя; Tкип – температура кипения чистого растворителя; R – универсальная газовая постоянная; F – удельная теплота плавления чистого растворителя; L – удельная теплота его парообразования.
Изотонический коэффициент
В случае рассмотрения разбавленных растворов слабых электролитов, которые при растворении за счет протекания процесса электролитической диссоциации дают относительно малое количество заряженных частиц, уравнения, описывающие закономерности поведения идеальных растворов и рассмотренные ранее, также могут быть использованы. Однако для этого в них необходимо ввести поправочный множитель i, называемый изотоническим коэффициентом.
38 |
39 |
Таким образом, для растворов разбавленных электролитов имеем:
Pj = i · P0 · Nj , |
(6) |
где P0 – общее давление насыщающих паров над раствором; Nj – мольная доля соответствующего компонента в растворе.
Величина изотонического коэффициента всегда больше 1, но, как правило, является дробной величиной. Если пренебречь наличием электрическогозарядаучастиц,образующихсяврезультатеэлектролитической диссоциации слабых электролитов, а учитывать только увеличение их количества, то значение изотонического коэффициента можно связать с величиной степени диссоциации электролита
i = 1 + α (n – 1), |
(7) |
где n – число ионов, образующихся из одной молекулы растворенного вещества; α – степень его диссоциации в растворе (доля распавшихся молекул).
Отсюда имеем
i −1 |
|
α = n −1 . |
(8) |
Применение законов идеальных растворов
Из приведенных в предыдущем разделе соотношений, в зависимости от того, какие характеристики раствора известны, а какие нет, можно получить следующую информацию:
1) определить молекулярную массу растворенного вещества
M = |
K g 1000 |
= |
E g 1000 |
; |
G ∆T |
G ∆T |
|||
|
замерз |
|
кип |
|
2) определить значение криоскопической или эбулиоскопической постоянной для растворителя
K = ∆Tзамерз , E = ∆Tкип .
Cm Cm
3) найти значение изотонического коэффициента, характеризующего поведение данного растворенного вещества в данном конкретном растворителе,
i = ∆Tзамерз .
K Cm
4)определить степень диссоциации растворенного вещества
α= ni −−11 ;
5)найти моляльную концентрацию растворенного вещества в растворе
Cm = ∆TKзамерз .
Экспериментальная часть
Опыт 1. Криоскопия
Криоскопический метод определения молекулярной массы растворенных веществ основан на измерении понижения температуры замерзания раствора с известной моляльной концентрацией относительно температуры замерзания чистого растворителя.
Криоскопический метод обычно применяют для сильно разбавленных растворов в бинарных системах. При замерзании таких растворов сначала выпадают кристаллики растворителя, и раствор становится более концентрированным, температура кристаллизации оставшегося раствора еще больше понижается. Поэтому при определении температуры кристаллизации раствора следует отмечать момент начала его затвердевания.
В некоторых случаях возможно переохлаждение раствора ниже истинной температуры кристаллизации. В результате после снижения температуры ниже температуры кристаллизации и при начале выпадения из него кристаллов температура может начать увеличиваться за счет выделяющегося при этом процессе тепла. Однако после повышения до определенного предела температура вновь начинает уменьшаться. В этом случае за температуру кристаллизации следует принимать предел повышения температуры после выпадения первых кристаллов.
Оборудование и принадлежности
Пробирки и стаканы химические по ГОСТ 20292–74, термометр по ГОСТ 215–75.
40 |
41 |
Порядок выполнения работы
1.Приготовить охладительную смесь изо льда и нитрата калия (примерное соотношение 10 : 1) и наполнить ею основную емкость криоскопа.
2.Отмерить с помощью мерного цилиндра 20 мл воды.
3.Перелить воду в пробирку криоскопа.
4.Поместить пробирку с водой в охладительную смесь.
5.Постоянно перемешивая жидкость, довести ее до температуры замерзания. Зафиксировать температуру замерзания растворителя.
6.Повторить измерения по пп. 2–5 еще 2 раза для определения погрешности.
7.Повторить п. 2, добавив в растворитель заранее приготовленную навеску растворяемого вещества, перемешивая жидкость до полного растворения.
8.Повторить действия по пп. 3–6 с целью определения температуры кристаллизации раствора.
9.Полученные данные занести в табл. 1, 2.
10.Рассчитатьпоприведеннымдалееформуламивнестивтабл.2 значения молекулярной массы растворенного вещества (М) и изотонического коэффициента (i):
M = |
1000 K g |
, Cm = |
∆Tзамерз |
, i = |
∆Tзамерз |
, |
|
G ∆Tзамерз |
|
K Cm |
|||||
K |
|||||||
|
|
|
|
где Cm – моляльная концентрация растворенного вещества; K– криоскопическая постоянная растворителя.
Опыт 2. Эбулиоскопия
Метод эбулиоскопии заключается в определении характеристик растворенного вещества по его влиянию на температуру кипения растворителя.Эбулиоскопическийметодопределениямолекулярной массы растворенных веществ обычно используют при анализе только водных растворов, избегая испарения токсичных органических растворителей. При этом концентрация растворенного вещества должна быть относительно невелика, для того чтобы исследуемый раствор мог рассматриваться как близкий к идеальному состоянию по своим свойствам.
|
|
|
Таблица 1 |
|
|
|
|
|
Чистый растворитель |
||
|
|
|
|
№ п/п |
Масса растворителя |
|
Температура кристаллизации |
|
|
|
|
1 |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
Среднее значение |
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 2 |
|
|
|
|
Раствор |
|
|
|
|
|
|
|
|
|
|
|
Номерп/п |
МассарастворителяG |
Массарастворенного веществаg |
Температура кристаллизацииT |
Понижение температуры кристаллизацииТ |
Молекулярная веществамасса M |
Изотонический коэффициентi |
|
|
|
|
|
|
замерз |
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Среднее |
значение |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Оборудование и принадлежности
Пробирки по ГОСТ 20292–74, термометр по ГОСТ 215–75, глицериновая баня по ГОСТ 237–78.
Порядок выполнения работы и обработка результатов эксперимента
1.В коническую пробирку, соединенную с термометром, налить 0,5 мл растворителя (вода) так, чтобы жидкость находилась на уровне ртутного шарика.
2.Поместить в пробирку с жидкостью гранулу цеолита.
42 |
43 |

3.Термометр с пробиркой поместить в глицериновую баню и равномернонагретьдотехпор,покасповерхностицеолитаненачнутнепрерывно выделяться пузырьки воздуха (начало процесса кипения).
4.Повторить опыт с целью определения погрешности.
5.Зафиксировать температуру кипения растворителя.
6.Приготовить в отдельной пробирке исследуемый раствор из навески исследуемого вещества (выдается преподавателем) и растворителя.
7.Налить в коническую пробирку 0,5 мл исследуемого раствора
иповторите измерения по пп. 2–4 еще 2 раза.
8.Привести полученное значение температуры кипения к нор-
мальнымусловиямпоуравнению ∆Tкип. = 0,00012(760− P) (273+T0 ), где Tкип и Т0 – соответственно температуры кипения в условиях экс-
перимента (при давлении Р) и при нормальном давлении. 9. Заполнить по результатам измерений табл. 3.
|
|
|
|
Таблица 3 |
|
|
|
|
|
Параметры |
Растворитель |
Раствор |
Погрешность |
|
Температура кипения, °С |
1 |
|
|
|
|
2 |
|
|
|
|
3 |
|
|
|
Среднее значение, °С |
|
|
|
|
Среднее значение, приведенное |
|
|
|
|
к нормальным условиям, °С |
|
|
|
|
Расчетное значение, °С |
|
|
|
|
Молекулярная масса растворен- |
|
|
|
|
ного вещества, г/моль |
|
|
|
|
Контрольные вопросы
1.Какие растворы называются идеальными? Какие реальные растворы приближаются по своим свойствам к идеальным?
2.Объясните закономерности изменения температуры замерзания и кипения раствора при изменении их концентрации.
3.Что такое криоскопическая и эбулиоскопическая постоянные? От чего зависит их величина?
4.Каков физический смысл изотонического коэффициента?
5.В чем суть методов криоскопии и эбулиоскопии?
Работа 6. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ. СВОЙСТВА РАСТВОРОВ ЭЛЕКТРОЛИТОВ
Электролитами называются вещества, растворы или расплавы которых проводят электрический ток.
Электролитическая диссоциация – это процесс распада элек-
тролита на ионы под действием полярных молекул растворителя. В зависимости от степени электролитической диссоциации (α) различают сильные и слабые электролиты. Степень диссоциации – это отношение числа молекул, распавшихся на ионы n, к общему числу молекул N:
α = Nn .
Если α > 0,3, т. е. из 100 молекул более 30 молекул распались на ионы, то электролит сильный. К сильным электролитам относятся:
• некоторые неорганические кислоты, такие как HCl, HBr, HI,
HNO3, H2SO4, H2SeO4, HClO4, HMnO4;
• основания щелочных и некоторых щелочно-земельных металлов;
• почти все растворимые соли.
Сильные электролиты диссоциируют в одну стадию, количественной характеристикой процесса является константа диссоциации (отношение произведения равновесных концентраций образовавшихся ионов к равновесной концентрации исходного вещества). Например,
H SO |
4 |
→ 2H+ + SO |
−2 |
|
2 |
|
4 |
||
Kд |
= |
[H+]2[SO4−2 |
] |
|
[H2SO4] |
|
|
||
|
|
|
|
|
Слабые электролиты могут диссоциировать ступенчато, причем процесс протекает преимущественно по первой ступени, слабее –
44 |
45 |
по второй и совсем незначительно – по третьей.
H2CO3 |
↔ H+ + HCO3− |
Kд1 = |
[H+][HCO3−] |
|||
|
|
|
|
|
|
[H2CO3 ] |
− |
|
+ |
−2 |
|
[H+][CO3−2 ] |
|
HCO3 |
|
↔ H |
|
+ CO3 |
Kд2 = |
[HCO3−] |
К слабым электролитам относятся:
•все органические кислоты;
•неорганические кислоты, кроме уже упомянутых;
•основания металлов, за исключением щелочных и щелочноземельных;
•вода.
Одновременно с процессом диссоциации (распада на ионы) происходит процесс ассоциации (соединения положительно и отрицательно заряженных ионов в молекулы), т. е. электролитическая диссоциация является обратимой реакцией.
На степень электролитической диссоциации существенное влияние оказывают концентрация электролита и температура. Обычно при разбавлении раствора и повышении температуры процесс усиливается.
Экспериментальная часть
Цель работы – экспериментальное изучение процесса электролитической диссоциации и электропроводности сильных и слабых электролитов.
Оборудованиеиреактивы: лабораторный реостат, угольные электроды; хлорид натрия, мрамор, хлорид аммония; растворы соляной кислоты, гидроксида натрия, уксусной кислоты, гидроксида аммония, хлорида железа (III), метасиликата натрия, хлорида бария.
Опыт 1. Экспериментальное наблюдение электролитической диссоциации
Химический стакан наполнить на 1/2 его объема дистиллированной водой. Предварительно убедиться, что вилка лампового реостата вынута из розетки. Опустить в стакан угольные электроды. Электроды должны быть частично погружены в воду, но не касаться дна
стакана. Включить реостат в сеть. Проводит ли электрический ток дистиллированная вода? Выключить реостат.
В сухой стакан насыпать поваренную соль (NaCl) так, чтобы она покрыла дно стакана и электроды, опущенные в стакан, могли касаться ее. Включить ламповый реостат. Загорается ли лампочка? Проводит ли сухая соль электрический ток?
При выключенном реостате прилить к соли 20–30 мл дистиллированной воды, перемешать. Что наблюдается при включении лампового реостата?
Результаты опыта занести в табл. 1.
Таблица 1
Раствор (вещество) |
Оценка электропроводности |
Заключение |
|
|
|
|
|
|
Опыт 2. Сравнение электропроводности растворов электролитов
Испытать электропроводность растворов, приведенных в табл. 2, погружая электроды реостата в стакан, заполненный на 1/2 объема испытуемым раствором. После каждого испытания ополаскивать стакан дистиллированной водой.
В последнем опыте слить растворы гидроксида аммония и уксусной кислоты. Испытать электропроводность полученного раствора, сравнить с электропроводностью индивидуальных веществ.
Написать уравнение взаимодействия гидроксида аммония и уксусной кислоты в молекулярной и ионно-молекулярной формах.
Заполнить табл. 2.
|
|
|
Таблица 2 |
|
|
|
|
|
Характеристика |
Уравнение |
Выражение |
Электролит |
электролитической |
константы |
|
|
электролита |
диссоциации |
диссоциации |
|
|
||
HCl |
|
|
|
NaOH |
|
|
|
CH3COOH (конц.) |
|
|
|
NH4OH (конц.) |
|
|
|
NH4OH + CH3COOH |
|
|
|
46 |
47 |
Опыт 3. Влияние добавления соли слабого основания |
Контрольные вопросы |
|
на степень его диссоциации |
1. Какие вещества называются электролитами? |
|
В две пробирки внести по 2–3 мл раствора гидроксида аммония. |
||
2. В чем заключается механизм процесса диссоциации? |
||
В каждую пробирку прибавить одну-две капли раствора фенолфта- |
3. Что такое степень и константа диссоциации электролита и от |
|
леина. Одну пробирку оставить в качестве контрольной, а в другую |
чего зависят их величины? |
|
добавить 3-4 микрошпателя сухого хлорида аммония и перемешать |
4. В чем суть закона разбавления Оствальда? |
|
раствор стеклянной палочкой. Сравнить интенсивность окраски по- |
|
|
лученного раствора и контрольного. |
|
|
Написать уравнение диссоциации гидроксида аммония и выраже- |
|
|
ние константы его диссоциации. Указать, как смещается равновесие |
|
|
в этом растворе при добавлении к нему хлорида аммония и почему |
|
|
окраска раствора бледнеет. |
|
|
Опыт 4. Сравнение химической активности кислот |
|
|
В одну пробирку на 1/4 ее объема налейте раствор соляной кис- |
|
|
лоты с молярной концентрацией СHCl = 2 моль/л, в другую – столько |
|
|
же уксусной кислоты с такой же концентрацией. |
|
|
Выбрать два примерно одинаковых кусочка мрамора. В каждую |
|
|
пробирку бросить по одному кусочку. Отметить интенсивность вы- |
|
|
деления газа в одной и второй пробирках. |
|
|
Написать уравнения реакций. |
|
|
Опыт 5. Направление обменных процессов в растворах |
|
|
электролитов |
|
|
В три пробирки внести по 1–2 мл следующих растворов: в пер- |
|
|
вую – хлорид железа (III) + гидроксид натрия; во вторую – метаси- |
|
|
ликат натрия (Na2SiO3) + соляную кислоту; в третью – разбавленную |
|
|
серную кислоту + хлорид бария. Наблюдать в первой пробирке вы- |
|
|
падение осадка гидроксида железа, во второй – кремниевых кислот |
|
|
(условно метакремниевой кислоты), в третьей – сульфата бария. На- |
|
|
писать уравнение реакций в молекулярной и ионных формах. |
|
48 |
49 |
Работа 7. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ. ГИДРОЛИЗ СОЛЕЙ
Химическое обменное взаимодействие ионов растворенной соли с водой, приводящее к образованию слабодиссоциирующих продуктов (молекул слабых кислот или оснований, анионов кислых и катионов основных солей) и сопровождающееся измерением рН среды, называется гидролизом.
Изменение рН при растворении солей в воде является одним из основных признаков, указывающих на протекание в растворе гидролиза. Так, раствор, получающийся при растворении ацетата натрия в воде, имеет щелочную реакцию (рН > 7):
NаСН3СОО + Н2О ↔ СН3СООН + NaОН
или в ионной форме СН3СОО− + Н2О ↔ СН3СООН + ОН−
Характер гидролиза растворенного вещества определяется природой соли. Различают несколько вариантов взаимодействия соли с водой.
Пример 1. Соль, образованная сильным основанием и слабой кислотой, гидролизуется по аниону, так как анион образует с ионами водорода слабодиссоциирующее соединение:
KСN + Н2О ↔ KОН + НСN
или в ионной форме
СN− + Н2О ↔ ОН− + НСN Реакция среды щелочная (рН > 7).
Соли, образованные многоосновной слабой кислотой, гидролизуются ступенчато.
Первая ступень:
K2СО3 + Н2О ↔ KНСО3 + KОН
или в ионной форме СО3−2 + Н2О ↔ НСО3− + ОН−
Вторая ступень:
KНСО3 + Н2О ↔ Н2СО3 + KОН или в ионной форме
НСО3− + Н2О ↔ Н2СО3 + ОН− Пример 2. Соль, образованная слабым основанием и сильной
кислотой, гидролизуется по катиону, так как катион образует с ионами гидроксида слабодиссоциирующее соединение. Поскольку в результате гидролиза образуется сильная кислота, то раствор такой соли имеет рН < 7. Соли слабых многокислотных оснований гидролизуются ступенчато.
Первая ступень:
Fe2(SO4)3 + 2Н2О ↔ 2FeОHSO4 + Н2SO4
Fe+3 + Н2О ↔ (FeОH) +2 + Н+
Вторая ступень:
2FeОHSO4 + 2Н2О ↔ [Fe(ОH)2]2SO4 + Н2SO4
(FeОH)+2 + Н2О ↔ Fe(ОH)2+ + Н+
Третья ступень:
[Fe(ОH)2]2SO4 + 2Н2О ↔ 2Fe(ОH)3 + Н2SO4
Fe(ОH)2+ + Н2О ↔ Fe(ОH)3 + Н+
Пример 3. Соль, образованная слабым основанием и слабой кислотой, гидролизуется и по катиону, и по аниону:
NН4СН3СОО + Н2О ↔ СН3СООН + NН4ОН или в ионной форме
NН4+ + СН3СОО− + Н2О ↔ NН4ОН + СН3СООН
От силы образующихся слабых кислоты и основания зависит рН среды, обычно составляющий 6–8.
Экспериментальная часть
Целью работы является экспериментальное изучение гидролиза солей в зависимости от их природы, влияния различных факторов
50 |
51 |
на степень гидролиза, определение и измерение водородного показателя при растворении веществ в воде, указывающее на протекание в растворе гидролиза.
Оборудование и реактивы: спиртовка, пробирки на 10 мл – 8 шт., стакан емкостью 50 мл – 1 шт., рН-метр; растворы хлорида натрия, карбоната натрия, сульфата алюминия, сульфата калия, хлорида алюминия, ацетата калия – 0,1 моль/л, нитрата висмута – 0,5 моль/л, фенолфталеина, метилового оранжевого; металл – цинк.
Опыт 1. Исследование гидролиза солей и определение рН растворов с помощью индикаторов и рН-метра
Налить в отдельные пробирки по 1–2 мл 0,1 н. растворов солей NаCl, Nа2CO3, Al2(SO4)3, K2SO4. Прибавить в каждую пробирку по 2-3 капли индикатора – фенолфталеина. Появление малиновой окраски свидетельствует о том, что раствор имеет щелочную реакцию. Отсутствие окраски указывает на нейтральность или кислотность раствора.
Для определения характера реакции растворов, которые не изменили своей окраски, прибавить к ним 2-3 капли индикатора – метилоранжа. Появление розовой окраски свидетельствует о кислой реакции среды. Растворы, в которых цвет метилоранжа не изменился, следует считать нейтральными.
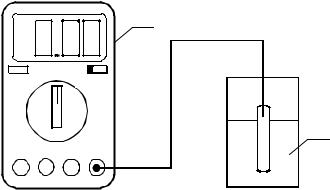
Уточнить значения рН растворов путем измерения с помощью рН-метра (рисунок). Установить переключатель «размах» в положение «рН». Включить рН-метр, при этом на передней панели прибора загорается цифровой индикатор.
Стакан и электроды ополоснуть дистиллированной водой, высушить их фильтровальной бумагой. В сухой стакан поместить исследуемый раствор (20–30 мл), опустить в него электроды и зафиксировать значение рН раствора.
Результаты определений внести в таблицу. Составить молекулярные и ионные уравнения реакций гидролиза тех солей, для которых он имеет место.
Опыт 2. Растворение металла в продуктах гидролиза
Впробирку налить 2 мл раствора хлорида алюминия и опустить
враствор кусочек цинка, очищенного от оксидной пленки. Раствор
1
 Вкл. рНpH
Вкл. рНpH
2  33
33
Схема установки для измерения рН: 1 – рН-метр; 2 – измерительный электрод; 3 – стакан с раствором
|
|
Реакция растворов |
|
Основание или |
Вывод о |
||
|
Фор- |
|
|
|
рН |
||
№ |
|
|
|
кислота (сильные, |
том, что |
||
п/п |
мулы |
щелоч- |
кис- |
нейтраль- |
рас- |
слабые), которыми |
произошел |
|
солей |
ная |
лая |
ная |
твора |
образована соль |
гидролиз |
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
нагреть до кипения. Наблюдать выделение газа. Составить уравнения реакций.
Опыт 3. Влияние температуры на степень гидролиза
В две пробирки налить по 1–2 мл раствора ацетата калия и добавить по 1-2 капли раствора фенолфталеина. Нагреть одну пробирку до кипения и сравнить интенсивность окраски индикатора в обеих пробирках. Дать немного остыть пробирке, затем охладить ее холодной водой. Объяснить наблюдения. Составить уравнения реакций гидролиза.
52 |
53 |
Опыт 4. Влияние концентрации соли на степень гидролиза
Налить в пробирку 1–2 мл раствора нитрата висмута. Обратить внимание на прозрачность раствора. Разбавить раствор водой в 2–3 раза и наблюдать выделение мелкокристаллического осадка. Составить уравнение реакции гидролиза, зная, что продуктом гидролиза является нитрат дигидроксовисмута.
Контрольные вопросы
1.Что называется гидролизом?
2.Какие типы гидролиза в зависимости от состава солей извест-
ны?
3.Что такое степень и константа гидролиза?
4.Какие факторы и как влияют на степень гидролиза солей?
5.Что называется водородным показателем? Каково значение рН
внейтральной, кислой и щелочной средах?
Работа 8. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Цель работы – закрепление знаний студентов о комплексных соединениях. В процессе работы студенты знакомятся с образованием различных типов комплексных соединений, устойчивостью и разрушением комплексов, приобретают навыки пользования номенклатурой комплексных соединений.
Оборудование и реактивы: спиртовка, держатель для пробирок, стеклянные палочки, пробирки; растворы с концентрацией
0,05 моль/л: K3[Fe(CN)6], FeCl3, K4[Fe(CN)6]; растворы с концентрацией 0,1 моль/л: NH4Fe(SO4)2, BaCl2, ZnSO4, Cr(NO3)3, Al2(SO4)3, Bi(NO3)3, KI, Pb(NO3)2, Na2SO4, NaCH3COO, CuSO4, Na2S, NiSO4;
растворы с концентрацией 1 моль/л: KCNS, NaCl; раствор NaOH (30%-ный), NH4OH (25%-ный); твердые вещества: CuCl2, NaCl.
Каждый студент должен выполнить несколько опытов (4–5) по указанию преподавателя. В тех опытах, где имеется несколько вариантов (а, б, в, …), студент выполняет один из них по указанию преподавателя.
Опыт 1. Различие между двойными и комплексными солями
В три пробирки налить по 1–2 мл раствора двойной соли – желе-
зоаммонийных квасцов NH4Fe(SO4)2 – и проверить наличие в растворе ионов NH4+, Fe+3, SO4−2.
Для этого в одну из пробирок прилить 0,5–1 мл раствора щелочи (KOH или NaOH) и нагреть. Определить по запаху выделение газообразного аммиака. В другую пробирку прилить несколько капель раствора KCNS или NH4CNS. Появилось ли темно-красное окрашивание раствора, свидетельствующее о наличии иона Fe+3? В третью пробирку прилить 1–2 мл раствора хлорида бария. Наблюдать выпадение белого осадка.
54 |
55 |
Написать уравнения диссоциации квасцов и уравнения реакций, доказывающих присутствие всех трех ионов в растворе.
Для сравнения в чистую пробирку налить 1–2 мл раствора комплексной соли K3[Fe(CN)6]. Добавить к этому раствору 1-2 капли KCNS или NH4CNS. Появилось ли темно-красное окрашивание раствора? Сделать вывод, присутствует ли ион железа Fe+3 в растворе или нет.
Опыт 2. Образование гидроксокомплексов
В три пробирки налить по 4-5 капель в каждую растворы сульфата цинка, нитрата хрома (III) и сульфата алюминия. В каждую пробирку по каплям добавить раствор щелочи (NaOH, 30%-ный) до выпадения осадка. Затем в эти же пробирки при постоянном помешивании содержимого стеклянной палочкой добавить избыток щелочи до растворения осадка. В результате образуются гидроксокомплексы, содержащие ионы:
[Zn(OH)4]−2; [Cr(OH)6]−3; [Al(OH)6]−3
Написатьуравненияполучениянерастворимыхосадков–гидрок- сидов металлов, а также уравнения растворения этих осадков в избытке щелочи с образованием комплексного соединения.
Дать название каждому из трех комплексных соединений.
Опыт 3. Образование соединений с комплексным анионом
1.Налить в пробирку 4-5 капель раствора нитрата висмута. Добавить к нему по каплям раствор йодида калия до выпадения осадка. Отметить цвет выпавшего осадка. Затем в эту же пробирку добавить избыток раствора KI до полного растворения осадка и образования комплексного соединения K[BiI4].
Написать в молекулярной и ионно-молекулярной формах уравнения реакций образования осадка и его растворения в избытке реактива.
Дать название получившемуся комплексному соединению.
2.Налить в пробирку 4-5 капель раствора нитрата свинца. Добавитьвэтужепробиркупокаплямрастворсульфатанатриядовыпадения осадка. Отметить цвет осадка. Затем к образовавшемуся осадку добавить по каплям раствор ацетата натрия до полного растворения
осадка и образования комплексного соединения Na2[Pb(CH3COO)4]. Написать в молекулярной и ионно-молекулярной формах уравнения реакций образования осадка и его растворения с образованием
комплексного соединения.
Дать название получившемуся комплексному соединению.
Опыт 4. Образование соединений с комплексным катионом
Налить в пробирку 4-5 капель раствора соли соответственно варианту:
а) CuSO4 ; б) ZnSO4; в) NiSO4.
К раствору соли осторожно по каплям прилить 25%-ный раствор аммиака до выпадения осадка гидроксида металла. В эту же пробирку добавить избыток раствора аммиака до растворения осадка и образования комплексного соединения:
а) [Cu(NH3)4](OH)2; б) [Zn(NH3)4](OH)2; в) [Ni(NH3)6](OH)2
Сравнить цвет раствора исходной соли и получившегося комплексного соединения.
Написать уравнения реакций образования осадка гидроксида металла и его растворения в избытке раствора аммиака.
Дать название комплексному соединению. Записать, чему равно координационное число комплексообразователя.
Опыт 5. Прочность комплексных ионов
1. Внести в пробирку небольшое количество сухого безводного хлорида меди бледно-зеленого цвета. Добавить к нему несколько капель воды при перемешивании содержимого стеклянной палочкой до получения раствора голубого цвета, обусловленного образованием тетрааквакупруматиона [Cu(H2O)4]+2.
К получившемуся раствору прилить несколько капель 25%-ного раствора аммиака. Отметить изменение цвета раствора на темносиний, что связано с переходом аквакомплекса в тетраамминкупру-
мат [Cu(NH3)4]+2.
Отметить, какой из двух комплексных ионов является более прочным. Записать уравнения реакций получения этих комплексных соединений и уравнения их диссоциации.
56 |
57 |
