
Билет 22. Гидролиз и нейтрализация
.docxБилет 22. Гидролиз и нейтрализация
Реакция нейтрализации между сильной кислотой и сильным основанием, обычно характеризуется и отрицательной энтальпией (значительным тепловыделением) и отрицательной энергией Гиббса, а потому имеет высокую степень завершенности.
|
νi |
-1 |
-1 |
1 |
1 |
|
|
KOH |
+ HNO3 |
= KNO3 |
+ H2O |
|
Δf Goi(298), ккал/моль |
-439,3 |
- 110,4 |
-392,8 |
-237,2 |
ΔrGo(298) = Σνi Δf Goi(298) = -80,3 ккал/моль
Вследствие почти полной, а потому одинаковой степени диссоциации (α → 1) сильных кислоты, основания и растворимой соли в нижеследующей полной ионно-молекулярной форме химического уравнения ионы К+ и NO3− не претерпевают изменений, а потому могут быть сокращены.
К+ + OH − + H+ + NO3− = K+ + NO3− + H2O → H+ + OH− = H2O.
Последнее уравнение отражает сущность реакции нейтрализации любой сильной кислоты любым сильным основанием, которая сводится к образованию воды из H+ и OH−, входивших в состав реагентов.
Полученный раствор имеет нейтральную реакцию (pH ≈ 7). При этом очевидно, что добавление воды с химической точки зрения ничего не меняет, а приводит только к разбавлению раствора образующейся соли.
Реакции нейтрализации, в которых хотя бы один из реагентов является слабым электролитом, не доходят до завершения, а потому при добавлении воды и изменении внешних условий возможно протекание обратной реакции.
Т.о. реакции солей с водой, обратные нейтрализации кислот и оснований называются реакциями гидролиза солей. В более широком смысле это взаимодействие вещества с водой, при котором его составные части соединяются с составными частями воды.
1. Гидролиз солей, образованных катионами сильных оснований и анионами слабых кислот (K2CO3, K2S, …).
CH3(CO)ONa + H2O = CH3(CO)OH + NaOH (молекулярная форма),
CH3(CO)O− + H2O = CH3(CO)OH + OH− (ионная форма).
Кгидр = [CH3(CO)OH] [OH−] / [CH3(CO)O−] · ([H+] / [H+]) = KW / Ka .
Константа гидролиза, определяющая равновесную степень гидролиза такой соли при очевидном преобразовании выражается через ионное произведение воды и константу ионизации кислоты.
Чем слабее образующаяся при гидролизе кислота, тем сильнее гидролиз ее солей.
2. Гидролиз соли, образованной катионом слабого основания и анионом сильной кислоты (CuCl2, AlCl3, Al2(SO4)3, …) рассмотрим на примере гидролиза NH4Cl.
NH4+ + H2O = NH4OH + H+
Кгидр = [NH4OH] [H+] / [NH4+] · [OH−] / [OH−] = KW / Kb
3. Соли слабой кислоты и слабого основания (Al2S3, Al(COO)3, Fe(CH3COO)3, …) легче других подвергаются гидролизу, т.к. их ионы связывают одновременно оба иона воды и образуют слабые электролиты.
NH4+ + CH3(CO)O− + H2O = NH4OH + CH3 (CO)OH
Кгидр = [NH4OH]·[CH3(CO)OH] / [CH3(CO)O−] [NH4+] = KW /(Ka ·Kb).
Пример: Найти pH раствора HCN, С=1 М. (pKa = 4.74 из табл. 4.1)
CN− + H2O = HCN + OH−
A− + H2O = HА + OH− Кгидр = [HA]·[OH−] / [A−] = KW / Ka;
C – x x x

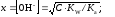

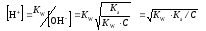 .
.
pH = 7+ 0,5·pKa – 0,5 pC = 7 + 0,5·9,4 - 0,5·0 = 11,7.
Ступенчатый гидролиз
1.Соль, содержащая многовалентный катион слабого основания
1-я ступень:
CuCl2 + H2O = CuOHCl + HCl, Cu2+ + H2O = CuOH+ + H+,
хлорид гидроксомеди (II)
2-я ступень:
CuOHCl + H2O = Cu(OH)2 + HCl, CuOH+ + H2O = Cu(OH)2 + H+.
Реакция среды – кислая, pH < 7. Гидролиз по второй ступени протекает в весьма малой степени.
2. Соль, содержащая анион слабой многоосновной кислоты и катион сильного основания.
Na2S + H2O = NaHS + NaOH S2- + H2O = HS− + OH−
NaHS + H2O = NaOH + H2S HS− + H2O = OH− + H2S.
Реакция среды – щелочная, pH>7.
Особые случаи гидролиза PCl3, PCl5, PBr3, SO2Cl2 и других солей, которые часто идут до конца с образованием двух кислот, например:
PBr3 + 3H2O = 3HBr + H3PO4
SO2Cl2 + 2H2O = 2HCl + H2SO4
Гидролиз органических соединений широко используется для промышленного получения спиртов (этилового), альдегидов, кетонов, карбоновых кислот и др.
R – Hal + H2O = ROH + H+ + Hal−;
R−C=O OR' + H2O = R−C=O OH + R'OH;
и т. д.
По аналогии со степенью диссоциации может быть введена и рассчитана степень гидролиза h с параллельным расчетом рН среды. Несколько таких примеров представлено ниже.
-
NH4Cl: h = 0,007%, рН = 5,3;
-
СН3(СО)О NH4: h = 0,5%, рН = 7,0;
-
КСN: h = 1,2%, рН = 11,3;
-
Na3 PO4: h = 34%, рН = 12…
